Влияние терапии бисфосфонатами на уровень маркеров костного метаболизма у пациентов с остеопорозом
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить влияние золедроновой кислоты на уровень маркеров костного обмена и сопоставить полученные данные с динамикой МПК за весь период лечения.
Материал и методы. В когортное открытое проспективное исследование было включено 100 женщин с постменопаузальным остеопорозом, получавших золедроновую кислоту в дозе 5 мг один раз в год в течение трех лет.
Минеральная плотность костной ткани оценивалась в динамике – до терапии, через один, два и три года на основании результатов двухэнергетической рентгеновской абсорбциометрии (DXA) (денситометр HOLOGIC Discovery Wi) в двух точках – в поясничном отделе позвоночника (L1–L4) и шейке бедра.
Все женщины подписали информированное согласие на участие в исследовании и обработку обезличенных персональных данных.
Наряду с традиционными лабораторными методами обследования в динамике оценивались маркеры костного обмена (кальций, фосфор крови, паратгормон, витамин D (25 (ОН)), кальций общий и ионизированный, дезоксипиридинолин мочи, C-концевой телопептид коллагена 1, остеокальцин, магний, фосфор, щелочная фосфатаза).
Статистический анализ полученных данных проводили с использованием программ IBM SPSS Statistics 26 (SPSS Inc., США) и StatTech v. 3.1.8 (ООО «Статтех», Россия).
Результаты. У обследованных пациенток до терапии наблюдались низкие показатели МПК в L1–L4 (-3,4 (95% ДИ -3,9– -2,9) SD) и шейке бедра (-3,1 (95% ДИ -3,4– -2,8) SD). Риск переломов по FRAX составлял 37,0 (95% ДИ 15,0–32,5)%, что соответствует высокому риску.
До проведения антиостеопоротической терапии отмечались высокие показатели маркеров костеобразования.
Через три года лечения у получавших золедроновую кислоту зафиксировано достоверное повышение МПК в бедре в целом (-2,6 (95% ДИ -2,8– -2,5) SD) и поясничном отделе позвоночника (-2,7 (95% ДИ -3,0– -2,5) SD).
Прирост МПК в поясничном отделе позвоночника в среднем составил 4,5%, в шейке бедра – 2,4%, в проксимальном отделе бедра в целом – 3,1%. Кроме того, статистически значимо снизилась концентрация C-концевого телопептида коллагена 1 (р < 0,001), остеокальцина (р < 0,001) и дезоксипиридинолина в моче (р < 0,001), а также щелочной фосфатазы (р < 0,001).
Лечение золедроновой кислотой привело к сокращению риска повторных переломов.
Серьезных нежелательных явлений на фоне проводимой терапии зарегистрировано не было.
Заключение. Применение в течение трех лет золедроновой кислоты способствовало снижению риска повторных переломов по DXA. Кроме того, было показано статистически значимое снижение уровня биохимических маркеров костного обмена.
Цель исследования – оценить влияние золедроновой кислоты на уровень маркеров костного обмена и сопоставить полученные данные с динамикой МПК за весь период лечения.
Материал и методы. В когортное открытое проспективное исследование было включено 100 женщин с постменопаузальным остеопорозом, получавших золедроновую кислоту в дозе 5 мг один раз в год в течение трех лет.
Минеральная плотность костной ткани оценивалась в динамике – до терапии, через один, два и три года на основании результатов двухэнергетической рентгеновской абсорбциометрии (DXA) (денситометр HOLOGIC Discovery Wi) в двух точках – в поясничном отделе позвоночника (L1–L4) и шейке бедра.
Все женщины подписали информированное согласие на участие в исследовании и обработку обезличенных персональных данных.
Наряду с традиционными лабораторными методами обследования в динамике оценивались маркеры костного обмена (кальций, фосфор крови, паратгормон, витамин D (25 (ОН)), кальций общий и ионизированный, дезоксипиридинолин мочи, C-концевой телопептид коллагена 1, остеокальцин, магний, фосфор, щелочная фосфатаза).
Статистический анализ полученных данных проводили с использованием программ IBM SPSS Statistics 26 (SPSS Inc., США) и StatTech v. 3.1.8 (ООО «Статтех», Россия).
Результаты. У обследованных пациенток до терапии наблюдались низкие показатели МПК в L1–L4 (-3,4 (95% ДИ -3,9– -2,9) SD) и шейке бедра (-3,1 (95% ДИ -3,4– -2,8) SD). Риск переломов по FRAX составлял 37,0 (95% ДИ 15,0–32,5)%, что соответствует высокому риску.
До проведения антиостеопоротической терапии отмечались высокие показатели маркеров костеобразования.
Через три года лечения у получавших золедроновую кислоту зафиксировано достоверное повышение МПК в бедре в целом (-2,6 (95% ДИ -2,8– -2,5) SD) и поясничном отделе позвоночника (-2,7 (95% ДИ -3,0– -2,5) SD).
Прирост МПК в поясничном отделе позвоночника в среднем составил 4,5%, в шейке бедра – 2,4%, в проксимальном отделе бедра в целом – 3,1%. Кроме того, статистически значимо снизилась концентрация C-концевого телопептида коллагена 1 (р < 0,001), остеокальцина (р < 0,001) и дезоксипиридинолина в моче (р < 0,001), а также щелочной фосфатазы (р < 0,001).
Лечение золедроновой кислотой привело к сокращению риска повторных переломов.
Серьезных нежелательных явлений на фоне проводимой терапии зарегистрировано не было.
Заключение. Применение в течение трех лет золедроновой кислоты способствовало снижению риска повторных переломов по DXA. Кроме того, было показано статистически значимое снижение уровня биохимических маркеров костного обмена.



Введение
Остеопороз (ОП) – метаболическое заболевание костной системы, единственным клиническим проявлением которого являются патологические переломы, представляющие серьезную медико-социальную проблему в связи с ухудшением качества жизни пациентов, инвалидизацией и повышенным риском смерти среди пожилого населения [1]. Согласно критериям Всемирной организации здравоохранения, остеопороз определяют как минеральную плотность кости (МПК) с Т-показателем ≤ -2,5 в позвоночнике и шейке бедренной кости [2]. В настоящее время ОП страдают более 200 млн населения мира.
Важная роль в профилактике ОП отводится коррекции модифицируемых факторов риска. Речь, в частности, идет о дефиците витамина D, курении и употреблении алкоголя, низком потреблении кальция и фосфора, дефиците или избытке белка в рационе, чрезмерном потреблении кофе, малоподвижном образе жизни или неподвижности, а также недостаточном воздействии солнечного света.
Медикаментозное лечение остеопороза включает бисфосфонаты, препараты кальция и витамина D3, терипаратид.
Согласно данным эпидемиологических исследований, приверженность антиостеопоротической терапии составляет 30–50% [3–5].
Определение маркеров костного метаболизма показано не только для диагностики ОП, но и для контроля приверженности лечению, в том числе в динамике [6].
Костный метаболизм характеризуется двумя взаимосвязанными процессами: образованием новой костной ткани остеобластами и разрушением (резорбцией) старой костной ткани остеокластами. Маркеры костного метаболизма высвобождаются во время цикла ремоделирования кости и измеряются в крови или моче, что отражает скорость ремоделирования [7]. В процессе ремоделирования остеобласты синтезируют и выделяют в циркулирующую кровь ряд белков, ферментов, цитокинов и факторов роста. К маркерам костеобразования относятся остеокальцин, карбокси- и аминоконцевые пропептиды проколлагена 1 (P1CP, P1NP), общая щелочная фосфатаза и ее костный изофермент (bALP).
При резорбции костной ткани остеокластами образуются продукты деградации, которые также попадают в циркулирующую кровь и в дальнейшем выводятся с мочой. К маркерам резорбции кости относятся окси- и дезоксипиридинолины (PYR, DPYR), гидроксипролин (OHPr) и кальций в моче, N- и C-телопептиды молекул коллагена 1 (NTX, CTX) в сыворотке крови или моче [8].
С учетом того что в настоящее время, во-первых, наиболее часто при ОП используют бисфосфонаты (золедроновую кислоту), которые доказали свою эффективность в снижении риска переломов в ходе многочисленных рандомизированных клинических исследований [9–12], во-вторых, в полной мере не оценена значимость динамического контроля показателей костного метаболизма [13], нами было проведено исследование с целью определения влияния золедроновой кислоты на уровень маркеров костного обмена и сопоставления этих данных с изменением МПК через один, два и три года терапии.
Материал и методы
В когортное открытое проспективное исследование были включены 100 пациенток с постменопаузальным ОП, получавших золедроновую кислоту внутривенно капельно по 5 мг один раз в год в течение трех лет. Минеральная плотность костной ткани оценивалась в динамике – до и через один, два, три года лечения. Для этого в двух точках – в поясничном отделе позвоночника (L1–L4) и шейке бедра проводили двухэнергетическую рентгеновскую абсорбциометрию (DXA) на аппарате HOLOGIC Discovery Wi.
Все женщины подписали информированное согласие на участие в исследовании и обработку обезличенных персональных данных.
У пациенток до, а также через один, два и три года терапии золедроновой кислотой помимо традиционного лабораторного обследования оценивали маркеры костного метаболизма (кальций, фосфор крови, паратгормон, витамин D (25 (ОН)), кальций общий и ионизированный, дезоксипиридинолин мочи, C-концевой телопептид коллагена 1, остеокальцин, магний, фосфор, щелочную фосфатазу).
Полученные результаты анализировали с использованием программ IBM SPSS Statistics 26 (SPSS Inc., США) и StatTech v. 3.1.8 (ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро – Уилка при количестве исследуемых менее 50 или критерия Колмогорова – Смирнова при количестве исследуемых более 50. Количественные показатели, имеющие нормальное распределение, описывали с помощью среднего арифметического (M) и стандартного отклонения (SD) с указанием границ 95%-ного доверительного интервала (ДИ). В отсутствие нормального распределения количественные данные описывали с помощью медианы (Me), а также нижнего и верхнего квартилей (Q1–Q3). Категориальные данные представляли с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполняли с помощью U-критерия Манна – Уитни. При сравнении двух количественных показателей, распределение которых отличалось от нормального, в двух связанных группах использовали критерий Уилкоксона. Направление и тесноту корреляционной связи между двумя количественными показателями оценивали с помощью коэффициента ранговой корреляции Спирмена (при распределении показателей, отличном от нормального). Прогностическая модель, характеризующая зависимость количественной переменной от факторов, создавалась с помощью метода линейной регрессии. Бинарные показатели, характеризующие более двух связанных совокупностей, сравнивали с помощью Q-критерия Кохрена. Апостериорный анализ проводился с использованием теста МакНемара c поправкой Холма.
Различия считались статистически значимыми при p < 0,05.
Результаты
Характеристика исследуемой группы представлена в табл. 1. Средний возраст пациенток с ОП составил 63,7 (95% ДИ 62,3–65,1) года, длительность менопаузы – 15,0 (95% ДИ 10,0–21,0) года, индекс массы тела – 27,90 ± 2,42 (95% ДИ 27,40–28,40) кг/м2.
У всех пациенток помимо терапии препаратами кальция и витамина D проводилась инфузия золедроновой кислоты в дозе 5 мг внутривенно капельно один раз в год в течение трех лет.
Всем пациенткам также проведена стратификация абсолютного десятилетнего риска развития основных остеопоротических переломов с использованием FRAX-калькулятора. FRAX составил 37 (95% ДИ 15,0–32,50; р < 0,001)%, что соответствует высокому риску переломов.
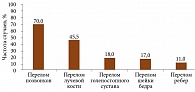
Анализ частоты остеопоротических переломов показал, что у всех женщин имел место один и более остеопоротический перелом (рис. 1). Наиболее часто пациентки переносили переломы позвонков (70,0%) и лучевой кости (45,5%). Реже случались переломы голеностопного сустава (18%), шейки бедра (17,0%) и ребер (11,0%). Следует отметить, что у 88% женщин в анамнезе были зафиксированы предшествующие переломы различной локализации.
При оценке показателей костного метаболизма до лечения выявлены недостаток витамина D – 42,9 (95% ДИ 23,2–65,2) нг/мл, высокий уровень щелочной фосфатазы – 156,5 (95% ДИ 123,0–167,5) Ед/л. До терапии содержание маркеров резорбции костной ткани также было высоким. В частности, уровень C-концевого телопептида коллагена 1 составлял 2,9 (95% ДИ 2,2–3,5) нг/мл, дезоксипиридинолина в моче – 8,4 (95% ДИ 7,9–8,9; р < 0,001) нмоль/мл, остеокальцина – 56,0 (95% ДИ 54,0–66,0) нг/мл.
При оценке динамики показателей МПК на фоне проводимой терапии золедроновой кислотой в L1–L4 и проксимальном отделе бедренной кости отмечалось статистически значимое улучшение относительно исходных значений (табл. 2).
В исследуемой группе установлено статистически значимое снижение концентрации C-концевого телопептида коллагена 1 (р < 0,001), остеокальцина (р < 0,001) и дезоксипиридинолина в моче (р < 0,001) через один, два и три года наблюдения, а также щелочной фосфатазы через три года от начала лечения (р < 0,001) (табл. 3).
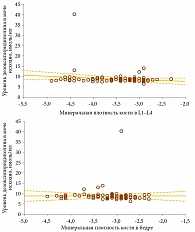
Выявлена обратная сильная связь между показателями МПК в оцениваемых областях скелета и уровнем дезоксипиридинолина в моче (рис. 2).
У получавших золедроновую кислоту не были зарегистрированы повторные переломы.
Серьезных нежелательных явлений за период наблюдения зафиксировано не было.
Частота гриппоподобного синдрома в исследуемой группе после первой инфузии составила 6%, после второй (через 12 месяцев) – 4%, после третьей (через 24 месяца) – 2%.
Обсуждение результатов
У обследованных пациенток до начала терапии наблюдались низкие показатели МПК в L1–L4 и шейке бедра – -3,4 (95% ДИ -3,9– -2,9) и -3,1 (95% ДИ -3,4– -2,8) SD соответственно. Риск переломов, согласно FRAX, составил 37,0 (95% ДИ 15,0–32,5)%, то есть риск стратифицирован как высокий. Кроме того, отмечались высокие показатели маркеров костеобразования.
Через три года лечения у женщин с ОП зафиксировано достоверное повышение МПК в поясничном отделе позвоночника и проксимальном отделе бедренной кости. Прирост МПК в поясничном отделе позвоночника в среднем составил 4,5%, в шейке бедра – 2,4%, в проксимальном отделе бедра в целом – 3,1%.
Важно отметить статистически значимое снижение концентрации C-концевого телопептида коллагена 1 (р < 0,001), остеокальцина (р < 0,001) и дезоксипиридинолина в моче (р < 0,001) через один, два и три года наблюдения, а также щелочной фосфатазы через три года от начала лечения (р < 0,001).
Выявлена также обратная сильная корреляция между показателями МПК в L1–L4 и проксимальном отделе бедренной кости и уровнем дезоксипиридинолина в моче, что свидетельствует о значимости исследования этого параметра в динамике у пациентов с ОП на фоне терапии бисфосфонатами для оценки ее эффективности.
Заключение
В нашем исследовании продемонстрировано, что терапия золедроновой кислотой у пациентов с ОП способствовала статистически значимому снижению уровня маркеров костной резорбции и риска повторных переломов позвонков и проксимального отдела бедренной кости по DXA за три года наблюдения. Кроме того, нами установлена значимость динамической оценки показателей дезоксипиридинолина в моче как маркера эффективности применения золедроновой кислоты при ОП.
E.S. Zhugrova, PhD, V.I. Mazurov, Academician of the RASci., MD, PhD, Prof., I.B. Belyayeva, MD, PhD, Prof., D.A. Shimanski
North-Western State Medical University named after I.I. Mechnikov
Academician I.P. Pavlov First St. Petersburg State Medical University
Contact person: Elena S. Zhugrova, jugrova@mail.ru
Osteoporosis is a metabolic disease of the skeletal system that currently affects more than 200 million patients worldwide. World Health Organization criteria define osteoporosis as low bone mineral density (BMD) with a T-score ≤ -2.5, found in the spine, femoral neck. Osteoporosis significantly reduces the patient's quality of life and leads to disability.
Purpose – to study the effect of zoledronic acid on the level of bone turnover markers and compare these data with the dynamics of BMD over the entire period of treatment.
Material and methods. A cohort open prospective study included 100 women with postmenopausal osteoporosis receiving zoledronic acid 5 mg once a year for 3 years.
Bone mineral density was assessed over time before therapy, after 1, 2, 3 years based on dual-energy X-ray absorptiometry (DXA) (densitometer HOLOGIC Discovery Wi), at 2 points – in the lumbar spine (L1–L4) and the femoral neck.
All women signed informed consent to participate in the study and process anonymized personal data.
Along with traditional laboratory examination methods, markers of bone metabolism (calcium, phosphorus in the blood, parathyroid hormone, 25(OH) vitamin D, total and ionized calcium, deoxypyridinoline in urine, C-terminal telopeptide, type 1 collagen, osteocalcin, magnesium, phosphorus, alkaline phosphatase) were determined in dynamics.
Statistical analysis was carried out using the programs IBM SPSS Statistics 26 (SPSS Inc., USA) and StatTech v. 3.1.8 (Stattech LLC, Russia).
Results. The examined patients had low BMD values in L1–L4 (-3.4 (95% CI -3.9– -2.9) SD) and femoral neck (-3.1 (95% CI -3.4– -2.8) SD) before therapy. The risk of fractures according to FRAX was 37% (95% CI 15.00–32.50), which corresponds to a high risk.
Prior to osteopathic therapy, high rates of bone formation markers were noted.
After 3 years of treatment, in the group of women receiving zoledronic acid, there was a significant increase in BMD of the hip as a whole (-2.6 (95% CI -2.8– -2.5) SD) and the lumbar spine (-2.7 (95% CI -3.0– -2.5) SD).
The increase in BMD in the lumbar spine averaged 4.5%, in the femoral neck – 2.4%, in the proximal femur as a whole – 3.1%. In addition, the concentration of type 1 collagen C-terminal telopeptide (p < 0.001), osteocalcin (p < 0.001) and deoxypyridinoline (p < 0.001), as well as alkaline phosphatase (p < 0.001) significantly decreased.
Treatment with zoledronic acid in subgroup 1 resulted in a reduction in the risk of recurrent fractures.
No serious adverse events were recorded during the therapy.
Conclusion. The use of zoledronic acid for 3 years helped to reduce the risk of repeated fractures according to DXA. In addition, a statistically significant decrease in the levels of biochemical markers of bone turnover was shown.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.