Патофизиологические механизмы формирования фибрилляции предсердий при синдроме апноэ сна
- Аннотация
- Статья
- Ссылки
- English
Актуальность
Фибрилляция предсердий (ФП) – хаотические, нерегулярные возбуждения отдельных предсердных мышечных волокон или их групп с утратой механической систолы предсердий и нерегулярными, не всегда полноценными возбуждениями и сокращениями миокарда желудочков [1]. На протяжении последних нескольких десятилетий отмечается резкое увеличение частоты случаев ФП, преимущественно ее пароксизмальной формы. В России в 2019 г. насчитывалось около 2,5 млн пациентов с ФП (1,7% популяции) [2]. В отсутствие своевременного лечения данное нарушение сердечного ритма может привести к таким осложнениям, как инсульт, инфаркт миокарда, сердечная недостаточность.
Нарушение регуляции дыхания во сне, в частности синдром обструктивного апноэ сна (СОАС), признается модифицируемым фактором, способствующим развитию ФП. Результаты крупномасштабных исследований, выполненных методом менделевской рандомизации, показали более высокий риск развития ФП при генетически обусловленном СОАС и подтвердили роль ожирения в развитии сердечной аритмии [3, 4]. По данным разных групп исследователей, СОАС определяется у 21–74% пациентов с ФП [5, 6] и остается недиагностированным у 66% пациентов с персистирующей формой ФП [7]. У пациентов с ожирением эпизоды впервые возникшей ФП регистрируются в два раза чаще при наличии СОАС [8].
При постоянной форме ФП, особенно у лиц мужского пола старше 60 лет с хронической сердечной недостаточностью, гипотиреозом, чаще выявляется дыхание Чейна – Стокса с центральными апноэ [9]. Опубликованы данные, объединяющие результаты двух исследовательских групп, изучавших частоту встречаемости СОАС и дыхания Чейна – Стокса с центральными апноэ во сне при различных вариантах дисфункции левого желудочка [10]. Если сравнить выявляемость дыхания Чейна – Стокса у бессимптомных больных с систолической и диастолической дисфункцией (n = 47), то в первом случае она несколько больше – 11 против 4% [11]. Если проанализировать встречаемость дыхания Чейна – Стокса в зависимости от значений фракции выброса левого желудочка (n = 352), то такая форма расстройства дыхания во сне диагностируется у 33% пациентов с сохраненной фракцией выброса и у 24% пациентов – с низкой [12].
Патофизиологическая связь между ФП и синдромами апноэ сна долгое время оставалась спекулятивной. Определенную ясность внесли результаты экспериментальных работ на животных, цель которых состояла в моделировании повторяющихся эпизодов апноэ для изучения роли различных пусковых факторов в возникновении ФП [13].
Патофизиологическая взаимосвязь ФП и СОАС
Пусковым фактором возникновения периодического дыхания с эпизодами апноэ обструктивного типа служит коллапс верхних дыхательных путей и стенок глотки. Патофизиологические механизмы, лежащие в основе аритмогенеза при СОАС, условно можно разделить на три группы:
- непосредственные (или острые) реакции;
- опосредованные (или подострые) эффекты;
- хронические эффекты [11].
К остро возникающим реакциям относят:
- хроническую интермиттирующую гипоксию и гиперкапнию;
- резкие колебания тонуса симпатического и парасимпатического отделов автономной нервной системы в разные фазы сна, на протяжении эпизода апноэ и после него;
- микропробуждения, которые прерывают апноэ и помогают восстановить поток воздуха;
- быстрые перепады внутригрудного давления и изменения градиентов внутрисердечного трансмурального давления при каждом усилии вдоха и выдоха.
Все эти многократно повторяющиеся изменения, связанные с остановками дыхания во время сна, способствуют возникновению и быстрому прогрессированию системной гипертензии, диастолической дисфункции левого желудочка, ремоделированию левого предсердия и сердечной недостаточности. Вместе с тем каждое из перечисленных состояний может самостоятельно предрасполагать к развитию ФП. Так, хроническая интермиттирующая гипоксия и гиперкапния сокращают эффективный рефрактерный период предсердий; повышение симпатического тонуса предрасполагает к эктопической активности, вызывая изменения в экспрессии ионных каналов кардиомиоцитов; колебания отрицательного внутригрудного давления во время апноэ способствуют эктопической активности за счет растяжения предсердий и их дальнейшего структурного ремоделирования.
К опосредованным (подострым) эффектам относят структурное и электрофизиологическое ремоделирование миокарда предсердий, что сопровождается неуклонным прогрессированием системного воспаления и окислительного стресса.
Структурное ремоделирование проявляется расширением полости левого предсердия, увеличением давления и трансмурального градиента в полости левого желудочка, возрастанием венозного возврата крови к сердцу. Под электрофизиологическим ремоделированием миокарда понимают уменьшение времени эффективного рефрактерного периода предсердий, динамическое удлинение интервала QT на поверхностной электрокардиограмме, укорочение временной задержки между окончанием механического сокращения и электрической активацией сердца, возникновение ранних и отсроченных постдеполяризаций.
Системное воспаление и окислительный стресс являются общепризнанными факторами патогенеза сердечно-сосудистых заболеваний. Ключевая роль в этом процессе отводится накоплению эпикардиальной жировой ткани, непосредственно прилежащей к миокарду предсердий [14]. При этом риск развития ФП повышается за счет:
- жировой инфильтрации субэпикардиального слоя миокарда предсердий;
- активации вегетативных нервных сплетений, приводящей к укорочению потенциала действия, ускорению транспорта кальция в кардиомиоциты предсердий;
- развития и поддержания местной воспалительной реакции на фоне увеличения продукции интерлейкинов и фактора некроза опухоли альфа;
- увеличения выработки активных форм кислорода.
СОАС может рассматриваться как хроническое вялотекущее воспалительное заболевание, ключевым проявлением которого считается интермиттирующая гипоксия, способствующая индукции факторов транскрипции (ядерного фактора каппа B и ядерного фактора для экспрессии интерлейкинов) [15]. Экспрессия провоспалительных цитокинов способствует миграции лейкоцитов к эндотелию сосудов и увеличению числа адгезивных молекул на поверхности клеток. Дополнительно к развитию сосудистого воспаления приводит увеличение продукции активных форм кислорода и перекисного окисления липидов.
Длительное отсутствие лечения СОАС ассоциируется с возникновением хронических эффектов: увеличения объема эпикардиальной жировой ткани, прогрессирования метаболических нарушений, хронического воспаления и фиброза. Ремоделирование щелевых контактов в миокарде предсердий (коннексины), активация сигнальных путей инфламмасомы NLRP3 (NLR family pyrin domain containing 3) служат потенциальными медиаторами повышенной уязвимости к развитию ФП при СОАС [16].
Зависимость между тяжестью синдрома апноэ сна и темпом прогрессирования ремоделирования левого предсердия у человека остается недостаточно изученной. Предполагается участие в данном процессе генетических механизмов.
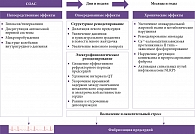
Многоуровневая схема патофизиологических механизмов возникновения ФП при СОАС представлена на рисунке.
Патофизиологическая взаимосвязь ФП и дыхания Чейна – Стокса с центральными апноэ
Пусковым фактором возникновения периодического дыхания с эпизодами апноэ центрального типа являются нарушения регуляторных механизмов между периферическими хеморецепторами (преимущественно на уровне каротидных телец в области бифуркации сонных артерий) и центральными (медуллярными) хеморецепторами. Для дыхания Чейна – Стокса характерен особый вид фазы гипервентиляции, состоящей из четырех и более дыхательных циклов, образующих паттерн «крещендо – декрещендо». При этом длительность цикла периодического дыхания должна составлять не менее 40 с, обычно от 45 до 90 с (измерения проводятся от начала фазы апноэ до окончания фазы гипервентиляции) [13]. Патофизиологическая взаимосвязь этой формы синдрома центрального апноэ сна и ФП изучена меньше.
Результаты нескольких исследований подтвердили повышенную частоту возникновения ФП у пациентов с синдромом центрального апноэ сна [17]. В таких случаях пусковые факторы возникновения ФП во многом схожи с таковыми при СОАС. К ним относят гипоксию и колебания уровня углекислого газа, микропробуждения, повышенную симпатическую и нейрогуморальную активность, окислительный стресс и хроническое воспаление. Различия заключаются в следующем. Резкие колебания дыхательного объема в фазы гипер- и гиповентиляции и уровня углекислого газа поддерживают высокую активность симпатического отдела автономной нервной системы, повышается концентрация предсердного натрийуретического пептида. Избыток катехоламинов приводит к учащению частоты сердечных сокращений и пульса, повышению уровня системного артериального давления и повышенной потребности миокарда в кислороде. Создаются все предпосылки для аритмогенеза. Со временем нейрогуморальные нарушения способствуют ремоделированию предсердий вследствие окислительного стресса, воспаления и электрической нестабильности. Повышенный симпатический тонус, интермиттирующая гипоксия и механическая нагрузка на миокард предсердий формируют уязвимый субстрат в предсердиях, риск развития ФП повышается.
Анализ опубликованных данных свидетельствует об отсутствии какого-либо уникального патофизиологического субстрата, предрасполагающего к развитию ФП при нарушениях регуляции дыхания во время сна.
O.V. Lyshova, PhD, Prof.
N.N. Burdenko Voronezh State Medical University
Contact person: Olga V. Lyshova, dr-lyshova@mail.ru
There is a two-way relationship between atrial fibrillation and sleep-disordered breathing. Current data reflecting the main pathways of the pathogenesis of atrial fibrillation in obstructive sleep apnea syndrome and Cheyne – Stokes respiration with central apnea are presented. Acute, subacute, and chronic effects leading to structural and electrophysiological remodeling of the atria are discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.