Влияние системного воспаления на распространенность дефицита железа у пациентов с фибрилляцией предсердий, находящихся на двойной антитромботической терапии
- Аннотация
- Статья
- Ссылки
- English
Цель. Изучить встречаемость ДЖ, витамина В12 и фолатов, а также влияние воспаления на распространенность ДЖ у пациентов с ФП и ИБС, находящихся на двойной антитромботической терапии (ДАТ).
Материал и методы. В проспективное открытое когортное исследование были включены 126 пациентов с ФП и ИБС (средний возраст 69,5 (63; 76) года, 62,7% мужчин), находящихся на ДАТ. Всем пациентам были проведены клинический и биохимический анализы крови с определением показателей обмена железа, витамина В12 и фолатов. Также проводилась оценка индексов воспаления – индекса системного иммунного воспаления, соотношения моноцитов к холестерину липопротеидов высокой плотности, соотношения тромбоцитов к лимфоцитам, соотношения нейтрофилов к лимфоцитам, соотношения моноцитов к лимфоцитам, индекса системного воспалительного ответа и совокупного индекса системного воспаления.
Результаты. ДЖ был диагностирован у 27,8% пациентов, которые составили первую группу; вторую группу – пациенты без ДЖ (n = 91). Функциональный дефицит витамина В12 выявлен у 16,7% пациентов, а дефицит фолатов – у 23,8%. Индекс коморбидности Чарлсона был выше в первой группе (6,0 (5,0; 7,0) баллов против 5,0 (4,0; 6,0), p = 0,044), чем во второй. Показатели воспалительных индексов и лейкоцитов в группе с ДЖ также были выше, чем у пациентов без него, однако различия оказались статистически незначимы.
Заключение. Дефицит железа и витаминов В12 и В9 широко распространен у пациентов с ФП, находящихся на ДАТ. Ключевым фактором ДЖ является системное воспаление, наиболее доступной оценкой выраженности которого являются воспалительные индексы.
Цель. Изучить встречаемость ДЖ, витамина В12 и фолатов, а также влияние воспаления на распространенность ДЖ у пациентов с ФП и ИБС, находящихся на двойной антитромботической терапии (ДАТ).
Материал и методы. В проспективное открытое когортное исследование были включены 126 пациентов с ФП и ИБС (средний возраст 69,5 (63; 76) года, 62,7% мужчин), находящихся на ДАТ. Всем пациентам были проведены клинический и биохимический анализы крови с определением показателей обмена железа, витамина В12 и фолатов. Также проводилась оценка индексов воспаления – индекса системного иммунного воспаления, соотношения моноцитов к холестерину липопротеидов высокой плотности, соотношения тромбоцитов к лимфоцитам, соотношения нейтрофилов к лимфоцитам, соотношения моноцитов к лимфоцитам, индекса системного воспалительного ответа и совокупного индекса системного воспаления.
Результаты. ДЖ был диагностирован у 27,8% пациентов, которые составили первую группу; вторую группу – пациенты без ДЖ (n = 91). Функциональный дефицит витамина В12 выявлен у 16,7% пациентов, а дефицит фолатов – у 23,8%. Индекс коморбидности Чарлсона был выше в первой группе (6,0 (5,0; 7,0) баллов против 5,0 (4,0; 6,0), p = 0,044), чем во второй. Показатели воспалительных индексов и лейкоцитов в группе с ДЖ также были выше, чем у пациентов без него, однако различия оказались статистически незначимы.
Заключение. Дефицит железа и витаминов В12 и В9 широко распространен у пациентов с ФП, находящихся на ДАТ. Ключевым фактором ДЖ является системное воспаление, наиболее доступной оценкой выраженности которого являются воспалительные индексы.

Введение
Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смертности и стойкой инвалидизации населения во всем мире [1, 2]. При этом наибольший вклад в увеличение бремени для здравоохранения вносят фибрилляция предсердий (ФП) и ишемическая болезнь сердца (ИБС), в особенности острый коронарный синдром (ОКС) [1, 2]. Распространенность ФП и ИБС на фоне старения населения за последние 30 лет увеличилась практически в два раза [1]. Так, по данным исследований, частота встречаемости ФП во всем мире составляет от 0,3 до 7,2%, возрастая до 9% у лиц старше 80 лет [3–7]. А распространенность ИБС, по результатам исследования Global Burden of Disease (GBD) [8], составила 3605 (2892–4454) на 100 000 населения. При этом стоит отметить, что у пациентов с ФП риск развития ИБС и, в особенности, инфаркта миокарда (ИМ) был выше в два раза по сравнению с лицами без аритмии [9–11]. А по данным датского когортного исследования [12] (n = 103 989), у пациентов с впервые выявленными ФП или трепетанием предсердий кумулятивный риск ИМ за 10 лет составил 3,5%. В свою очередь, у пациентов с ИМ риск развития ФП также значимо повышается [13, 14]. Так, в исследовании Cardiac Arrhythmias and Risk Stratification After Myocardial Infarction (CARISMA) [13] (n = 5869, период наблюдения 2 года) у пациентов после перенесенного ИМ частота впервые выявленной ФП достигла 28%. Наличие ФП в сочетании с ИБС ассоциировано с увеличением риска развития сердечно-сосудистых осложнений и неблагоприятного исхода, что указывает на необходимость комплексного подхода к ведению таких пациентов [10–14].
Помимо общих факторов риска, ФП и ИБС имеют схожие патофизиологические механизмы развития, что объясняет двунаправленную взаимосвязь между этими заболеваниями. Одним из таких механизмов является хроническое системное воспаление [15–17]. По данным исследований, воспаление, вызывающее возникновение фиброза предсердий и гиперкоагуляцию, способствует электрическому и структурному ремоделированию предсердий, что в свою очередь может привести к развитию ФП [18, 19]. Повышенные уровни провоспалительных цитокинов, включая С-реактивный белок (СРБ), фактор некроза опухоли-α (ФНО-α) и интерлейкин 6 (ИЛ-6), не только ассоциированы с высоким риском дебюта ФП, но и являются независимыми предикторами развития сердечно-сосудистых событий, в том числе ИМ у пациентов с данным нарушением ритма [19–21]. Также широко известна роль воспаления в патогенезе атеросклероза [15–17]. Например, ОКС с последующим развитием нестабильной стенокардии или ИМ, согласно данным публикаций, во многом обусловлен повышением концентрации провоспалительных цитокинов и клеток воспалительного ряда, что приводит к эрозии и дестабилизации атеросклеротической бляшки, ее разрыву и ухудшению прогноза у пациентов [15–17]. В исследовании P.M. Ridker и соавт. [15] (n = 1086 здоровых мужчин, средний возраст 59 ± 9,2 года, период наблюдения 14 лет) исходная концентрация СРБ была выше у лиц, у которых впоследствии развился ИМ (1,51 против 1,13 мг/л, p < 0,001). При этом высокий уровень СРБ у мужчин был статистически значимо ассоциирован с увеличением риска ИМ в три раза (относительный риск (ОР) 2,9; p < 0,001) [15].
В настоящее время особое внимание уделяется дефициту железа (ДЖ) у лиц с сердечно-сосудистой патологией, часто возникающему на фоне хронического низкоинтенсивного воспаления. В основе его развития лежит влияние провоспалительных маркеров на гомеостаз железа путем стимуляции выработки гепсидина и уменьшения таким образом доступного для эритропоэза железа [22, 23]. По данным опубликованных на настоящий момент исследований показано, что ДЖ оказывает неблагоприятное влияние на течение и прогноз у лиц с сердечной недостаточностью (СН) [24–27]. А коррекция ДЖ с помощью внутривенного введения препаратов железа, в свою очередь, не только улучшает качество жизни, но и снижает риск госпитализации по поводу СН, а также смертность от ССЗ у пациентов с СН и ДЖ, даже при отсутствии анемии [24–27]. ФП и ИБС являются одними из основных этиологических факторов развития СН. Несмотря на это, распространенность ДЖ у пациентов с ФП в сочетании с ИБС, а также его влияние на течение заболеваний практически не изучалось, однако имеются основания полагать, что ДЖ может способствовать ухудшению качества жизни пациентов как при ФП, так и при ИБС, а также оказывать негативное влияние на прогноз [28, 29].
Помимо ДЖ, с ухудшением прогноза, в частности с повышением риска инсульта у пациентов с ФП, ассоциирована недостаточность таких витаминов, как В9 (фолиевая кислота) и В12 [30, 31].
Целью данного исследования, исходя из вышеизложенного, стали изучение частоты встречаемости ДЖ, витамина В12 и фолатов, а также оценка влияния воспаления на распространенность ДЖ у пациентов с ФП, находящихся на двойной антитромботической терапии (ДАТ).
Материал и методы
В проспективное открытое когортное исследование были включены 126 пациентов с ФП (средний возраст 69,5 (63; 76), 62,7% мужчин), находящихся на ДАТ.
Критерии включения в исследование: пациенты обоего пола, возраст ≥ 18 лет; неклапанная ФП, риск по шкале CHA2DS2-VASc ≥ 1 балла для мужчин и ≥ 2 баллов для женщин; подтвержденный прием прямого орального антикоагулянта (ривароксабан, апиксабан или дабигатрана этексилат) в сочетании с любым антиагрегантом (ацетилсалициловая кислота или клопидогрел, или тикагрелор, или прасугрел) [32].
Критерии невключения в исследование: обратимые причины ФП, беременность, лактация, наличие выраженной почечной и/или печеночной недостаточности, клинически значимое кровотечение на момент включения в исследование, наличие системной патологии, онкологических, гематологических и психических заболеваний, низкая приверженность к лечению, прием тройной антитромботической терапии или варфарина [32].
Исследование одобрено этическим комитетом ФГБОУ ДПО РМАНПО Минздрава России (протокол заседания № 12 от 10 октября 2023 г.).
Всем пациентам в исследовании была проведена оценка лабораторных показателей, включающих клинический анализ крови с целью определения содержания гемоглобина, лейкоцитов и клеток лейкоцитарного ряда, биохимический анализ крови с показателями обмена железа, витамина В12 и фолатов. ДЖ диагностировался при уровне ферритина ниже 40 мкг/л [33]. Абсолютный дефицит витамина В12 определялся при концентрации показателя ниже 200 пг/мл, а функциональный – менее 450 пг/мл [34]. В свою очередь, дефицит фолатов устанавливался у пациентов со значениями уровня витамина В9 менее 4 нг/мл [35]. Также проводился анализ гематологических индексов воспаления – индекса системного иммунного воспаления (Systemic Immune-Inflammation Index, SII), соотношения моноцитов к холестерину липопротеинов высокой плотности (Monocyte to High Density Lipoprotein Ratio, MHR), соотношения тромбоцитов к лимфоцитам (Platelets to Lymphocytes Ratio, PLR), соотношения нейтрофилов к лимфоцитам (Neutrophils to Lymphocytes Ratio, NLR), соотношения моноцитов к лимфоцитам (Monocytes to Lymphocytes Ratio, MLR), индекса системного воспалительного ответа (Systemic Inflammation Response Index, SIRI) и совокупного индекса системного воспаления (Aggregate Inflammation Systemic Index, AISI).
Статистическая обработка данных выполнена в программном пакете IBM SPSS Statistics 27 (IBM, США). Нормальность распределения полученных переменных оценивали с помощью критерия Шапиро – Уилка. Для описания исследуемых параметров, представляющих собой ненормально распределенные количественные переменные, рассчитывали медиану (Ме) и интерквартильный размах в виде 25-го и 75-го процентилей. Нормально распределенные количественные переменные были описаны в виде среднего значения (M) и стандартного отклонения (Standard Deviation, SD). При анализе различий количественных показателей использовали t-критерий Стьюдента или критерий Манна – Уитни (в зависимости от характера распределения данных). Категориальные переменные оценивали с помощью точного критерия Фишера, а непараметрические показатели – с помощью критерия χ2. Статистически значимыми считали различия при р < 0,05.
Результаты
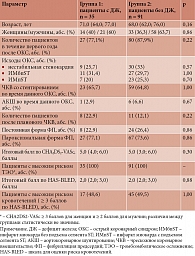
В изучаемой когорте медиана уровня ферритина составила 72,1 (37,0; 129,9) мкг/л. При этом, согласно полученным результатам, ДЖ был диагностирован у 35 (27,8%) пациентов (возраст – 71,0 (64,0; 77,0) года, 60% мужчин, медиана концентрации ферритина – 22,0 (11,3; 32,8) мкг/л), которые далее составили первую группу; во вторую группу были распределены пациенты без ДЖ (n = 91, возраст – 68,0 (62,0; 76,0) года, 63,7% мужчин, концентрация ферритина – 94,0 (67,6; 190,5) мкг/л) (табл. 1).
В то же время среди всех пациентов, включенных в исследование, функциональный дефицит витамина В12 выявлен у 21 (16,7%) пациента (возраст – 71,0 (64,0; 77,0) года, 66,7% мужчин, медиана уровня витамина В12 – 403,1 (371,0; 432,3) мкг/л; случаи абсолютного дефицита В12 у пациентов отсутствовали, а дефицит фолатов был отмечен у 30 (23,8%) больных (возраст – 66,5 (59,8; 76,0) года, 70% мужчин, медиана концентрации витамина В9 – 3,7 (3,2; 3,8)). Сочетанный ДЖ, витаминов В12 и В9 имели 2 (1,6%) пациента, дефицит витаминов В12 и В9 диагностирован у 9 (7,1%) лиц, железа и витамина В9 – у 6 (4,8%) пациентов, а ДЖ в сочетании с дефицитом витамина В12 обнаружен у одного (0,8%) пациента.
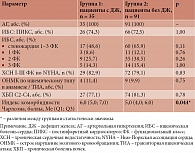
Общая характеристика пациентов в зависимости от наличия или отсутствия ДЖ представлена в таблицах 1 и 2. При оценке сопутствующей патологии артериальная гипертензия (АГ) диагностирована у всех пациентов, включенных в исследование (табл. 2). У пациентов первой группы отмечается более отягощенный коморбидный фон: так, анемия почти в два раза чаще выявлялась у пациентов с ДЖ, чем у лиц без данной патологии (31,4% против 17,6%, различия статистически незначимы). В первой группе также чаще наблюдается как более выраженное снижение почечной функции (хроническая болезнь почек 3–4 стадии, 37,1% против 29,7%), так и более тяжелое течение хронической сердечной недостаточности (III ФК, 22,9% против 16,5%), чем во второй группе, однако различия между группами оказались статистически незначимы. Индекс коморбидности Чарлсона был статистически значимо выше в группе пациентов с диагностированным ДЖ (6,0 (5,0; 7,0) против 5,0 (4,0; 6,0) балла; p = 0,044), чем у лиц без данной патологии (табл. 2).
Анализ лабораторных параметров продемонстрировал, что уровень лейкоцитов в первой группе был выше, чем во второй (7,7 (5,8; 8,5) × 109/л против 7,0 (5,9; 8,3) × 109/л), однако различия статистически незначимы (табл. 3). Показатели воспалительных индексов в группе ДЖ также были выше, чем у пациентов без данной сопутствующей патологии. Хотя различия не достигают статистической значимости, наблюдается определенная тенденция к их наличию. Наиболее высокая статистическая достоверность обнаружена при оценке SII (603,8 (470,4; 811,1) против 512,0 (300,7; 741,0); p = 0,07), PLR (132,5 (110,0; 162,1) против 119,4 (89,2; 157,1); p = 0,08) и NLR (2,8 (2,3; 3,6) против 2,2 (1,7; 3,4); p = 0,07).
Обсуждение
Данные о распространенности ДЖ у пациентов с ФП весьма ограниченны, а прогностическая значимость ДЖ остается в значительной степени недостаточно изученной [36]. В поперечном исследовании T. Kamihara и соавт. [37] (n = 260, средний возраст 78 лет) провели ретроспективный анализ пациентов с ФП для оценки распространенности ДЖ в данной когорте. Абсолютный ДЖ определялся при уровне ферритина < 12 нг/мл, функциональный – при концентрации ферритина < 100 нг/мл и коэффициенте насыщения трансферрина железом (НТЖ) < 20%. Согласно полученным результатам, частота встречаемости функционального ДЖ составила 13,8%, а абсолютного – 1,5% [37].
В другом обсервационном исследовании [38] (n = 134, средний возраст 73,3 ± 11,5 года) распространенность ДЖ, определяемого согласно критериям, предложенным Американской коллегией кардиологов (American College of Cardiology, ACC), а также Европейским обществом кардиологов (European Society of Cardiology, ESC) для пациентов с СН (уровень ферритина < 100 мкг/л или уровень ферритина в диапазоне 100–299 мкг/л в сочетании с коэффициентом НТЖ < 20%), составила 60,4%. При этом у пациентов с ДЖ чаще отмечались случаи инсульта в анамнезе (отношение шансов (ОШ) 3,147; p = 0,016), а также более высокие показатели индекса коморбидности Чарлсона (6,1 против 4,8; p = 0,007) [38]. Стоит отметить, что ДЖ не был ассоциирован ни с развитием ИМ (ОШ 1,1 (95% ДИ 0,18–6,06); p = 1,0), ни с ишемическими цереброваскулярными событиями (ОШ 1,4 (95% ДИ 0,27–7,35); p = 1,000), однако наблюдалась тенденция к повышению риска смертности (ОШ 2,1 (95% ДИ 0,91–4,9); p = 0,067) [38].
Полученные результаты соотносятся с данными настоящего исследования. Так, пациенты с ДЖ имели более отягощенный коморбидный фон, чем лица без данной патологии (6,0 (5,0; 7,0) баллов против 5,0 (4,0; 6,0); p = 0,044), что соответствует 10-летней выживаемости менее 21%. По данным настоящего исследования, частота встречаемости ДЖ составила 27,8% в связи с использованием более строгих критериев определения ДЖ: согласно клиническим рекомендациям Минздрава России по ведению пациентов с железодефицитной анемией [33].
В недавно опубликованном проспективном обсервационном исследовании [39] (n = 100, средний возраст составил 70,4 года) ДЖ (по критериям ESC) наблюдался у 53,6% пациентов с ФП, при этом не было выявлено статистически значимых различий при оценке индекса Чарлсона у пациентов с наличием и отсутствием ДЖ.
В датском когортном исследовании [40] (n = 10 834, средний возраст 76 (68; 82) лет, медиана периода наблюдения – 31 мес.) частоту встречаемости ДЖ у пациентов с ФП определяли по четырем различным критериям:
- упомянутым ранее критериям ESC у пациентов с СН (уровень ферритина < 100 мкг/л, или уровень ферритина в диапазоне 100–299 мкг/л в сочетании с коэффициентом НТЖ < 20%);
- только по уровню ферритина < 100 нг/мл;
- по значению коэффициента НТЖ < 20%;
- по концентрации сывороточного железа ≤ 13 мкмоль/л.
Общая распространенность ДЖ, по результатам исследования, в зависимости от использованного критерия его диагностики варьировалась от 36,2 до 61,7% у пациентов с ФП в сочетании с СН и от 38,6 до 62,7% у пациентов с ФП без СН [40]. При этом значения коэффициента НТЖ < 20% были ассоциированы с увеличением риска смертности от всех причин и сердечно-сосудистой смертности как у пациентов с СН (отношение рисков (ОР) 1,25; 95% ДИ 1,14–1,37 и ОР 1,31; 95% ДИ 1,14–1,49 соответственно), так и у пациентов без СН (ОР 1,39; 95% ДИ 1,18–1,64 и ОР 1,54; 95% ДИ 1,18–2,00 соответственно) [40].
Аналогичным образом ДЖ, диагностируемый при уровне сывороточного железа ≤ 13 мкмоль/л, также был ассоциирован с более высокой смертностью от всех причин и сердечно-сосудистой смертностью у пациентов с СН (ОР 1,44; 95% ДИ 1,31–1,58 и ОР 1,42; 95% ДИ 1,24–1,63 соответственно) и у пациентов без СН (ОР 1,67; 95% ДИ 1,41–1,97 и ОР 1,46; 95% ДИ 1,13–1,89 соответственно). Однако ДЖ, определяемый по рекомендациям ESC или только по уровню ферритина < 100 нг/мл, не был ассоциирован с повышением риска смертности ни в одной из групп, но сопровождался увеличением частоты госпитализации по любой причине у пациентов с ФП в сочетании с СН (ОР 1,15; 95% ДИ 1,08–1,23 и ОР 1,16; 95% ДИ 1,09–1,23 соответственно). В связи с полученными данными авторы рекомендуют использовать в качестве диагностических критериев ДЖ показатели коэффициента НТЖ < 20% или сывороточного железа ≤ 13 мкмоль/л, обладающие высокой прогностической ценностью у пациентов с ФП [40].
M. Keskin и соавт. [41] (n = 101) у пациентов с ФП без признаков СН в исследовании определяли дефицит не только железа (критерии ESC), но и витамина В12 (концентрация < 200 пг/мл), и фолиевой кислоты (уровень < 4,0 нг/мл). ДЖ был выявлен у 47,6% пациентов с ФП, при этом его частота была выше у пациентов с постоянной формой ФП (40,0%) по сравнению с пациентами с пароксизмальной или персистирующей формами ФП (13,8 и 14,8% соответственно) (ОШ 4,30; 95% ДИ 0,83–12,07; р = 0,039). Стоит отметить, что высокочувствительный СРБ (ОШ 1,47; 95% ДИ 0,93–2,36; p = 0,019) и количество лейкоцитов (ОШ 1,21; 95% ДИ 0,95–1,58; p = 0,041) были значимо ассоциированы с ДЖ [41].
В свою очередь, дефицит витамина B12 был выявлен у 9,9%, а дефицит фолиевой кислоты – у 12,9% пациентов [41]. В нашем исследовании распространенность дефицитов данных витаминов была несколько выше: дефицит фолатов выявлен у 23,8%, а функциональный дефицит витамина В12 у 16,7% (случаи абсолютного дефицита среди пациентов отсутствовали). При этом у многих пациентов выявлен сочетанный дефицит витаминов и/или микроэлементов, что также влияет на выбор тактики ведения исследуемой популяции.
В доступной научной литературе имеются данные, подтверждающие влияние уровня витамина В12 на распространенность ФП. Так, С. Liakos и соавт. [42] (n = 32 800) продемонстрировали, что низкий уровень витамина B12 был значимо ассоциирован с распространенностью как пароксизмальной, так и постоянной формы ФП у пациентов с эссенциальной АГ (p = 0,030 и p = 0,009 соответственно). Однако патофизиологические механизмы, лежащие в основе этой взаимосвязи, требуют дальнейшего изучения.
Метаанализ 30 рандомизированных контролируемых исследований [43] (n = 82 334) показал, что прием фолиевой кислоты значимо ассоциирован со снижением риска инсульта на 10% (ОР 0,90; 95% ДИ 0,84–0,96; p = 0,002) и общего риска ССЗ на 4% (ОР 0,96; 95% ДИ 0,92–0,99; p = 0,02), однако влияние на риск развития ИБС доказано не было.
У пациентов с ИБС распространенность ДЖ изучена более подробно. Так, у лиц с ОКС частота встречаемости ДЖ варьировалась от 29 до 56% в зависимости от характеристики когорт [44–46], при этом общая распространенность ДЖ, по данным метаанализа семи исследований [47] (n = 2821), составила 43%.
В исследовании T. Zeller и соавт. (n = 836, средний возраст 63,0 года) ДЖ, распространенность которого по критериям ESC составила 29,1%, был независимым предиктором повышения риска нефатального ИМ и сердечно-сосудистой смертности на 50% (сОР 1,73; 95% ДИ 1,07–2,81; p = 0,026) после поправки на возраст, пол, АГ, статус курения, сахарный диабет, гиперлипидемию, индекс массы тела, концентрацию N-концевого мозгового натрийуретического пропептида B-типа, тропонина и анемию [45].
По результатам другого исследования (n = 141, средний возраст 59,7 ± 1,1 года), частота встречаемости ДЖ (критерии ESC) у пациентов с ИМ после чрескожного коронарного вмешательства (ЧКВ) достигла 43%. Наряду с этим ДЖ был ассоциирован с бóльшим размером ИМ, а также более высокой частотой неблагоприятного ремоделирования левого желудочка через 6 месяцев, чем у пациентов без данной патологии [44].
B. Schrage и соавт. [48] (n = 12 164, медиана возраста 59 (45; 68) лет) оценивали распространенность ДЖ, а также его влияние на риск ССЗ в европейской популяции. Критерием абсолютного ДЖ был уровень ферритина < 100 мкг/л, при этом авторы отдельно выделяли тяжелый ДЖ (уровень ферритина < 30 мкг/л). Функциональный ДЖ определяли по критериям ESC (концентрация ферритина < 100 мкг/л или сочетание уровня ферритина 100–299 мкг/л и коэффициента НТЖ < 20%). Частота встречаемости абсолютного ДЖ, в том числе тяжелого, составила 60,0 и 16,4% соответственно, а функциональный ДЖ обнаружили у 64,3% пациентов исследуемой популяции. Абсолютный ДЖ был ассоциирован с повышением риска ИБС (ОР 1,20; 95% ДИ 1,04–1,39; р = 0,01), а тяжелый ДЖ – с увеличением смертности от всех причин (ОР 1,28; 95% ДИ 1,12–1,46; р < 0,01) [48]. В свою очередь, функциональный ДЖ был статистически значимо ассоциирован с повышением риска развития ИБС на 24% (ОР 1,24; 95% ДИ 1,07–1,43; р < 0,01), сердечно-сосудистой смертности – на 26% (ОР 1,26; 95% ДИ 1,03–1,54; р = 0,03) и смертности от всех причин на 12% (ОР 1,12; 95% ДИ 1,01–1,24; р = 0,03). При этом 5,4% летальных исходов от всех причин, 11,7% случаев сердечно-сосудистой смертности, а также 10,7% случаев ИБС были обусловлены ДЖ [48].
Несмотря на высокую распространенность ДЖ как при ФП, так и при ИБС, а также доказанную взаимосвязь ДЖ с высоким риском развития ишемических событий, общей и сердечно-сосудистой смертности, в настоящее время отсутствуют исследования, оценивающие частоту встречаемости ДЖ у пациентов с ФП в сочетании с ИБС и подтверждающие эффективность применения препаратов железа в изучаемой популяции.
Как было упомянуто ранее, одной из основных причин развития ДЖ у пациентов с ФП в сочетании с ИБС является хроническое низкоинтенсивное воспаление [15–17]. В проведенных исследованиях уже была доказана ассоциация высоких уровней провоспалительных маркеров, таких как СРБ, ФНО-α, ИЛ-6 и других, не только с высоким риском развития ФП и ОКС, но и с неблагоприятным прогнозом у пациентов с данной сердечно-сосудистой патологией [19–21]. Однако рутинное определение таких цитокинов в клинической практике затруднено. В свою очередь, оценка степени воспаления по показателям клинического анализа крови широко доступна в связи с низкой стоимостью и относительной простотой проведения лабораторного исследования. В проведенных ранее исследованиях продемонстрирована взаимосвязь уровня лейкоцитов крови и их подвидов (нейтрофилов, лимфоцитов, моноцитов) с увеличением риска развития ИБС, инсульта и смертности от всех причин. В настоящее время активно изучается прогностическая ценность воспалительных индексов, основанных на лейкоцитарной формуле [49, 50].
Так, M. Aimaitijiang и соавт. [51] (n = 570) в исследовании изучали прогностическую значимость таких индексов хронического воспаления, как MHR и MLR, для оценки риска рецидива ФП после криоаблации. Согласно полученным результатам, у пациентов с подтвержденным рецидивом ФП были отмечены более высокие значения MHR (0,37 ± 0,14 против 0,33 ± 0,14; р = 0,004) и MLR (0,49 ± 0,32 против 0,18 ± 0,07; р < 0,001) по сравнению с лицами без рецидива ФП. При этом показатель MHR ≥ 0,34 в сочетании с MLR ≥ 0,24 (ОР 9,979; 95 % ДИ 6,070–16,407; p < 0,001) был независимым предиктором рецидива ФП после криоаблации [51].
Схожие результаты были получены и в отечественном исследовании М.А. Басиевой и соавт. [52] (n = 239, средний возраст 61 год, средний период наблюдения 20 мес.). Пациенты с диагностированным рецидивом ФП после криобаллонной изоляции легочных вен имели более высокие уровни таких воспалительных индексов, как SIRI (0,91 (0,67; 1,1) против 0,76 (0,55; 1,05); p = 0,018), SII (410,5 (309,6; 565,1) против 350,95 (257,1; 462,8); p = 0,008) и NLR (1,8 (1,5; 2,5) против 1,6 (1,3; 2); p = 0,002) по сравнению с лицами без рецидива. При этом, согласно результатам ROC-анализа, пороговые значения SIRI > 0,841, SII > 365,83 и NLR > 1,6 были значимо ассоциированы с возникновением рецидива ФП [52].
В ранее проведенных исследованиях была доказана взаимосвязь NLR с увеличением смертности у лиц с ОКС и аритмиями, в том числе ФП [53–55]. Установлено, что уровень NLR > 3,15 приводит к увеличению риска развития ФП в 2,5 раза [53–55]. NLR является одним из ключевых прогностических индексов воспаления у пациентов с ССЗ, поскольку на него практически не оказывает влияние физиологическое состояние организма. Повышение NLR часто сопровождается увеличением количества нейтрофилов и лейкоцитов, что, в свою очередь, способствует возникновению и прогрессированию, и повышению риска развития ИБС и ишемического инсульта на фоне дестабилизации атеросклеротической бляшки и окклюзии просвета сосуда [55–57].
В проспективном обсервационном исследовании Q. Li и соавт. [58] (n = 1701, средний возраст 60 ± 10 лет, средний период наблюдения 30 месяцев) оценивали прогностическую ценность 5 индексов воспаления (PLR, NLR, MLR, SII и SIRI) у пациентов с ОКС, перенесших ЧКВ. По результатам многофакторного регрессионного анализа Кокса можно сделать вывод, что все изучаемые воспалительные индексы являются независимыми предикторами развития серьезных неблагоприятных сердечно-сосудистых событий (Major Adverse Cardiovascular Events, MACE), при этом наилучшие результаты получены с помощью индекса SIRI (ОР 3,847; 95% ДИ 2,623–5,64; p < 0,001). Стоит отметить, что при комплексной оценке индексов NLR, MLR, SII или SIRI в сочетании со шкалой риска Глобального реестра острых коронарных событий (Global Registry of Acute Coronary Events, GRACE) продемонстрирована более высокая прогностическая ценность, особенно в случае SIRI (p < 0,001), по сравнению с использованием только шкалы GRACE [58].
В другом когортном исследовании [59] (n = 42 875 без ССЗ и онкологических заболеваний, средний возраст 44 ± 18 лет, период наблюдения 20 лет) было показано, что значение индекса SII > 655,56 ассоциировано с увеличением смертности от всех причин (ОР 1,29; 95% ДИ 1,18–1,41) и сердечно-сосудистой смертности (ОР 1,33; 95% ДИ 1,11–1,59), по сравнению с референсным значением SII < 335,36. Значение индекса SIRI > 1,43 также было ассоциировано с увеличением риска смертности от всех причин (ОР 1,39; 95% ДИ 1,26–1,52) и сердечно-сосудистой смертности (ОР 1,39; 95% ДИ 1,14–1,68) [59].
В нашем исследовании у пациентов с ДЖ отмечены более высокие показатели всех индексов воспаления, однако без статистически значимых различий. Учитывая результаты исследований, ДЖ на фоне хронического низкоинтенсивного воспаления в исследуемой популяции может сопровождаться увеличением риска развития сердечно-сосудистых событий и ухудшением прогноза, однако для подтверждения данной гипотезы требуются дальнейшие крупные проспективные исследования.
Заключение
Согласно полученным результатам, дефицит железа, витамина В12 и В9 широко распространен у пациентов с ФП в сочетании с ИБС. Одним из основных этиологических факторов развития ДЖ, помимо алиментарного генеза и заболеваний желудочно-кишечного тракта, служит хроническое системное низкоинтенсивное воспаление. Наиболее доступным методом оценки степени воспаления у пациентов с данной сердечно-сосудистой патологией являются воспалительные индексы, рассчитываемые на основе показателей клинического анализа крови. Как ДЖ, так и воспаление у пациентов с ФП и ИБС ассоциированы с неблагоприятным прогнозом и повышенным риском смертности, а их сочетание может усугублять данное негативное влияние.
S.S. Telkova, A.I. Kochetkov, A.V. Starodubova, T.N. Korotkova, I.V. Vorozhko, N.E. Gavrilova, E.Yu. Trush, O.D. Ostroumova
Russian Medical Academy of Continuous Professional Education, Moscow
Federal Research Center of Nutrition, Biotechnology and Food Safety, Moscow
Pirogov Russian National Research Medical University, Moscow
Scandinavian Health Center, Moscow
I.M. Sechenov First Moscow State Medical University, Moscow
Contact person: Olga D. Ostroumova, olga@mail.ru
Atrial fibrillation (AF) and coronary artery disease (CAD), associated with chronic inflammation, are socially significant cardiovascular diseases. Iron deficiency (ID) and vitamin deficiencies contribute to a worse quality of life and prognosis in AF and CAD; however, their prevalence has been scarcely studied.
Aim. To investigate the prevalence of ID, vitamin B12, and folate deficiencies, and the impact of inflammation on the prevalence of ID in patients with AF and CAD on dual antithrombotic therapy (DATT).
Material and methods. A prospective open cohort study included 126 patients with AF and CAD (mean age 69.5 [63;76], 62.7% men) on DATT. All patients underwent clinical and biochemical blood tests to assess iron metabolism, vitamin B12, and folate levels. Inflammatory indices were also evaluated: the systemic immune-inflammation index, monocyte-to-high density lipoprotein ratio, platelet-to-lymphocyte ratio, neutrophil-to-lymphocyte ratio, monocyte-to-lymphocyte ratio, systemic inflammation response index, and the aggregate index of systemic inflammation.
Results. ID was diagnosed in 27.8% of patients, who constituted Group 1; Group 2 consisted of patients without ID (n = 91). Functional vitamin B12 deficiency was detected in 16.7% of patients, and folate deficiency in 23.8%. The Charlson comorbidity index was higher in Group 1 (6.0 [5.0;7.0] vs. 5.0 [4.0;6.0], p = 0.044) than in Group 2. The values of inflammatory indices and white blood cell counts were also higher in the group with ID compared to those without it; however, the differences were not statistically significant.
Conclusion. Iron and vitamin B12 and B9 deficiencies are highly prevalent in patients with AF on DAPT. A key factor of ID is systemic inflammation, the most accessible way to assess its severity is by using inflammatory indices.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.