Патология почек при циррозе печени
- Аннотация
- Статья
- Ссылки
- English



В среднем у 5–7% больных циррозом печени различной этиологии ежегодно наблюдается декомпенсация заболевания [1–3]. Декомпенсированный цирроз печени – заболевание с мультиорганной (системной) дисфункцией. Декомпенсированной стадии заболевания предшествует стадия компенсации (асимптомная стадия), когда клинические симптомы заболевания отсутствуют. Средняя продолжительность жизни пациентов с компенсированной стадией заболевания – 12 лет.
Существуют три стадии компенсированного цирроза печени:
- стадия 0: отсутствуют признаки портальной гипертензии и варикозно расширенные вены пищевода (ВРВП), измерение жесткости печени (liver stiffness measurement, LSM) > 15, но < 20 или давление в воротной вене > 5, но < 10 мм рт. ст.;
- стадия 1: ВРВП отсутствуют, определяется значимая портальная гипертензия – LSM ≥ 20 или давление в воротной вене ≥ 10 мм рт. ст.;
- стадия 2: имеют место ВРВП и значимая портальная гипертензия.
Декомпенсация цирроза печени (симптомная стадия) характеризуется наличием клинических признаков заболевания, средняя продолжительность жизни не превышает двух лет. Манифестация декомпенсированного заболевания часто сопровождается кровотечением из ВРВП. Конечная стадия декомпенсации цирроза печени характеризуется развитием рефрактерного асцита, печеночной энцефалопатии или желтухи, почечной недостаточности, присоединением инфекции [1, 3, 4].
О функциональном состоянии почек судят по уровню креатинина крови и снижению скорости клубочковой фильтрации (СКФ).
Критерии почечной недостаточности у пациентов с циррозом печени были определены более 30 лет назад и базировались на уровне креатинина ≥ 1,5 мг/дл, что соответствовало показателю СКФ ≤ 40 мл/мин/1,73 м2. Важно, что у пациентов с заболеваниями печени даже незначительное увеличение уровня креатинина крови может вызывать заметное снижение СКФ. Тем не менее диагноз почечной дисфункции при заболеваниях печени все еще основан на показателях креатинина крови [5, 6]. В случае повышения уровня креатинина крови и снижения СКФ у пациентов с заболеванием печени необходимо исключить хроническую болезнь почек (ХБП), острую болезнь почек (ОБП), острое повреждение почек (ОПП) или их сочетание (табл. 1).
Цирроз печени может сопровождаться ХБП, обусловленной сопутствующими заболеваниями, например сахарным диабетом, артериальной гипертензией и/или такими заболеваниями почек, как IgA-нефропатия, вирусная гломерулопатия.
Распространенность ХБП у пациентов с циррозом печени до сих пор не изучена. Диагноз ХБП основывается на снижении СКФ на протяжении трех и более лет (СКФ < 60 мл/мин/1,73 м2). СКФ рассчитывается по формулам, учитывающим уровень креатинина, наличие (отсутствие) признаков повреждения почечной паренхимы (протеинурия, гематурия, анормальные значения ультрасонографии). Стадия ХБП определяется исходя из уровня снижения СКФ [7–9].
Критерием ОБП служит повреждение почек, зафиксированное в течение менее трех месяцев: СКФ снижается менее 60 мл/мин/1,73 м2, или на 35% и более, либо уровень креатинина увеличивается на 50% и более за указанный промежуток времени.
В настоящее время вместо термина «острая почечная недостаточность» используется термин «острое повреждение почек», предложенный экспертами Международной организации по улучшению глобальных результатов лечения заболеваний почек KDIGO (Kidney Disease: Improving Global Outcomes) [10, 11]. При ОПП не отмечается каких-либо структурных изменений почек. Диагноз основан на увеличении уровня креатинина сыворотки крови в 1,5 раза по сравнению с исходным (если это известно или предполагается, что увеличение уровня произошло в течение предшествующих семи дней, или абсолютное увеличение уровня креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и более – на протяжении двух дней).
Следует подчеркнуть, что диагностика ОПП, согласно критериям KDIGO, может базироваться как на уровне креатинина сыворотки крови, так и на объеме выделяемой мочи. То есть, исходя из данных критериев, диагноз ОПП правомерен и при объеме мочи менее 0,5 мл/кг/ч за шесть часов [11–13]. Однако, согласно новому консенсусу Международного асцитического клуба (International Ascites Club), объем мочи не учитывается при диагностике ОПП у больных циррозом печени. Это объясняется тем, что больные циррозом печени с асцитическим синдромом часто страдают олигурией с выраженной задержкой натрия, несмотря на относительно нормальную СКФ, объем мочи у них может повышаться на фоне применения диуретиков [14].
Новая система разделения ОПП на стадии основана на процентном увеличении уровня креатинина сыворотки крови у больных циррозом печени по сравнению с базовым уровнем (начальная стадия) либо при пиковом значении креатинина во время госпитализации в случае прогрессирующего ОПП (пиковая стадия). У пациентов с циррозом печени значение креатинина в течение последних трех месяцев, до его повышения, следует рассматривать как базовое. Согласно критериям KDIGO, стадия 1 соответствует увеличению креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и более, или в 1,5–2 раза от базового. Стадия 2 ОПП соответствует увеличению уровня креатинина сыворотки крови более чем в два раза, но менее чем в три раза. Стадия 3 верифицируется при увеличении уровня креатинина более чем в три раза (табл. 2) [11].
Как показали результаты недавних исследований, у пациентов с циррозом печени со стадией 1 ОПП эффективность терапии зависит от уровня креатинина сыворотки крови. Его увеличение более чем на 1,5 мг/дл (132,6 мкмоль/л) ассоциируется с худшим прогнозом [15–17]. В отличие от системы KDIGO эксперты Международного асцитического клуба предложили разделять стадию 1 на подстадии 1а (креатинин < 1,5 мг/дл (132,6 мкмоль/л)) и 1b (креатинин ≥ 1,5 мг/дл (132,6 мкмоль/л)) [14].
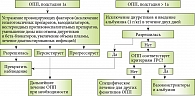
С учетом системы стадирования и результатов нескольких проспективных исследований был предложен новый алгоритм лечения ОПП у пациентов с циррозом печени (рисунок) [14]. При подстадии 1а (увеличение уровня креатинина до значений менее чем 1,5 мг/дл (132,6 мкмоль/л)) в некоторых случаях достаточно устранить провоцирующие факторы: отменить гепатотоксические препараты, нестероидные противовоспалительные препараты, уменьшить дозу или отменить диуретики и бета-блокаторы, увеличить объем плазмы, пролечить диагностированные инфекции. Но уже с подстадии 1b кроме полной отмены диуретических препаратов рекомендовано вводить альбумин из расчета 1 г на 1 кг веса больного на протяжении двух дней. Если после двухдневного лечения признаки ОПП сохраняются, необходимо исключить наличие у пациента гепаторенального синдрома (ГРС) или других видов ОПП.
У больных циррозом печени могут наблюдаться все виды ОПП – преренальное, ГРС, ренальное, острое тубулярное, постренальное повреждение [8]. Необходимо дифференцировать ГРС от острого тубулярного некроза. Конечно, возможно разграничение различных вариантов повреждения с помощью пункционной биопсии почек. В отличие от острого тубулярного некроза при ГРС отсутствуют морфологические изменения в почках. Поскольку биопсия почки редко проводится при ОПП, в настоящее время предлагают использовать биомаркеры. Для дифференциальной диагностики между острым тубулярным некрозом и ГРС целесообразно определять в моче липокалин, ассоциированный с желатиназой нейтрофилов. Концентрация этого белка в моче и крови значительно повышается в первые часы после развития ОПП. Подобный анализ позволяет быстро установить диагноз и назначить адекватную терапию. Скорее всего этот тест в будущем получит широкое распространение в клинической практике [18–22].
Экспертами Международного асцитического клуба классификация ГРС была пересмотрена. Сегодня выделяют два типа ГРС. Тип 1 соответствует ГРС-ОПП, тип 2 подразумевает нарушение функции почек, соответствие критериям ГРС, но не ОПП (не-ОПП-ГРС).
Согласно критериям Международного асцитического клуба, ГРС-ОПП возникает только при наличии у больных декомпенсированным циррозом печени асцита и признаков ОПП (увеличение уровня креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и выше на протяжении 48 часов, или на 50% и более на протяжении семи дней). При диагностике ГРС-ОПП необходимо исключить шок, органическое поражение почек (отсутствие протеинурии и микрогематурии и структурных изменений почек по данным ультрасонографии), доказать отсутствие в анамнезе приема в ближайшее время нефро- и гепатотоксических препаратов, улучшение в течение двух дней после отмены диуретических средств и назначения альбумина в дозе 1 г на 1 кг веса пациента [14, 23].
Всем пациентам c ГРС-ОПП со стадией выше 1а необходимо незамедлительно назначить вазоконстрикторы и альбумин с госпитализацией в палату интенсивной терапии. Препаратом выбора из вазопрессоров является терлипрессин (Реместип). Препарат повышает тонус гладких мышц сосудистой стенки, вызывает сужение артериол, вен и венул в большей степени в брюшной полости, уменьшает кровоток в гладкомышечных органах и печени, снижает давление в портальной системе. Препарат можно вводить внутривенно болюсно (1 мг каждые 4–6 часов) или непрерывно внутривенно, 2 мг/сут. Если через два дня лечения уровень креатинина снижается менее чем на 25% пикового, дозу терлипрессина следует увеличить до максимальной – 12 мг/сут. При недоступности терлипрессина его можно заменить норадреналином. Если недоступны оба препарата, можно использовать мидодрин и октреотид, хотя их эффективность ниже. Одновременно с вазопрессорами вводится 20%-ный раствор альбумина, его суточная доза – 20–40 г. Для предупреждения перегрузки кровообращения целесообразно измерять центральный объем крови с титрованием дозы альбумина [24–29].
Профилактика ГРС основана на введении раствора альбумина пациентам с асцитическим синдромом, у которых не исключен риск развития спонтанного бактериального перитонита. В случае его верификации альбумин вводят из расчета 1,5 мг на 1 кг веса, на третий день от постановки диагноза – в дозе 1 мг на 1 кг веса пациента [30, 31].
Кроме того, в качестве профилактики спонтанного бактериального перитонита и развития на его фоне ГРС-ОПП используют норфлоксацин 400 мг/сут.
M.F. Osipenko, MD, PhD, Prof., N.B. Voloshinа, MD, PhD, Prof., N.L. Shayde
Novosibirsk State Medical University
Novosibirsk City Clinical Hospital № 12
Contact person: Marina F. Osipenko, ngma@bk.ru
Renal damage in patients with liver cirrhosis significantly worsens the prognosis of the disease. The article provides the diagnostic criteria of chronic renal disease, acute renal disease, acute renal damage and methods of their treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.