количество статей
7261
Пожалуйста, авторизуйтесь:
Медицинский форум
Периферические полиневропатии: что скрывается за многообразием клинических форм?
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Неврология №1
- Аннотация
- Статья
- Ссылки
Тяжесть патологических изменений периферических волокон, приводящих к периферической полиневропатии, обусловлена характером повреждающих факторов. Вопросы патогенеза, клинических проявлений и методов лечения неврологических последствий самых распространенных причин развития полиневропатии – сахарного диабета и алкогольной болезни – обсуждались в рамках симпозиума, организованного компанией "Вёрваг Фарма".

Профессор И.В. Гурьева

Профессор О.Е. Зиновьева
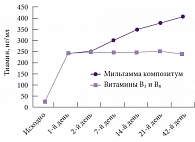
Рис. 1. Концентрация тиамина в плазме на фоне Мильгаммы композитум и комбинации витаминов В₁ и В₆
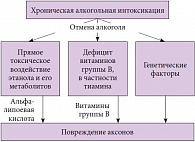
Рис. 2. Этиотропная и патогенетическая терапия алкогольной полиневропатии
Сахарный диабет (СД) относится к одному из наиболее распространенных этиологических факторов поражения периферических нервов. Периферическая диабетическая невропатия может носить болевой (острая и хроническая болевая формы) или безболевой характер (хроническая безболевая невропатия). По данным руководителя Московского центра «Диабетическая стопа» Федерального бюро медико-социальной экспертизы, профессора кафедры эндокринологии и диабетологии РМАПО, д.м.н. Ирины Владимировны ГУРЬЕВОЙ, признаки болевых периферических невропатий возникают у 20% пациентов с СД. Однако треть больных не получает лечения, 50% пациентам назначается неадекватная терапия, и только 2% лечатся у специализирующихся на болевых синдромах врачей. Кроме того, поражения периферических нервов могут проявляться не болью, а, наоборот, утратой чувствительности, что может послужить причиной развития острых и хронических язв, костно-суставных поражений и гнойно-некротических процессов.
Диабетическая полиневропатия (ДПН) не только серьезно нарушает качество жизни больных (ухудшает сон, способствует развитию депрессии и др.), но и влияет на ее продолжительность. Установлено, что невропатия – наиболее важный предиктор повышенного риска смерти во время интенсивной терапии диабета. Согласно данным исследования ACCORD (Action to Control Cardiovascular Risk in Diabetes), у пациентов с кардиальной автономной невропатией риск смертельного исхода возрастает в 1,55–2,14 раза, а в сочетании с диабетической полиневропатией – в 3 раза1. Патогенез диабетической полиневропатии представляет собой сложный процесс, пусковым механизмом которого является хроническая гипергликемия. Стойкое повышенное содержание глюкозы в сыворотке крови вызывает каскад метаболических нарушений, приводящих к повреждению различных систем организма. В условиях гипергликемии активируется каскад патологических путей метаболизма глюкозы. Избыток глюкозы неизбежно направляется по полиоловому пути: накопление сорбитола в нейронах подавляет синтез важнейшего компонента миелина (миоинозитола) и снижает активность Nа(+),К(+)-аденозинтрифосфатазы. В результате этих нарушений страдает проводимость нервных импульсов.
Многие крупные рандомизированные исследования показали, что ранний интенсивный гликемический контроль снижает риск развития осложнений сахарного диабета. К окончанию исследования DCCT (Diabetes Control and Complications Trial) интенсивная терапия больных СД 1 типа позволила снизить риск клинически подтвержденной невропатии на 64%, автономной невропатии – на 31%. Согласно данным исследования EDIC (Epidemiology of Diabetes Interventions and Complications), в группе интенсивной терапии к 14-му году лечения риск развития клинически подтвержденной невропатии снизился на 30%, эректильной дисфункции – на 64%, язв – на 48%, автономной невропатии – на 31%2. Результаты исследований позволили сделать вывод о том, что развитие неврологических осложнений в сильной степени зависит от уровня гликированного гемоглобина (HbA1c). В ходе других исследований было доказано, что демиелинизирующий вариант невропатии чаще развивается при СД 1 типа на фоне высокого уровня HbA1c, а комбинированный вариант (аксональный + демиелинизирующий) – при СД 2 типа и большой длительности периферической невропатии3.
Однако даже длительное поддержание удовлетворительного уровня глюкозы после гипергликемии не предупреждает развитие ДПН (так называемый феномен гипергликемической памяти). Именно феноменом метаболической памяти, который способен сохраняться в течение длительного времени, можно объяснить развитие осложнений диабета даже при контроле HbA1c. Механизмы гипергликемической памяти реализуются в митохондриях, сопровождая процессы окислительного стресса. В условиях гипергликемии происходит гликирование митохондриальных белков, в том числе увеличивается уровень метилглиоксаля (активная форма глюкозы) – промежуточного продукта образования конечных продуктов гликирования (КПГ, англ. advanced glycation end products). Это приводит к нарушению митохондриального дыхания, модификации митохондриальных белков. Уже имеются исследования, показывающие, что значительное повышение метилглиоксаля плазмы крови обнаруживается при диабетической полиневропатии, особенно при болевой форме, по сравнению с контролем. КПГ связываются со специфическим рецептором, определяющим гипергликемическую память и приводящим к окислительному стрессу. Образование связей КПГ с рецепторами КПГ приводит к нарушению окислительно-восстановительного баланса клеток и избыточному образованию активных форм кислорода (свободных радикалов), которые вызывают повреждение митохондриальной ДНК и являются пусковым механизмом гибели нервных клеток.
В соответствии с пониманием патогенеза диабетической полиневропатии наиболее оправданным можно считать назначение пациентам антиоксидантов (альфа-липоевая кислота) и активаторов транскетолазы. Профессор M. Brownlee продемонстрировал, что достоверно уменьшить накопление промежуточных продуктов можно путем активации транскетолазы с помощью бенфотиамина4. Бенфотиамин оказывает прямое нейротропное действие. Считается, что бенфотиамин повышает активность транскетолазы и защищает нервную ткань от конечных продуктов гликирования, предотвращает развитие микро- и макроангиопатии у больных сахарным диабетом и к тому же обладает анальгетическим действием. «Уже получены данные, подтверждающие эффективность 600 мг бенфотиамина в ингибировании образования КПГ. Более ранними исследованиями было доказано, что прием пищи с большим содержанием КПГ вызывает более значимое снижение адипонектина при сахарном диабете, по сравнению с низким КПГ, и предотвращается приемом 1050 мг бенфотиамина в день5», – пояснила профессор И.В. Гурьева.
Бенфотиамин вместе с пиридоксином (витамин В₆) входит в состав препарата Мильгамма композитум, который широко применяется для лечения диабетической полиневропатии. Эффективность Мильгаммы композитум доказана результатами 6 плацебоконтролируемых двойных слепых исследований. Профессор И.В. Гурьева более детально остановилась на результатах радомизированного плацебоконтролируемого исследования по оценке эффективности Мильгаммы композитум у больных СД 2 типа и диабетической полиневропатией, проведенного сотрудниками кафедры эндокринологии и диабетологии РМАПО6. Пациенты в течение 6 недель получали либо Мильгамму композитум (1 драже 3 р/сут), либо инъекционные формы витаминов В₁ и В₆, либо плацебо. Анализ концентрации тиамина в плазме продемонстрировал более значимую фармакокинетическую эффективность драже Мильгамма композитум по сравнению с водорастворимыми витаминами В₁ и В₆ – рост накопления тиамина начинался уже на 2-й день от начала приема (рис. 1). Оценка динамики шкалы NIS LL (Neuropathy Impairment Score of Low Limbs) показала достоверный регресс объективных клинических проявлений ДПН в группе Мильгаммы композитум по сравнению с группой больных, принимавших водорастворимые витамины группы В и плацебо.
Какая доза бенфотиамина является оптимальной для больных с диабетической полиневропатией? Исследование BENDIP (Benfotiamine in Diabetic Polyneuropathy) продемонстрировало положительный эффект шестинедельной терапии бенфотиамином в дозе 600 мг/сут7. Позитивная невропатическая симптоматика (жалобы больных на боль, жжение, онемение и др.) в почти одинаковой мере уменьшалась при использовании доз 300 и 600 мг бенфотиамина. Однако улучшение было более выражено в группе пациентов, принимавших бенфотиамин в более высокой дозе (600 мг), и нарастало с продолжительностью лечения (р < 0,033). Препарат Мильгамма, помимо бенфотиамина и витамина В₆, содержит цианокобаламин (B₁₂). Последний способствует восстановлению миелиновой оболочки и уменьшению невропатической боли. За счет наличия в составе Мильгаммы 20 мг лидокаина инъекции практически безболезненны. По этой причине при выраженном болевом синдроме внутримышечное введение Мильгаммы больным СД 2 типа, осложненного диабетической полиневропатией, с последующим переходом на пероральный прием Мильгаммы композитум может быть более предпочтительно.
Как уже было сказано, существенным методом воздействия на ключевые механизмы патогенеза диабетической полиневропатии является восстановление антиоксидантной защиты, где важная роль принадлежит альфа-липоевой кислоте. Альфа-липоевая кислота нейтрализует действие окислительного стресса и позволяет сбалансировать нарушенные окислительные и антиоксидантные процессы в организме. Именно альфа-липоевая кислота в качестве патогенетической терапии диабетической полиневропатии обладает наиболее значимой доказательной базой (уровень доказательности А)8. Традиционная схема лечения больных с диабетической полиневропатией заключается в назначении внутривенных инфузий альфа-липоевой кислоты (Тиогамма) по 600 мг ежедневно. Как долго? Данные исследования AND study продемонстрировали, что возвращение симптомов заболевания через 2 недели после прекращения приема альфа-липоевой кислоты, которую пациенты принимали в течение 12 месяцев, свидетельствует о том, что лечение диабетической полиневропатии должно быть длительным и продолжаться даже при отсутствии симптомов. Все это подтверждает необходимость назначения препаратов, обладающих патогенетическими свойствами.
«Болевая диабетическая полиневропатия может приводить к атрофическим процессам центральной нервной системы при длительном течении. В этой связи ранняя диагностика болевой невропатии и добавление к гипогликемизирующим средствам препаратов, модифицирующих факторы риска, несомненно считаются перспективными», – отметила профессор И.В. Гурьева в заключение.
Алкогольные полиневропатии. Вопросы патогенеза и лечения
А лкогольная полиневропатия является классической моделью токсической и дефицитарной полиневропатии. Известно, что одним из основных патогенетических механизмов алкогольной полиневропатии считается прямое токсическое действие этанола и его метаболитов. По словам профессора кафедры нервных болезней Первого МГМУ им. И.М. Сеченова, д.м.н. Ольги Евгеньевны ЗИНОВЬЕВОЙ, вследствие метаболизма этанола образуются цитотоксические белки, в первую очередь ацетальдегид, которые поражают клетки центральной и периферической нервной системы. Согласно данным литературы, посвященной проблеме хронической алкогольной интоксикации, у 50–67% пациентов, страдающих хронической алкогольной интоксикацией, отмечаются признаки невропатии, у 40–60% – миопатии алкогольного генеза. Наиболее частым проявлением алкогольной болезни является алкогольная полиневропатия. Среди полиневропатий с выраженным болевым синдромом алкогольная полиневропатия занимает второе место, уступая лишь диабетической полиневропатии.
Алкогольные полиневропатии – это неоднородная в патогенетическом отношении группа. При преимущественной невропатии тонких волокон прежде всего нарушаются вегетативные функции и поверхностная чувствительность. В случае невропатии толстых волокон сначала страдает глубокая чувствительность, потом появляется двигательный дефект и только потом снижается поверхностная чувствительность. С научной точки зрения в основе патогенеза алкогольной полиневропатии могут лежать два механизма – прямое токсическое действие этанола и его метаболитов и дефицит витаминов группы В, в частности тиамина, вследствие недостаточного питания и синдрома мальабсорбции. При алкогольной полиневропатии без дефицита тиамина, когда ведущим патогенетическим механизмом выступает токсическое воздействие метаболитов этанола на периферические нервы, преимущественно страдают тонкие волокна и в 25–45% случаев развивается невропатическая боль. Это дистальная симметричная сенсорная невропатия с первичным поражением волокон поверхностной чувствительности и хроническим прогрессирующим течением.
При постановке диагноза ее следует дифференцировать с другими токсическими и дисметаболическими невропатиями, а также с наследственными сенсорно-вегетативными невропатиями. При алкогольной полиневропатии с дефицитом тиамина страдают как тонкие, так и толстые волокна периферических нервов, а невропатическая боль развивается только у 10–20% больных. Это дистальная симметричная сенсорно-моторная невропатия, которая характеризуется как острым, так и хроническим прогрессированием. При постановке диагноза врачу следует ее дифференцировать с воспалительными демиелинизирующими невропатиями, наследственными моторно-сенсорными невропатиями, с подострой комбинированной дегенерацией спинного мозга. Безусловно, основу этиотропного лечения тяжелой алкогольной полиневропатии составляет отказ от приема алкоголя, однако, как показывает ряд исследований и собственный клинический опыт, это не всегда приводит к регрессу клинических и морфологических признаков заболевания.
«В этой связи даже знание ведущего этиологического фактора не освобождает нас от необходимости проводить патогенетическую терапию больным алкогольными полиневропатиями – заместительную терапию нейротропными витаминами при полидефицитарном состоянии и антиоксидантную терапию в сочетании с симптоматической терапией невропатической боли (рис. 2)», – уточнила профессор О.Е. Зиновьева. На сегодняшний день установлено, что алкоголизм является наиболее частой причиной тиаминдефицитного состояния в развитых странах: снижение концентрации тиамина в крови отмечается у 80% пациентов с хронической алкогольной интоксикацией. В этом случае целесообразно использовать в лечении жирорастворимую форму тиамина – бенфотиамин. Бесспорными преимуществами бенфотиамина считаются высокая абсорбция и биодоступность (в 5 раз выше тиамина), резистентность к тиаминазе кишечника, низкая токсичность, хорошая переносимость. Бенфотиамин значительно лучше тиамина проникает через гематоневральный барьер и способствует улучшению функции периферических нервов.
В исследовании с участием пациентов с алкогольной дефицитарной полиневропатией было установлено, что на фоне терапии бенфотиамином в первую очередь улучшалась вибрационная чувствительность, а также двигательная функция. Полученные результаты подтверждались при электромиографическом исследовании, в ходе которого отмечалось увеличение скорости распространения возбуждения по двигательным и чувствительным нервам конечностей9. Доказано, что нейротропные витамины обладают анальгетическим эффектом, механизм которого заключается в усилении действия норадреналина и серотонина, в ингибировании медиаторов воспаления и уменьшении сенситизации на уровне задних рогов спинного мозга и зрительного бугра. По мнению профессора О.Е. Зиновьевой, их действие сродни действию адъювантных анальгетиков, которые обычно используются при лечении невропатической боли. Патогенетическая терапия нейротропными витаминами позволяет купировать болевой синдром при умеренной интенсивности боли, которая не превышает 4–5 баллов по визуально-аналоговой шкале.
В целом неврологическая симптоматика у больных с дефицитом тиамина прогрессирует более быстрыми темпами, чем в случаях алкогольной полиневропатии с нормальным содержанием тиамина. Профессор О.Е. Зиновьева выделила возможность назначения пациентам с дефицитарной алкогольной полиневропатией препарата Мильгамма, в состав которого входит комбинация нейротропных витаминов (B₆ участвует в синтезе ключевых нейромедиаторов, обеспечивает синаптическую передачу; B₁₂ участвует в синтезе миелиновой оболочки, обладает анальгетическим свойством; B₁ обеспечивает аксональный транспорт, участвует в синтезе аденозинтрифосфата). При увеличении интенсивности боли следует назначать антиконвульсанты второго поколения. Их ярким представителем является препарат Габагамма (габапентин) – структурный аналог гамма-аминомасляной кислоты.
Незаменимой в лечении алкогольной полиневропатии является альфа-липоевая кислота, которая оказывает антиоксидантное (нейропротекторное), дезинтоксикационное, гепатопротекторное, гиполипидемическое действие. Переносимость альфа-липоевой кислоты обусловлена используемой в препаратах солью. Большинство препаратов содержат этилендиаминовую соль, применение которой характеризуется выраженными побочными эффектами (контактный дерматит, раздражение кожи и слизистых оболочек, аллергические реакции). Реже в состав препаратов альфа-липоевой кислоты входит трометамоловая соль, внутривенное введение которой чревато развитием гиперкалиемии, депрессии дыхания, диареи, гипотонии и др. В этой связи следует отметить меглютаминовую соль, которая содержится в препарате Тиогамма. Нежелательные явления при приеме меглютаминовой соли незначительны – могут развиться головные боли, чувство усталости и проходящее жжение в месте инъекции. Препарат Тиогамма выпускается в разных лекарственных формах (таблетки, ампулы, флаконы), что позволяет применять поэтапный подход к лечению пациентов с тяжелой невропатией – от парентерального до перорального.
По словам профессора О.Е. Зиновьевой, в целом тактика ведения больных алкогольной полиневропатией определяется стадией заболевания и требует назначения комбинированной терапии – препаратов Тиогамма и Мильгамма. В случае полиневропатии с выраженным функциональным дефектом следует начинать лечение с инъекционных форм с последующим переходом на пероральный прием. В заключение докладчик представила следующую схему лечения полиневропатии препаратами Тиогамма и Мильгамма/Мильгамма композитум:
стадия полиневропатии с выраженным функциональным дефектом:
- 1-й этап: в/в – Тиогамма № 15; в/м – Мильгамма № 10;
- 2-й этап: перорально – Тиогамма 600 мг/сут, Мильгамма композитум – по 1 драже 3 раза в день длительно (не менее 2 месяцев);
Заключение
В рамках симпозиума были рассмотрены возможности патогенетической терапии, направленной на отсрочку, замедление, остановку прогрессирования невропатических повреждений. Отмечалось, что бенфотиамин и альфа-липоевая кислота могут оказать положительное влияние на механизмы развития невропатии. Бенфотиамин ингибирует метаболические процессы, вовлеченные в патогенез невропатий, стимулируя метаболические пути, препятствующие их развитию. Альфа-липоевая кислота является эффективным антиоксидантом и может частично ингибировать патогенетические процессы, вызванные окислительным стрессом. Были представлены убедительные доказательства патогенетических возможностей нейротропных витаминных комплексов Мильгамма и Мильгамма композитум, в состав которых входят терапевтические дозировки витаминов группы В, а также препарата альфа-липоевой кислоты Тиогамма в схемах лечения пациентов, страдающих диабетическими и алкогольными полиневропатиями. Был также отмечен хороший обезболивающий эффект антиконвульсанта второго поколения – препарата Габагамма.
1. Pop-Busui R., Evans G.W., Gerstein H.C. et al. Effects of cardiac autonomic dysfunction on mortality risk in the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial // Diabetes Care. 2010. Vol. 33. № 7. P. 1578–1584.
2. Albers J., Herman W.H., Pop-Busui R. et al. Effect of prior intensive insulin treatment during the Diabetes Control and Complications Trial (DCCT) on peripheral neuropathy in type 1 diabetes during the Epidemiology of Diabetes Interventions and Complications (EDIC) Study // Diabetes Сare. 2010. Vol. 33. № 5. P. 1090–1096.
3. Dunnigan S.K., Ebadi H., Breiner A. et al. Conduction slowing in diabetic sensorimotor polyneuropathy // Diabetes Care. 2013. Vol. 36. № 11. P. 3684–3690.
4. Brownlee M. Biochemistry and molecular cell biology of diabetic complications // Nature. 2001. Vol. 414. № 6865. P. 813–820.
5. Stirban A., Negrean M., Stratmann B. et al. Benfotiamine prevents macro- and microvascular endothelial dysfunction and oxidative stress following a meal rich in advanced glycation end products in individuals with type 2 diabetes // Diabetes Care. 2006. Vol. 29. № 9. P. 2064–2071.
6. Маркина О.А. Значение лекарственной формы и пути введения витаминов группы В для обеспечения эффективного лечения диабетической полиневропатии // Клиническая фармакология и терапия. 2003. № 2. С. 6–9.
7. Stracke H., Gaus W., Achenbach U. et al. Benfotiamine in Diabetic Polyneuropathy (BENDIP): results of a randomised, double-blind, placebo-controlled clinical study // Exp. Clin. Endocrinol. Diabetes. 2008. Vol. 116. № 10. P. 600–605.
8. Tesfaye S., Boulton A.J., Dyck P.J. et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity and treatments // Diabetes Care. 2010. Vol. 33. № 10. P. 2285–2293.
9. Strake H., Lindenmann A., Federlin K. A benfotiamine-vitamin B combination in treatment of diabetic polyneuropathy // Exp. Clin. Endocrinol. Diabetes. 1996. Vol. 104. № 4. P. 311–316.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


