Пертузумаб: рекордная выживаемость при HER2-положительном метастатическом раке молочной железы
- Аннотация
- Статья
- Ссылки
- English
Введение
В течение последних десятилетий терапия рака молочной железы (РМЖ) претерпела существенные изменения. Определение уровня экспрессии в опухоли рецепторов эстрогенов, рецепторов прогестерона и рецептора HER2 стало рутинной практикой во всех российских онкологических центрах. Гиперэкспрессия HER2 в опухоли выявляется у 20–25% больных РМЖ. Планирование противоопухолевого лечения начинается с определения подтипа РМЖ.
До начала эры таргетной терапии больные HER2-положительным метастатическим РМЖ составляли группу крайне неблагоприятного прогноза. Появление сначала таргетного препарата трастузумаба, затем лапатиниба, а главное – возможность использования этих препаратов в рутинной практике коренным образом изменили судьбу больных HER2-положительным РМЖ [1–3]. Добавление к химиотерапии первой линии трастузумаба позволило значительно увеличить выживаемость без прогрессирования и общую выживаемость при метастатическом HER2-положительном РМЖ [4]. Теперь пациентки с метастатическим РМЖ могут успешно получать одну линию терапии в течение нескольких лет.
К сожалению, часть больных не отвечает на терапию трастузумабом или перестает отвечать на нее спустя время после начала терапии. Примерно у 15% больных HER2-положительным РМЖ отмечается первичная или приобретенная резистентность к трастузумабу [5]. Научный поиск в этой области привел к разработке еще одного анти-HER2-препарата – пертузумаба.
Пертузумаб является гуманизированным моноклональным антителом, связывается с внеклеточным доменом II рецептора HER2 опухоли и препятствует димеризации (образованию пар) рецепторов. Пертузумаб и трастузумаб имеют разные точки приложения на рецепторе HER2.
Семейство рецепторов эпидермального фактора роста хорошо изучено. В него входят четыре трансмембранных тирозинкиназных рецептора: EGFR (erB1), HER2 (erB2), HER3 (erB3) и HER4 (erB4). HER2 отличается от других рецепторов семейства тем, что для его активации не требуется соединения с лигандом. Во внеклеточном домене рецептора HER2 различают четыре части с различными функциями. Пертузумаб блокирует субдомен II, который необходим для димеризации с другими рецепторами семейства erB, а трастузумаб блокирует субдомен IV. Все рецепторы эпидермального фактора роста активны только в виде димеров, причем могут образовываться не только гомодимеры (например, HER2/HER2), но и более активные гетеродимеры. Наиболее активным гетеродимером является HER2/HER3. Считается, что именно образование таких пар рецепторов способствует развитию резистентности к трастузумабу.
Исследования трастузумаба и пертузумаба
В исследовании второй фазы монотерапия пертузумабом при метастатическом РМЖ оказалась эффективной после прогрессирования на фоне трастузумаба [6]. Понимание механизма действия пертузумаба позволяет предположить, что пертузумаб и трастузумаб должны использоваться одновременно для блокирования различных субдоменов рецептора HER2 и прерывания нескольких сигнальных путей. В исследовании второй фазы больные метастатическим РМЖ после прогрессирования на фоне трастузумаба получали комбинацию пертузумаба и трастузумаба. Новая комбинация продемонстрировала высокую эффективность и благоприятный профиль токсичности [7].
Эффективность комбинации пертузумаба и трастузумаба изучали в международном двойном слепом плацебоконтролируемом исследовании III фазы WO20698 CLEOPATRA [8]. Эффективность терапии первой линии HER2-положительного метастатического РМЖ в режиме «пертузумаб + трастузумаб + доцетаксел» сравнивали с таковой комбинации «трастузумаб + доцетаксел». В исследовании участвовали 808 пациенток с HER2-положительным метастатическим РМЖ, ранее не получавших лечения по поводу метастатической болезни. Первичной целью исследования стала выживаемость без прогрессирования по независимой оценке экспертов, дополнительными целями – общая выживаемость и профиль безопасности. Средний возраст больных составил 54 года (27–89 лет). У 48% пациенток опухоль была эстроген- и/или прогестерон-положительной. Неоадъювантную или адъювантную терапию ранее получили 47% больных. Следует отметить, что лишь 10,5% пациенток ранее получили адъювантные режимы, содержавшие трастузумаб. С того момента прошло более 12 месяцев. У 78% больных имели место висцеральные метастазы.
Пертузумаб назначали в нагрузочной дозе 840 мг, затем по 420 мг один раз в три недели, трастузумаб – в стандартном режиме: нагрузочная доза 8 мг/кг, затем по 6 мг/кг один раз в три недели. Доцетаксел в дозе 75 мг/м2 вводили также один раз в три недели. Была предусмотрена эскалация дозы доцетаксела до 100 мг/м2 при отсутствии выраженной гематологической токсичности. После минимум шести (или более до достижения максимального ответа) циклов доцетаксела в отсутствие прогрессирования пациентки продолжали получать только таргетную терапию в режиме «пертузумаб + трастузумаб» или «плацебо + трастузумаб». Уже первый промежуточный анализ при медиане наблюдения 19,3 месяца продемонстрировал высокую эффективность новой комбинации. Объективный ответ (полный + частичный) был достигнут у 80,2% больных в группе двух анти-HER2-препаратов и у 69,3% больных группы «плацебо + трастузумаб» (p = 0,001). По оценке независимых экспертов, медиана выживаемости без прогрессирования в группе больных, получавших комбинацию «пертузумаб + трастузумаб + доцетаксел», достигла 18,5 месяца. В группе трастузумаба и доцетаксела аналогичный показатель составил 12,4 месяца (относительный риск (ОР) 0,62; 95%-ный доверительный интервал (ДИ) 0,51–0,75; p < 0,001). Таким образом, первичная цель исследования была достигнута. В подгруппе больных, которые ранее не получали трастузумаб, различие в показателях медианы выживаемости без прогрессирования было еще значительнее – 21,6 и 12,6 месяца соответственно (ОР 0,6; 95% ДИ 0,43–0,83).
Второй промежуточный анализ был проведен при медиане наблюдения 29,7 месяца в основной группе и 30,1 месяца – в контрольной [9]. Второй промежуточный анализ продемонстрировал впечатляющее преимущество нового режима. Отношение рисков смерти от прогрессирования РМЖ составило 0,66 (р = 0,0008). В связи с этим был проведен кроссовер и больных группы плацебо перевели на более эффективную терапию комбинацией пертузумаба и трастузумаба.
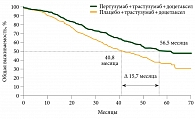
В 2014 г. был представлен финальный анализ данных об общей выживаемости при медиане наблюдения 50 месяцев [10]. Медиана общей выживаемости в группе пертузумаба, трастузумаба и доцетаксела составила 56,5 месяца, в группе плацебо, трастузумаба и доцетаксела – 40,8 месяца (ОР 0,68; 95% ДИ 0,56–0,84; p = 0,0002) (рис. 1). На основании данных исследования CLEOPATRA комбинация «трастузумаб + пертузумаб + доцетаксел» была рекомендована в качестве первой линии терапии метастатического HER2-положительного РМЖ. Наиболее частыми (частота свыше 25% или разница между группами, превышающая 5%) нежелательными явлениями, зарегистрированными в группе пертузумаба, были диарея, сыпь, воспаление слизистых оболочек, головная боль, инфекции верхних дыхательных путей, зуд, фебрильная нейтропения, сухость кожи, мышечные спазмы.
Был проведен подгрупповой анализ в зависимости от возраста пациенток (< 65 лет и > 65 лет) [11]. Интересно, что в подгруппе больных в возрасте 65 лет и старше, которых в исследовании было 15,7%, отмечалась очень высокая эффективность исследуемой комбинации. Более пожилые больные получили в среднем шесть циклов терапии доцетакселом против восьми циклов у больных моложе 65 лет. Объективный ответ у пациенток в возрасте 65 лет и старше зафиксирован в 84% случаев в группе пертузумаба и 75,9% случаев в группе плацебо. Объективный ответ у пациенток моложе 65 лет имел место в 79,5% случаев в группе пертузумаба и 68% случаев в группе плацебо. Медиана выживаемости без прогрессирования для больных в возрасте 65 лет и старше составила 21,6 месяца в группе пертузумаба и 10,4 месяца в группе плацебо (ОР 0,52; 95% ДИ 0,31–0,86). У пациенток моложе 65 лет аналогичный показатель достиг 17,2 месяца в группе пертузумаба и 12,5 месяца в группе плацебо (ОР 0,65; 95% ДИ 0,53–0,80). Интерпретировать полученные данные следует осторожно, поскольку подгруппа пожилых больных была относительно невелика, у них реже отмечались висцеральные метастазы, не так много больных ранее получали трастузумаб. Тем не менее для клинической практики важно, что проведение шести циклов с использованием комбинации «пертузумаб + трастузумаб + доцетаксел» оказалось высокоэффективным. Частота развития нежелательных явлений у пожилых пациенток была несколько выше, чаще развивались диарея, периферическая нейропатия. В то же время влияния на функцию сердечной мышцы не зарегистрировано.
Данные исследования CLEOPATRA показывают, что комбинация «пертузумаб + трастузумаб + доцетаксел» наиболее эффективна в первой линии терапии HER2-положительного метастатического РМЖ.
Клинический случай
Больная Б. 1952 г. р.
Диагноз: рак левой молочной железы T4bN1M0, состояние после комплексного лечения в 2008 г. Прогрессирование в 2009 г. Метастатическое поражение костей и печени (IV клиническая группа).
В марте 2008 г. выявлен рак левой молочной железы T4bN1M0. Гистологическое заключение (трепан-биопсия) – инфильтрирующий рак молочной железы. При иммуногистохимическом исследовании рецепторы эстрогенов – 7, рецепторы прогестерона – 4, HER2-«3+». Было проведено комплексное лечение: четыре цикла неоадъювантной химиотерапии по схеме FAC (фторурацил, доксорубицин, циклофосфамид), радикальная мастэктомия по Маддену слева, послеоперационная лучевая терапия (40–46 Гр), четыре цикла адъювантной химиотерапии по схеме FAC (суммарная доза доксорубицина – 326 мг/м2). Гистологическое исследование послеоперационного материала: инфильтрирующий протоковый рак, первая степень лечебного патоморфоза. Метастаз в одном из 16 лимфоузлов. Адъювантная химиотерапия завершена в ноябре 2008 г. В декабре 2008 г. пациентка начала получать тамоксифен 20 мг/сут.
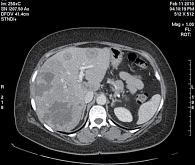
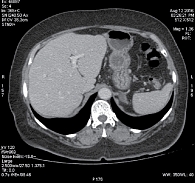
Прогрессирование заболевания в декабре 2009 г. Выявлен метастаз в правом тазобедренном суставе. Проведена лучевая терапия 25 Гр (по 5 Гр) на эту область. В январе 2010 г. обнаружены метастазы в печени. В феврале 2010 г., по данным компьютерной томографии органов грудной клетки, брюшной полости и малого таза с внутривенным контрастированием, в печени (рис. 2) определены множественные метастатические очаги. Наибольшие из них в S7 – 7 × 6 см, S5/S8 – 6,5 × 4,2 см, S8 – 3,7 × 2,9 см, S3 – 3,1 × 2,2 см, S1 – 4 × 2,3 см. Кроме того, были обнаружены множественные метастазы в костях таза.
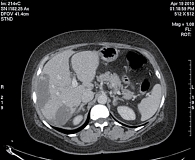
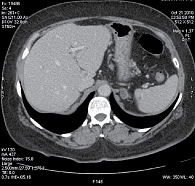
С февраля 2010 г. больная стала участницей исследования CLEOPATRA. Пациентке проведено шесть циклов химиотерапии в сочетании с таргетной терапией: пертузумаб назначали в нагрузочной дозе 840 мг, затем по 420 мг один раз в три недели, трастузумаб в нагрузочной дозе 8 мг/кг, затем по 6 мг/кг один раз в три недели, доцетаксел в дозе 75 мг/м2 один раз в три недели. Эскалация дозы доцетаксела не проводилась. При первой оценке через девять недель от начала терапии (после трех циклов) отмечался частичный ответ очагов в печени, очаги уменьшились на 31,6% по критериям RECIST (рис. 3). При оценке ответа на терапию через 18 недель от ее начала эффект продолжал нарастать и регресс измеряемых очагов печени составил 40,3% по сравнению с размерами очагов до лечения. После проведения шести циклов, с июня 2010 г., больная перестала получать доцетаксел и получала только таргетную терапию «пертузумаб + трастузумаб» один раз в три недели. Размеры метастатических очагов печени продолжали уменьшаться. Через 27 недель от начала терапии регресс составил 51%. При проведении компьютерной томографии через 36 недель от начала лечения регресс очагов составил 62,9%: в S7 – 2,9 × 1,6 см, S5/S8 – 5,2 × 2,9 см, S8 – 0,9 × 0,5 см. Очаги в S3 и S1 перестали определяться (рис. 4). В костях таза сохранялась стабилизация. При этом полностью отсутствовал болевой синдром.
Достигнутый в октябре 2010 г. частичный ответ сохраняется по настоящее время (рис. 5). Длительность первой линии терапии на данный момент составляет 79 месяцев. Состояние пациентки в течение терапии удовлетворительное (ECOG 1). Нежелательные явления были связаны только с терапией доцетакселом – нейтропения 3–4-й степени, тошнота 2-й степени, алопеция 2-й степени. С момента окончания терапии доцетакселом нежелательных явлений, связанных с применением трастузумаба или пертузумаба, не зарегистрировано. Гематологической и негематологической токсичности не зафиксировано. Масса тела пациентки остается стабильной. Больная ведет активный образ жизни. Показатели качества жизни, оцениваемые по опроснику FACT-B, стабильны в течение шести лет.
Обсуждение
Рассмотренный клинический случай иллюстрирует высокую эффективность комбинации «пертузумаб + трастузумаб + доцетаксел» в первой линии терапии метастатического HER2-положительного РМЖ. У пациентки имели место множественные висцеральные метастазы, распространенность метастатического процесса послужила показанием к проведению агрессивной химиотерапии в сочетании с таргетной терапией. У больной был определен суррогатный подтип опухоли – люминальный В (HER2-положительный). Стандартной терапией на момент включения пациентки в исследование считалась комбинация таксанов и трастузумаба. Добавление трастузумаба к доцетакселу в исследовании M77001 позволило добиться увеличения частоты общего ответа до 61% по сравнению с 34% в группе монотерапии доцетакселом (p = 0,0002) [4]. Статистически значимым стал выигрыш медианы времени до прогрессирования заболевания: 11,7 месяца в группе трастузумаба и доцетаксела по сравнению с 6,1 месяца в группе доцетаксела (p = 0,0001). Медиана общей выживаемости в группе трастузумаба и доцетаксела составила 31,2 месяца против 22,7 месяца в группе доцетаксела (p = 0,0325). Причем в случае прогрессирования процесса больным группы монотерапии доцетакселом назначали трастузумаб. Из 92 больных, получавших трастузумаб и доцетаксел, общий объективный эффект наблюдался у 62% больных с общей выживаемостью 31,2 месяца. Трехлетний рубеж пережили 30,4% пациенток.
Первичной целью исследования CLEOPATRA была выживаемость без прогрессирования по оценке независимых экспертов. Результаты исследования продемонстрировали cтатистически значимый выигрыш в выживаемости без прогрессирования. Медиана выживаемости без прогрессирования в группе пертузумаба была на 6,1 месяца больше, чем в группе плацебо, – 18,5 и 12,4 месяца соответственно (ОР 0,62; 95% ДИ 0,51–0,75; p < 0,001). Что касается рассмотренного клинического случая, выживаемость без прогрессирования или продолжительность первой линии терапии составила уже 79 месяцев, то есть метастатический РМЖ с висцеральными метастазами стал действительно хроническим заболеванием.
Возраст больной на момент начала терапии составлял 57 лет, у нее не было выявлено каких-либо противопоказаний к проведению химиотерапии. Пациентка относилась к группе больных моложе 65 лет. Частота объективного ответа при назначении пертузумаба у таких больных достигала 79,5%. Частота достижения объективного ответа у больных моложе 65 лет контрольной группы (трастузумаб и доцетаксел) также была достаточно высокой – 68%. Комбинация продемонстрировала высочайшую частоту объективного ответа. Он был получен у каждых четырех из пяти больных. В момент, когда пациентка получила шесть циклов комбинации «пертузумаб + трастузумаб + доцетаксел», регресс измеряемых метастатических очагов в печени по критериям RECIST составил 40,3%. Такую выраженную регрессию исследователи расценили как максимально возможную. При последующих оценках степень выраженности клинического ответа возрастала после того, как химиотерапия доцетакселом была завершена и больная продолжала получать только таргетную терапию. Максимальное уменьшение очагов было достигнуто через 36 недель от начала терапии и составило 62%.
Ряд режимов химиотерапии при метастатическом РМЖ позволяет добиться высокого уровня объективного ответа и увеличения выживаемости без прогрессирования. Но увеличение частоты объективного ответа и выживаемости без прогрессирования зачастую не приводит к увеличению общей выживаемости. В исследовании CLEOPATRA медиана общей выживаемости составила 56,5 месяца. Был получен уникальный рекордный выигрыш в медиане общей выживаемости – 15,7 месяца (p = 0,0002). Профиль токсичности режима «пертузумаб + трастузумаб + доцетаксел» удовлетворительный. Уникальность, несомненно, заключается в том, что после минимум шести циклов с доцетакселом больная переходит на терапию двумя таргетными препаратами, которые не вызывают тяжелой гематологической токсичности, тошноты, алопеции. Режим терапии позволяет больным длительно вести привычный образ жизни, качество жизни не снижается.
Данные исследования CLEOPATRA послужили основанием для регистрации комбинации пертузумаба, трастузумаба и доцетаксела в США, Европе и России в качестве режима первой линии терапии метастатического или местно-распространенного неоперабельного HER2-положительного РМЖ. В России комбинация из двух препаратов пертузумаба и трастузумаба зарегистрирована под названием Бейодайм.
Заключение
На фоне применения комбинации «пертузумаб + трастузумаб + доцетаксел» в исследовании CLEOPATRA были достигнуты рекордная выживаемость без прогрессирования и общая выживаемость. Продолжительность жизни пациентки с момента начала лечения составила 79 месяцев без признаков прогрессирования заболевания. Удовлетворительная переносимость, отсутствие серьезных нежелательных явлений, хорошее качество жизни позволяют проводить длительную непрерывную терапию.
Применение режима «пертузумаб + трастузумаб + доцетаксел» делает HER2-положительный метастатический РМЖ действительно хроническим заболеванием.
M.V. Kopp, I.A. Koroleva, A.A. Nizhegorodtseva, A.V. Balandina, Ye.V. Makarova-Gorbacheva
Medical University ‘Reaviz’, Samara
Samara Regional Clinical Oncologic Dispensary
Contact person: Mikhail Valeryevich Kopp, mvkopp@mail.ru
Here we describe a clinical case of efficient long-term use of the combination of ‘pertuzumab + trastuzumab + docetaxel’ in patient with HER2-positive metastatic breast cancer in clinical trial WO20698 CLEOPATRA. A regression of liver metastasis was 62%. Now duration of therapy is 79 months without signs of progression and with a good quality of life. In trial CLEOPATRA regimen ‘pertuzumab + trastuzumab + docetaxel’ gave benefit in survival without progression 6.1 months (HR 0.62; 95% CI 0.51–0.75; p < 0.001). Made a record benefit in overall survival – 15.7 months (HR 0.68; 95% CI 0.56–0.84; p = 0.0002). Combination pertuzumab + trastuzumab + docetaxel is recommended for 1st line therapy for HER2-positive metastatic or advanced inoperable breast cancer.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.