Возможности преодоления гепатотоксичности при проведении комбинированного и комплексного лечения рака молочной железы
- Аннотация
- Статья
- Ссылки




Рак молочной железы (РМЖ) занимает первое место в структуре онкологической заболеваемости среди женщин [1]. По данным Международного агентства по изучению рака (International Agency For Research On Cancer – IARC), в мире ежегодно регистрируют более 1 млн женщин с впервые выявленным РМЖ; каждый год более 600 тыс. больных погибают от РМЖ [2]. В Европе ежегодно регистрируется около 250 тыс. новых случаев РМЖ, из них около 60 тыс. – с летальным исходом [3]. В Российской Федерации ежегодно под наблюдением находится свыше 400 тыс. женщин с РМЖ, причем если распространенность РМЖ в России в 1997 г. составляла 214,7, то в 2007 г. – уже 318,0 на 100 тыс. населения [4, 5].
Комбинированное и комплексное лечение РМЖ, включающее в себя хирургическое лечение, химио- и гормонотерапию, лучевое воздействие, достоверно увеличивает безрецидивную и в ряде случаев общую выживаемость больных РМЖ. Однако большое число осложнений, приводящих к ухудшению качества жизни, ограничению достижения максимального эффекта, существенному увеличению стоимости лечения, ставит проблему профилактики и лечения токсических реакций у онкологических больных в ряд не только медицинских, но и социально значимых проблем.
В печени осуществляется активация и распад большинства лекарственных препаратов, токсические метаболиты которых могут повреждать этот орган. Данные о частоте гепатотоксичности (ГТ) варьируют от 14,3 до 100% [6–9]. Подобные различия могут быть обусловлены различными механизмами действия гепатотоксичных агентов, отличиями в методиках и критериях выявления ГТ [10]. Кроме того, выбранная в соответствии с протоколом исследования схема обязательных визитов для оценки состояния больного, решения вопроса о возможности продолжения или коррекции лечения является одним из важнейших факторов определения соответствия критериям включения и исключения. Однако подобная частота визитов не позволяет отследить все случаи токсичности, разрешившиеся к началу следующего визита, что также определяет целесообразность учета всех выполненных анализов.
Ранее мы обобщили данные о частоте и факторах риска ГТ по литературным источникам [11] и результатам проведенного нами ретроспективного мультицентрового исследования типа «случай – контроль» на модели комбинированного и комплексного лечения РМЖ [12–16].
Целью данной статьи явилось представление результатов дальнейшего анализа частоты и факторов риска ГТ с учетом всех визитов, как обязательных, так и дополнительных, что позволит оптимизировать профилактику и эффективное преодоление нежелательных побочных явлений, включая ГТ, комбинированного и комплексного лечения РМЖ.
Материал и методы
Объект и объем исследования. Всего проанализировано более 4200 архивных историй болезни и 2900 амбулаторных карт больных с РМЖ в 4 клиниках Москвы и Самары за период 1993–2003 гг. В исследование были включены 1643 больных, пролеченных/проконсультированных в соответствии с медико-экономическими стандартами лечения РМЖ. Возрастной диапазон больных был 28–72 года. В течение 5 лет прослежены истории болезни 607 больных, остальные за этот период времени выбыли из исследования по разным причинам. Диагноз РМЖ был подтвержден данными цитологического и/или гистологического исследования. Обязательная гистологическая верификация осуществлялась на основании анализа операционного материала.
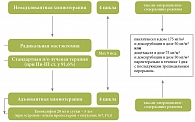
Согласно протоколу исследования, нами оценивалась токсичность только у тех пациенток, которые смогли завершить курс комбинированного и комплексного лечения РМЖ. То есть явления ГТ не должны были превышать степень I и II в соответствии с рекомендациями Национального ракового института США (National Cancer Institute Cancer Therapy Evaluation Program: Toxicity Criteria) [17]. Схема комбинированного и комплексного лечения РМЖ и дизайн исследования отражены на рисунках 1 и 2.
Результаты и обсуждение
При проведении адъювантной и неоадъювантной терапии наличие сочетанных изменений по данным ультразвуковой картины отражало незначительную тенденцию к увеличению количества пациентов с наличием изменений по данным УЗИ (46,7% по сравнению с исходными 44,0%; р = 0,11).
Всего отклонения от нормы по данным биохимических исследований исходно зарегистрированы в 75 случаях (4,6% всех обследованных). Основными причинами отклонений были неалкогольный стеатогепатит (2,6% обследованных), вирусные гепатиты В и С (в совокупности 1,0% обследованных). В 15 случаях (0,9% обследованных) причина исходного повышения уровня маркеров не установлена. В 3 случаях у больных вирусным гепатитом С имелись также признаки неалкогольного стеатогепатита.
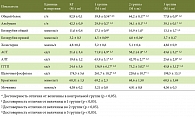
При анализе биохимических маркеров острой ГТ при обязательных визитах наиболее частыми отклонениями были повышенные уровни ГГТ, которые наблюдались в среднем за период исследования у 26,7% пациентов; значения щелочной фосфатазы повышались у 26,1% больных. Повышенные уровни АЛТ и АСТ регистрировались в среднем у 21,8% и 21,0% больных соответственно. Повышение уровня общего билирубина было в среднем у 6,7%. ГТ отсутствовала у 1034 (73,3 ± 1,2%) пациенток. ГТ при плановых визитах, в соответствии с критериями нашего исследования, выявлялась у 376 (26,7 ± 1,2%) из всех обследованных больных, I степень ГТ была у 342 (24,3 ± 1,1%), II степень ГТ – у 2,4 ± 0,4% больных.
Наряду с плановыми зарегистрированы дополнительные визиты. Они определялись необходимостью контроля как в связи с развитием токсических реакций, так и в связи с наличием фоновой патологии, а также c усугублением токсичности, в том числе и ГТ.
Для реализации возможности проведения статистического анализа было решено включать по одному наихудшему показателю за весь период наблюдения у каждого больного вне стандартных визитов. Таких больных с дополнительно проведенными анализами оказалось 1315, что составило 80% от числа включенных в исследование пациенток с РМЖ. Мы отметили преобладание частоты ГТ на внеплановых визитах по сравнению с обязательными. Так, ГТ не выявлялась на обязательных визитах у 73,3 ± 1,2% и отсутствовала у 60,9 ± 1,8% больных на дополнительных визитах (р < 0,05). В целом ГТ выявлялась у 26,7 ± 1,2 и 39,1 ± 1,8% соответственно (р < 0,05), причем прирост частоты ГТ происходил в основном за счет увеличения частоты II степени и появления ГТ III степени. Так, мы отметили только тенденцию к увеличению частоты ГТ I степени (24,3 ± 1,1 и 27 ± 1,2% соответственно). В то же время регистрировалось достоверное увеличение частоты ГТ II степени (2,4 ± 0,4% и 7,9 ± 0,7% соответственно, р < 0,05) и появление в 4,2% случаев ГТ III степени. Причина подобных отличий, на наш взгляд, очевидна – согласно стандартной процедуре обследования больного, получающего химиотерапевтическое лечение, особенно в амбулаторных условиях или в условиях дневного стационара, контрольное клинико-инструментальное исследование осуществляется, как правило, перед проведением курса полихимиотерапии. Подобная тактика определенно помогает принять решение о возможности продолжения лечения в контрольные сроки, и/или необходимости изменения доз препаратов исходя из площади тела, и/или изменения схемы лечения. В то же время, согласно полученным данным, частота реальной ГТ на внеплановых визитах была значительно выше, так как определялась после проведения курса полихимиотерапии. Кроме того, в не установленные протоколом исследования сроки регистрировались и более тяжелые гепатотоксические реакции (III степени), редуцировавшиеся к моменту очередного планового визита, вследствие чего их наличие не являлось критерием исключения. Больные с развитием ГТ IV степени не вошли в анализируемую когорту, вследствие того что она характеризовалась определенной резистентностью к проводимой терапии и требовала временной отмены полихимиотерапии, а в ряде случаев ее полного прекращения. Данное течение ГТ являлось критерием невключения в соответствии с дизайном исследования.
За 5 лет наблюдения повышение уровней АЛТ регистрировалось в среднем по визитам у 7,06% (6,7–7,42%), АСТ – у 5,86% (5,52–6,2%), щелочной фосфатазы – у 4,89% (4,46–5,53%), ГГТ – у 4,03% (3,59–4,46%), общего билирубина – у 4,20% (4,12–4,28%) больных. В среднем за весь 5-летний период наблюдения любые отклонения биохимических маркеров во время обязательных визитов наблюдались у 7,6% (95-процентный ДИ 7,19–8,0%) больных. Максимальная доля обследованных с любыми отклонениями биохимических данных наблюдалась на визите 10 – 25,6%. Этот эффект, вероятно, объясняется тем, что результаты, полученные на визите 10, отражают те изменения, которые наблюдаются спустя 3 месяца после окончания химиотерапии, и за этот промежуток времени нормализация биохимических показателей происходила не у всех больных. Кроме того, видимо, часть больных с удовлетворительным самочувствием не являлись на этот визит (равно как и последующие), и, таким образом, база данных может отражать несколько завышенные показатели по сравнению с реально существующими показателями по данным обязательных визитов. Достоверное снижение доли больных, имевших любые отклонения биохимических маркеров по сравнению с данными на момент окончания курса химиотерапии, наблюдалось уже в ходе следующего, 11-го визита – 17,6% (критерий статистической значимости р = 0,008).
Сравнение уровня биохимических маркеров на последнем обязательном визите спустя 5 лет после окончания лечения не выявило статистически значимых различий по сравнению с исходными данными: 4,45% пациентов с любыми отклонениями биохимических маркеров крови по сравнению с 4,6%. Большинство больных с поздней ГТ имели отклонения, соответствующие критериям I степени.
Факторы риска острой и поздней ГТ. Исходно повышенные уровни АЛТ, АСТ, щелочной фосфатазы и билирубина являлись независимыми факторами риска развития ГТ (табл. 1). Кроме того, наличие неалкогольного стеатогепатита и сопутствующей инфекции вирусными гепатитами В и С было факторами риска развития ГТ – ОШ развития гепатологической токсичности составил 6,8735 (95-процентный ДИ 3,4873–13,5479) и 20,5991 (95-процентный ДИ 4,6915–90,4448) соответственно.
Необходимо отметить, что все случаи ГТ III степени на внеплановых визитах (55 пациенток) выявлялись на фоне имеющейся фоновой патологии печени (стеатогепатит, вирусные инфекции гепатита В и С, сопровождающиеся исходным повышением уровня биохимических маркеров и уже имеющейся ГТ I cтепени (28 пациенток) или II степени (27 пациенток). Прирост частоты ГТ II степени на внеплановых визитах (с 34 до 104 пациенток) происходил на фоне уже имеющейся ГТ I степени (97 пациенток), при том что у 7 пациенток II степень ГТ не усугублялась. Соответственно, из 355 пациенток с ГТ I степени на внеплановых визитах у 138 отмечены кратковременные подъемы биохимических маркеров, не выявляемые на плановых визитах. Данные 138 пациенток, в соответствии с дизайном исследования, расценивались как не имеющие ГТ.
У всех больных с острой ГТ были зарегистрированы признаки гематологической, кардио- и панкреатоксичности. Это явилось основанием для проведения корреляционного анализа, который продемонстрировал наличие обратных корреляционных связей между уровнями маркеров острой ГТ и числом нейтрофилов, лейкоцитов, эритроцитов в периферической крови и маркерами ГТ (табл. 2); показателями глобальной систолической и диастолической функций левого желудочка и маркерами ГТ; значениями панкреатической амилазы крови и маркерами ГТ (табл. 3).
Таким образом, неалкогольный стеатогепатит и сопутствующая инфекция вирусными гепатитами В и С, исходное повышение маркеров холестаза и цитолиза являются факторами риска развития острой ГТ, которая часто сочетается с гематологической, кардио- и панкреатоксичностью. Истинная частота острой ГТ существенно выше, чем определенная в соответствии с протоколом исследования. Сложность анализа роли факторов риска и выявление острой ГТ определяют необходимость установления диагноза токсичности и назначения корригирующей и поддерживающей терапии онкологами совместно с гастроэнтерологами, гепатологами.
Анализ эффективности различных гепатопротекторов для преодоления острой ГТ и профилактики поздней ГТ. Современные методы лекарственной терапии заболеваний гепатобилиарной системы включают применение гепатопротекторов [7, 18–20]. В рамках нашего исследования мы попытались оценить эффект назначения различных гепатопротекторов у больных с ГТ на фоне комбинированного и комплексного лечения РМЖ. Всего острая ГТ, в соответствии с критериями Национального ракового института США, выявлялась при обязательных визитах у 439 (26,7%) из всех больных. В то же время в период проведения химиотерапии РМЖ лечащими врачами при обязательных визитах ГТ регистрировалась в историях болезни и амбулаторных картах только у 50,6% всех больных с выявленным нами нежелательным побочным эффектом в виде ГТ (222 больных). Другими словами, только в половине случаев в медицинской документации фигурировало описание токсической реакции, ее стадия. Изменение уровня биохимических маркеров появления или усугубления ГТ во время внеплановых визитов не повлекли за собой изменений схемы проводимого противоопухолевого лечения и не являлись причиной назначения или изменения терапии, направленной на коррекцию ГТ, или установления диагноза ГТ в случае его отсутствия. Только у 158 (36,0%) в связи с выявленной во время плановых визитов ГТ были предприняты меры по ее коррекции. Данным больным с момента выявления маркеров ГТ на весь срок лечения назначались препараты растительного происхождения перорально (33 больных), эссенциальные фосфолипиды с пероральным и парентеральным применением в соответствии с имеющимися рекомендациями (66 больных) и адеметионин с парентеральным и пероральным применением в соответствии с имеющимися рекомендациями (59 больных).
Ретроспективный анализ маркеров острой ГТ выявил отсутствие положительного влияния применения препаратов растительного происхождения, причем у 12 из 33 пациентов было отмечено небольшое увеличение уровня маркеров ГТ. Этот эффект может быть обусловлен описанным неблагоприятным действием данных препаратов при остром поражении печени, сопровождавшемся холестазом [18, 19]. При этом мы выявили отчетливый положительный эффект применения эссенциальных фосфолипидов и адеметионина. Для анализа эффективности применения гепатопротекторов при ГТ больные были разделены на 3 группы. В группу 1 были включены: а) больные РМЖ с признаками ГТ, выявленными нами, но которым диагноз ГТ не был поставлен во время лечения (n = 217); б) пациенты, у которых диагноз ГТ был установлен, но лечение не назначалось (n = 64); в) лица, которым проводилось лечение препаратами растительного происхождения (n = 33). Всего в данную группу были включены 314 женщин с РМЖ. В группу 2 вошли 66 больных, получавших по поводу ГТ эссенциальные фосфолипиды, в группу 3 – 59 пациенток, получавших адеметионин. Все 3 группы были близки по половому составу, возрасту, частоте фоновых заболеваний печени, уровню маркеров цитолиза и холестаза.
По данным обязательных визитов, представленных в таблице 4, в группе 1 средний уровень маркеров ГТ за время проведения химиотерапии стойко превышал показатели в контрольной группе, в то же время в группах 2 и 3 мы отметили тенденцию к нормализации уровня маркеров к концу лечения, более отчетливую в группе 3. Диспротеинемия была достоверно наибольшей (р < 0,05) в группе 1 и достоверно наименьшей (р < 0,05) – в группе 3. Уровень маркеров холестаза к концу лечения в группе 3 нормализовался, достоверно отличаясь от величин анализируемых маркеров в группах 1 и 2. В группе 2 величины маркеров холестаза испытали тенденцию к снижению по сравнению с группой 1, но продолжали отличаться от контрольных значений. Величины показателей холестаза в группе 1 к концу лечения значительно превышали уровни в контрольной группе и группе 3. Значения маркеров цитолиза достоверно (p < 0,05) снизились в группах 2 и 3. Среди пациенток группы 3 к концу химиотерапии регистрировалась только I степень ГТ, в группе 2 ГТ II степени была у 4 из 66 пациенток (6,1%), в остальных случаях (93,9%) регистрировалась I степень ГТ. В то же время в группе 1 ГТ II степени выявлялась у 36 из 314 лиц (11,5%), у остальных 278 (88,5%) определялась I степень.
Мы провели анализ степени ГТ по данным дополнительных визитов в выделенных группах. Всего из 439 женщин, включенных в данную фазу исследования, с внеплановыми визитами обратились 376. Частота выявления I степени ГТ на дополнительных визитах отчетливо и достоверно нарастала от группы 3 к группе 1 (62,4 ± 2,7; 24,2 ± 5,3; 8,5 ± 3,6% соответственно; р < 0,05). Частота выявления II степени ГТ на дополнительных визитах была наибольшей в группе 1 (27,7 ± 2,5%), отмечена существенная, но недостоверная тенденция к более низкому уровню данного нежелательного побочного эффекта в группе 2 (19,7 ± 4,9%). Представленность ГТ в группе 3 была достоверно наименьшей по сравнению с группами 1 и 2 (6,8 ± 3,3%; p < 0,05).
Полученные результаты согласуются с ранее опубликованными данными о высокой эффективности адеметионина для коррекции нарушений печеночного метаболизма у онкогематологических больных [21].
Мы провели анализ факторов риска поздней ГТ, а также роли назначения гепатопротекторов на фоне острой ГТ в прогнозе поздней ГТ. Эффект назначения гепатопротекторов оценивался нами у 607 пациенток, истории болезни которых были прослежены нами в течение всего 5-летнего периода наблюдения.
У 46 из 607 пациенток были признаки поздней ГТ. Все эти больные перенесли острую ГТ на фоне химиотерапии. Среди 98 пациенток, отнесенных к группе 1, признаки поздней ГТ во время различных визитов были в 40 случаях (40,8%), причем у 34 из них на внеплановых визитах выявлялось усугубление острой ГТ (у 11 определялась ГТ III степени, у 23 трансформация I степени во II степень). Среди 24 больных, отнесенных к группе 2, поздняя ГТ во время 10–16-го визитов регистрировалась у 5 пациенток (20,8%). На внеплановых визитах у всех больных также наблюдалось усугубление ГТ (из I степени во II степень). Из 25 лиц, отнесенных к группе 3, биохимические признаки поздней ГТ были в 1 случае (4,3%), выявленные на 10–12-м визитах, в данном случае в анамнезе был также дополнительный визит с трансформацией ГТ из I степени во II степень. Средняя частота поздней ГТ среди больных, отнесенных к группе 1, была достоверно выше, чем в группах 2 и 3, и она выявлялась за все время наблюдения. Отмечена отчетливая тенденция к более низкой частоте и быстрой редукции поздней ГТ в группе 3 по сравнению с группой 2. Отсутствие статистической достоверности отличия частоты ГТ, очевидно, связано с небольшим количеством прослеженных больных в рамках данного ретроспективного исследования.
Выводы
- Частота регистрации острой ГТ в ходе стандартного протокола комбинированного и комплексного лечения РМЖ, приближенного к реальной практике, достоверно ниже (26,7 ± 1,2%), чем во время внеплановых визитов больных (39,1 ± 1,8%), большей частью обусловленных именно проявлениями токсичности. Вне плановых визитов нередко регистрируются более тяжелые токсические реакции.
- Неалкогольный стеатогепатит и сопутствующие инфекции вирусными гепатитами В и С, исходное повышение маркеров холестаза и цитолиза являются факторами риска развития острой ГТ при комбинированном и комплексном лечении РМЖ. Имеется частое сочетание острой ГТ и острой гематологической, кардио- и панкреатоксичности. Фактором риска поздней ГТ является перенесение острой ГТ, особенно при усугублении острой ГТ на внеплановых визитах.
- Гепатопротекторы растительного происхождения неэффективны в коррекции проявлений острой ГТ и профилактике поздней ГТ. Эссенциальные фосфолипиды эффективны в коррекции проявлений цитолитического синдрома, в отношении холестатического синдрома при острой ГТ их эффект был недостаточным. Отмечен профилактический эффект эссенциальных фосфолипидов в отношении поздней ГТ. Адеметионин был наиболее эффективен в качестве средства купирования проявлений острой и профилактики поздней ГТ.
- Необходимо проведение исследований по профилактике острой ГТ у лиц с факторами риска ее развития, изучение сравнительной эффективности различных групп гепатопротекторов при назначении принятых схем противоопухолевого лечения.
- С учетом низкой частоты регистрации острой ГТ, недооценки данных внеплановых визитов, роли своевременного назначения гепатопротекторов данным больным, при наличии факторов риска ГТ в сочетании с изменением печеночных проб при проведении комбинированного и комплексного лечения онкологических заболеваний, в частности РМЖ, целесообразно ведение больных онкологами совместно с гастроэнтерологами, гепатологами.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.