Особенности течения диабетической ретинопатии в условиях преэклампсии
- Аннотация
- Статья
- Ссылки
- English
Цель – выявить взаимосвязь между ПЭ и прогрессированием ДР у беременных с СД.
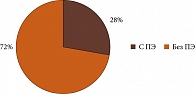
Материал и методы. Исследовано 50 пациенток, разделенных на две группы, – с ПЭ (n = 14) и без ПЭ (n = 36).
Результаты. У пациенток с ПЭ чаще отмечались пролиферативная ДР (50 против 25%), макулярный отек (42,9 против 27,8%), преимущественно диффузно-кистозного характера, гемофтальм (21,4%). Прогрессирование заболевания продолжалось в послеродовом периоде, что требовало активного терапевтического вмешательства.
Заключение. При высоком риске ПЭ необходимо ежемесячное офтальмологическое обследование. При толщине сетчатки < 400 мкм показана субпороговая лазеркоагуляция, при толщине > 400 мкм – интравитреальное введение дексаметазона (начиная со второго триместра беременности) с последующей субпороговой индивидуально подобранной лазерной коагуляцией сетчатки. При пролиферативной ДР панретинальная лазеркоагуляция выполняется во всех триместрах. Необходимо междисциплинарное взаимодействие специалистов для сохранения зрительных функций.
Цель – выявить взаимосвязь между ПЭ и прогрессированием ДР у беременных с СД.
Материал и методы. Исследовано 50 пациенток, разделенных на две группы, – с ПЭ (n = 14) и без ПЭ (n = 36).
Результаты. У пациенток с ПЭ чаще отмечались пролиферативная ДР (50 против 25%), макулярный отек (42,9 против 27,8%), преимущественно диффузно-кистозного характера, гемофтальм (21,4%). Прогрессирование заболевания продолжалось в послеродовом периоде, что требовало активного терапевтического вмешательства.
Заключение. При высоком риске ПЭ необходимо ежемесячное офтальмологическое обследование. При толщине сетчатки < 400 мкм показана субпороговая лазеркоагуляция, при толщине > 400 мкм – интравитреальное введение дексаметазона (начиная со второго триместра беременности) с последующей субпороговой индивидуально подобранной лазерной коагуляцией сетчатки. При пролиферативной ДР панретинальная лазеркоагуляция выполняется во всех триместрах. Необходимо междисциплинарное взаимодействие специалистов для сохранения зрительных функций.


Введение
Среди осложнений беременности особое место занимает преэклампсия (ПЭ) – патологическое состояние, возникающее у 2–5% будущих матерей [1]. Это системное заболевание может иметь крайне неблагоприятные последствия как для женщины, так и для ребенка, вплоть до летального исхода. ПЭ определяется как впервые возникшая артериальная гипертензия с увеличением уровня артериального давления до 140/90 мм рт. ст. и выше, сопровождающаяся протеинурией > 300 мг белка за сутки после 20-й недели беременности [2].
Особого внимания в контексте развития ПЭ заслуживают беременные с сахарным диабетом (СД). Статистика неутешительна: к 2019 г. каждая шестая беременная имела повышенный уровень глюкозы в крови [3]. Несмотря на значительные успехи современной медицины в изучении ПЭ, многие аспекты этого осложнения все еще требуют детального исследования [4].
В основе патогенеза ПЭ лежит нарушение функции эндотелия сосудов, затрагивающее весь организм матери [5]. Ключевым звеном патологического процесса становится неадекватное врастание клеток цитотрофобласта в спиральные артерии, что препятствует нормальной перестройке сосудов плаценты. В результате ишемически-реперфузионного повреждения плацентарной ткани развивается окислительный стресс с выбросом множества биомаркеров в кровоток матери [6].
Предсуществующие нарушения углеводного обмена и патологическая инсулинорезистентность значительно повышают риск развития ПЭ [5]. Частота подобного осложнения особенно высока у беременных с СД: 25–40% при СД 1-го типа и 20–24% при СД 2-го типа [5]. Механизм развития ПЭ у таких пациенток связан с системным воспалением и накоплением конечных продуктов гликирования, усиливающих окислительный стресс [7]. Взаимодействие этих патологических процессов создает предпосылки для развития ПЭ [8].
Примерно у 40% пациенток при ПЭ наблюдается широкий спектр офтальмологических нарушений, затрагивающих все структуры глаза: от роговицы (изменение толщины, кривизны и чувствительности) до сетчатки (геморрагия, отек, отслойка) и ее сосудов (генерализованное сужение артериол). Кроме того, имеют место нарушения гематоофтальмического барьера и изменения хориоидеи. При сочетании ПЭ и СД оценка офтальмологических изменений должна быть скрупулезной, с учетом способности каждого из этих состояний самостоятельно влиять на орган зрения [9].
Хроническая гипергликемия при СД сопровождается повреждением, дисфункцией и недостаточностью различных органов [10], в том числе микроциркуляторного русла. Среди осложнений беременности при СД ведущая роль принадлежит микроциркуляторным нарушениям на фоне физиологического спазмирования периферических сосудов. Прогрессирующая гипоксия вызывает локальное повреждение эндотелия и нарушение гемостаза. Активация перекисного окисления липидов и фосфолипазы стимулирует образование свободных радикалов, повреждающих клеточные мембраны. Нарушения усугубляются на фоне гиперлипидемии, возникающей при инсулинорезистентности. Порочный круг патологических процессов усиливает микроциркуляторные и гипоксические нарушения, провоцируя развитие или прогрессирование диабетической ретинопатии (ДР) [10].
Сочетание таких факторов, как беременность с изменениями ретинального кровотока, недостаточные скорость нормализации гликемии и гликемический контроль до и во время беременности, степень выраженности ДР до беременности, диабетический стаж, гипертензия, диабетическая нефропатия и преэклампсия, часто ухудшает течение ДР. Именно поэтому для женщин с СД критически важен регулярный офтальмологический контроль, особенно в период беременности, когда колебания уровня глюкозы, гормональные изменения и повышение артериального давления могут ускорить прогрессирование ДР и способствовать развитию диабетического макулярного отека (ДМО) [11].
Системный подход к наблюдению за беременными с СД и высоким риском офтальмологических осложнений отражен в практических рекомендациях [12], разработанных в рамках комплексной системы мероприятий по сохранению зрения у беременных с СД. Согласно этим рекомендациям, при постановке на учет необходим анализ ключевых предикторов риска развития или прогрессирования ДР, в частности:
- демографических факторов (репродуктивный возраст, число беременностей);
- общеклинических параметров (тип СД, уровень HbA1c до и во время гестации, наличие нефропатии);
- офтальмологических критериев риска развития ДР.
Расширенное офтальмологическое обследование в специализированном центре (цветная 7-польная фоторегистрация глазного дна, оптическая когерентная томография (ОКТ) переднего и заднего отрезка глаза, ОКТ-ангиография) позволяет оценить динамику сосудистой и ретинальной патологии и выявить такие значимые предикторы риска, как толщина сосудистого слоя цилиарного тела, индекс циркулярности, периметр фовеальной аваскулярной зоны, плотность сосудов в поверхностном сосудистом сплетении fovea. На основании этих данных определяются частота мониторинга (один раз в триместр при низком и среднем риске развития или прогрессирования ДР, ежемесячно при высоком риске) и персонализированный терапевтический подход.
Особого внимания заслуживают критерии выбора терапии макулярного отека. При толщине сетчатки в фовеолярной зоне < 400 мкм и непролиферативной или препролиферативной ДР рекомендуется субпороговая индивидуально подобранная лазерная коагуляция сетчатки (СПИЛКС). При толщине > 400 мкм во втором или третьем триместре показано интравитреальное введение имплантата дексаметазона с СПИЛКС через две недели. При пролиферативной ДР во всех триместрах рекомендуется панретинальная лазерная коагуляция сетчатки (ПРЛКС).
Таким образом, своевременная диагностика и адекватная терапия офтальмологических осложнений у беременных с СД, особенно на фоне ПЭ, требуют междисциплинарного подхода и следования четким алгоритмам ведения пациенток.
Цель – выявить взаимосвязь между ПЭ и прогрессированием ДР у беременных с СД.
В задачи исследования входили:
- оценка влияния ПЭ на характер и темпы прогрессирования ДР, включая риск развития таких осложнений, как макулярный отек и гемофтальм;
- анализ динамики состояния сетчатки в послеродовом периоде у женщин с ПЭ и ДР;
- определение ключевых клинических особенностей течения ДР на фоне ПЭ;
- разработка дифференцированного подхода к мониторингу и лечению беременных с ДР и ПЭ для минимизации риска офтальмологических осложнений.
Результаты исследования призваны оптимизировать алгоритмы офтальмологического наблюдения и лечения беременных с СД и ПЭ, а также повысить осведомленность специалистов о факторах риска прогрессирования ретинопатии в указанной группе пациенток.
Материал и методы
Проспективное когортное исследование проводилось на базе офтальмологического отделения ГБУЗ МО МОНИКИ им. М.Ф. Владимирского (2023–2025). Обследовано 50 пациенток с СД, разделенных на две группы: с ПЭ (n = 14) и без ПЭ (n = 36) (рис. 1). Исследование продолжалось в течение всего периода беременности (первый, второй и третий триместры) и год после родоразрешения. Диагноз ПЭ устанавливался акушером-гинекологом во время родоразрешения и подтверждался выписным эпикризом из родильного дома.
Всем пациенткам выполнено комплексное офтальмологическое обследование, включавшее стандартные методы (визометрия по таблицам С.С. Головина и Д.А. Сивцева, тонометрия, биомикроскопия, офтальмоскопия в условиях медикаментозного мидриаза с использованием высокодиоптрийной линзы 78–90 D) и специальную диагностику (ОКТ переднего и заднего отрезков глаза, ОКТ-ангиография заднего отрезка глаза).
Результаты
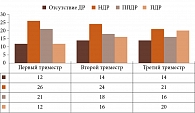
Диабетическая ретинопатия. В первой группе (14 пациенток с ПЭ) ДР на протяжении всей беременности отсутствовала у 2 (14,3%) пациенток. Стабильная непролиферативная ДР (НДР) отмечалась в 2 (14,3%) случаях, препролиферативная ДР (ППДР) – в 3 (21,4%) случаях. Пролиферативная ДР (ПДР), потребовавшая выполнения ПРЛКС, наблюдалась у 7 (50%) пациенток, у двух из них имел место частичный гемофтальм. Диффузно-кистозный макулярный отек с прогрессированием у трех пациенток (одна – с ППДР, две – с ПДР) потребовал введения препарата Озурдекс (имплантат дексаметазона 0,7 мг) с СПИЛКС через две недели (рис. 2).
Во второй группе (36 пациенток без ПЭ) ДР на протяжении всей беременности отсутствовала у 3 (8,3%) пациенток. Регрессия НДР до полного исчезновения отмечалась у 4 (11,1%) пациенток, стабильная НПДР – у 6 (16,7%), регрессия из ППДР в НДР – у 2 (5,6%), переход в НДР – у 3 (8,3%), стабильная ППДР – у 5 (13,9%), прогрессирование из НДР в ППДР – у 3 (8,3%) пациенток. У 5 (13,9%) пациенток на первом осмотре зафиксирована ПДР, что потребовало проведения ПРЛКС. У 4 (11,1%) пациенток зарегистрировано прогрессирование ППДР в ПДР с зонами ишемии и локусами неоваскуляризации по данным ОКТ-ангиографии. Стабильная ПДР в стадии регресса (состояние после ПРЛКС до беременности) имела место у 1 (2,8%) пациентки (рис. 3).
Диабетический макулярный отек. В первой группе ДМО зафиксирован у 6 (42,9%) пациенток. Кистозный отек отмечался у трех пациенток, ДМО у них не разрешился в послеродовом периоде и потребовал введения анти-VEGF-препарата (после завершения грудного вскармливания). Диффузно-кистозный отек имел место у трех пациенток. Прогрессивное нарастание высоты отека и значительное снижение остроты зрения у этих пациенток потребовали интравитреального введения Озурдекса в третьем триместре беременности с СПИЛКС через две недели. ДМО не разрешился в послеродовом периоде, что потребовало введения анти-VEGF-препарата (после завершения грудного вскармливания). Частичный гемофтальм с рецидивами имел место у трех пациенток (рис. 4).
Во второй группе фокальный ДМО зафиксирован у 10 (27,8%) пациенток. Самостоятельное разрешение ДМО после родов отмечалось у шести пациенток, разрешение ДМО в третьем триместре беременности – у трех пациенток. Одной пациентке потребовались введение анти-VEGF-препарата (после завершения грудного вскармливания) и дополнительная лазерная коагуляция в послеродовом периоде (рис. 5).
Течение ДР в послеродовом периоде. В первой группе дополнительная лазеркоагуляция проведена всем семи пациенткам с ПДР после ПРЛКС в связи с прогрессированием заболевания. Рецидив гемофтальма отмечался у трех из семи пациенток с ПДР. Интравитреальное введение ингибиторов ангиогенеза (по завершении грудного вскармливания) получили шесть из семи пациенток с ПДР. Прогрессирование ППДР до ПДР у одной пациентки с исходной ППДР и диффузно-кистозным макулярным отеком через шесть месяцев после родов потребовало выполнения ПРЛКС обоих глаз.
Во второй группе стабилизация ДР и ДМО в послеродовом периоде отмечалась у большинства пациенток. Прогрессирование ДР зафиксировано в одном случае. Стабилизация состояния достигнута после интравитреального введения анти-VEGF-препарата (по завершении грудного вскармливания) и выполнения дополнительной лазерной коагуляции.
Обсуждение
Проведенное исследование подтвердило, что ПЭ является одним из ключевых факторов, усугубляющих течение ДР у беременных с СД. Анализ полученных данных позволил выявить важные клинические закономерности и сформулировать практические рекомендации для оптимизации ведения данной категории пациенток.
Влияние преэклампсии на прогрессирование диабетической ретинопатии
У пациенток с ПЭ (первая группа) отмечалось более выраженное прогрессирование ДР до пролиферативной стадии, а также чаще развивался устойчивый ДМО. Это согласуется с патофизиологическими механизмами, описанными в литературе, когда сочетание гипергликемии и эндотелиальной дисфункции, характерной для ПЭ, создает синергический эффект, что негативно влияет на микроциркуляторное русло сетчатки.
Полученные результаты подтверждают важность учета информативных предикторов риска, в частности демографических, общеклинических и офтальмологических факторов. Сказанное особенно актуально для женщин с высоким риском развития ПЭ, установленным исходя из маркеров маточно-плацентарного кровотока и уровня плацентарного фактора роста (PlGF) в первом триместре.
Эффективность дифференцированного подхода к офтальмологическому мониторингу
В исследовании подтверждена эффективность рекомендаций по частоте офтальмологических осмотров в зависимости от степени риска прогрессирования ДР. Особую ценность в диагностике представляют ОКТ и ОКТ-ангиография, которые помогают выявить ранние признаки ухудшения: изменение толщины сосудистого слоя цилиарного тела, индекса циркулярности, периметра фовеальной аваскулярной зоны и плотности сосудов в поверхностном сосудистом сплетении fovea.
Оптимизация тактики лечения диабетического макулярного отека
Исследование подтвердило обоснованность дифференцированного подхода к лечению ДМО в зависимости от толщины сетчатки в фовеолярной зоне. У трех пациенток первой группы с диффузно-кистозным ДМО и толщиной сетчатки > 400 мкм интравитреальное введение имплантата дексаметазона (Озурдекс) с СПИЛКС через две недели позволило предотвратить дальнейшее ухудшение зрения. Такой подход соответствует рекомендациям [12] и доказывает эффективность своевременного начала комбинированной терапии.
Ограниченные возможности анти-VEGF-терапии во время беременности подчеркивают важность профилактических мер и своевременной оценки состояния глазного дна у пациенток с высоким риском ПЭ.
Междисциплинарное взаимодействие как основа успешного ведения
Несмотря на очевидные преимущества совместного ведения, на практике часто имеет место недостаточная координация между акушерами-гинекологами и офтальмологами. Наше исследование показало, что внедрение четких алгоритмов маршрутизации, призывающих акушеров-гинекологов направлять пациенток с высоким риском ПЭ на расширенный офтальмологический контроль, может существенно улучшить исходы. Это особенно актуально для женщин с изначально тяжелыми формами ДР, у которых беременность и ПЭ дают синергичный негативный эффект.
Заключение
Проведенное исследование позволило выявить значимую взаимосвязь между ПЭ и прогрессированием ДР у беременных с СД, что соответствует поставленной цели исследования.
Оценка влияния преэклампсии на характер и темпы прогрессирования диабетической ретинопатии
У пациенток с ПЭ наблюдалось более агрессивное течение ДР с развитием пролиферативной стадии (50 против 25% в группе без ПЭ). Макулярный отек у женщин с ПЭ развивался чаще (42,9 против 27,8%), имел преимущественно диффузно-кистозный характер и отличался резистентностью к терапии. Частичный гемофтальм наблюдался у 21,4% пациенток с ПЭ и отсутствовал в группе сравнения.
Анализ динамики состояния сетчатки в послеродовом периоде
У женщин с ПЭ и ДР заболевание прогрессировало и после родов. Всем пациенткам с ПДР потребовалась дополнительная лазерная коагуляция, у 21,4% наблюдались рецидивы гемофтальма, а 42,9% пациенток нуждались в интравитреальном введении ингибиторов ангиогенеза. В то же время у большинства женщин без ПЭ наблюдалась стабилизация состояния в послеродовом периоде.
Определение ключевых клинических особенностей течения диабетической ретинопатии на фоне преэклампсии
Более высокая частота развития пролиферативной ретинопатии, формирование устойчивого диффузно-кистозного макулярного отека, склонность к гемофтальму и продолжение прогрессирования заболевания в послеродовом периоде обусловлены синергическим эффектом гипергликемии и эндотелиальной дисфункции, характерной для ПЭ. Указанные клинические особенности требуют особого внимания при ведении беременных.
Разработка дифференцированного подхода к мониторингу и лечению
На основании полученных данных подтверждена эффективность дифференцированного подхода к офтальмологическому наблюдению беременных с ДР и ПЭ.
При высоком риске ПЭ, установленном исходя из маркеров маточно-плацентарного кровотока и уровня плацентарного фактора роста (PlGF) в первом триместре, акушер-гинеколог должен незамедлительно направлять пациенток на углубленное офтальмологическое обследование с рекомендацией последующего мониторинга каждый месяц при высоком риске прогрессирования ДР.
У пациенток с высоким риском ПЭ целесообразно проведение расширенного обследования, включающего цветную 7-польную фоторегистрацию глазного дна, ОКТ переднего и заднего отрезка глаза, ОКТ-ангиографию.
Особое внимание следует уделять динамике ключевых предикторов прогрессирования: толщине сосудистого слоя цилиарного тела, индексу циркулярности, периметру фовеальной аваскулярной зоны и плотности сосудов в поверхностном сосудистом сплетении fovea.
При толщине сетчатки в фовеолярной зоне < 400 мкм рекомендовано проведение СПИЛКС, при толщине > 400 мкм во втором или третьем триместре показано интравитреальное введение имплантата дексаметазона с СПИЛКС через две недели.
При пролиферативной ДР целесообразно выполнение ПРЛКС во всех триместрах беременности.
Ведение пациенток с ПЭ и ДР предполагает активное междисциплинарное взаимодействие акушеров-гинекологов и офтальмологов.
Таким образом, согласно полученным результатам, ПЭ следует рассматривать как важный фактор риска прогрессирования ДР у беременных с СД. Разработанный дифференцированный подход к мониторингу и лечению этой категории пациенток позволяет своевременно выявлять признаки прогрессирования заболевания и проводить адекватную терапию, минимизируя риск необратимых офтальмологических осложнений и сохраняя зрительные функции.
Полученные результаты могут быть использованы для оптимизации алгоритмов офтальмологического наблюдения беременных с СД и повышения осведомленности специалистов о факторах риска прогрессирования ретинопатии в данной группе пациенток.
Финансирование. Авторы не получали конкретного гранта на это исследование от какого-либо финансирующего агентства в государственном, коммерческом и некоммерческом секторах.
A.A. Afanasyeva, E.N. Khomyakova, PhD, I.A. Loskutov, PhD
M.F. Vladimirsky Moscow Regional Scientific Research Institute
Contact person: Anna A. Afanasyeva, anna_amor@mail.ru
Relevance. Preeclampsia is a pregnancy complication characterized by hypertension and proteinuria after 20th weeks of gestation. In patients with diabetes mellitus, the incidence of preeclampsia reaches 25–40% in type 1 diabetes mellitus and 20–24% in type 2 diabetes mellitus, creating prerequisites for diabetic retinopathy progression.
Purpose to identify the relationship between preeclampsia and diabetic retinopathy progression in pregnant women with diabetes mellitus.
Material and methods. 50 patients were studied, divided into groups with preeclampsia (n = 14) and without preeclampsia (n = 36).
Results. Patients with preeclampsia had a higher prevalence of proliferative diabetic retinopathy (50 vs 25%), more frequent development of macular edema (42.9 vs 27.8%) predominantly of diffuse-cystic nature, and more frequent vitreous hemorrhage (21.4%). Disease progression continued in the postpartum period, requiring active intervention.
Conclusion. In case of high risk of preeclampsia, monthly ophthalmological examination is necessary; with retinal thickening < 400 μm, subthreshold laser photocoagulation is indicated, > 400 μm – intravitreal administration of dexamethasone (starting from the second trimester of pregnancy) followed by subthreshold pattern individually tailored retinal laser photocoagulation; in case of PDR – panretinal laser photocoagulation in all trimesters. Interdisciplinary interaction of specialists is necessary to preserve visual functions.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.