Тактика ведения и лечения пациентов с осложненными формами диабетической ретинопатии
- Аннотация
- Статья
- Ссылки
- English

Введение
Диабетическая ретинопатия (ДР) представляет собой одно из наиболее значимых микрососудистых осложнений сахарного диабета (СД), характеризующихся прогрессирующим поражением сосудистой сети сетчатки, которое может привести к существенному ухудшению зрительной функции вплоть до ее полной утраты [1]. Актуальность данной патологии определяется высокой распространенностью среди пациентов с СД и значительным вкладом в структуру инвалидизации лиц трудоспособного возраста. Согласно прогнозам Международной диабетической федерации, к 2045 г. число больных СД достигнет 783 млн, из которых свыше 160 млн будут иметь клинические проявления ДР [2].
В Российской Федерации по состоянию на 2023 г. зарегистрировано свыше 400 тыс. случаев ДР. При этом более чем в 34% речь идет о лицах трудоспособного возраста. В 79% случаев диагностируются начальные стадии заболевания, на долю пролиферативной формы приходится около 6,58%. Ежегодно более 19 тыс. россиян утрачивают трудоспособность в связи с потерей зрительной функции, причем в 25% случаев причина заключается именно в ДР. Несмотря на развитие современных методов диагностики и терапии, распространенность ДР остается достаточно высокой [3].
Роль ишемии в патогенезе ДР
Ключевым звеном в развитии ДР является хроническая гипергликемия, которая инициирует каскад метаболических и воспалительных процессов. Среди них выделяют активацию полиолового пути, образование продуктов гликозилирования, усиление окислительного стресса, митохондриальную дисфункцию и хроническое воспаление. В результате этих процессов происходят гибель перицитов и эндотелиальных клеток, нарушение целостности гематоретинального барьера, повышение сосудистой проницаемости и утрата межклеточных контактов. Дальнейшее развитие включает формирование бесклеточных и окклюзированных капилляров, что ведет к ишемии сетчатки – одному из ключевых патофизиологических механизмов прогрессирования заболевания. Ишемические изменения активируют экспрессию провоспалительных и ангиогенных медиаторов, таких как VEGF-A, ангиопоэтин 2 и интерлейкин 6, способствующих развитию макулярного отека, неоваскуляризации, кровоизлияний и фиброзных изменений.
Особенность ишемии заключается в бессимптомном течении в ряде случаев, когда нейродегенеративные процессы могут предшествовать клинически выраженным проявлениям на глазном дне. Таким образом, ишемия сетчатки выступает центральным звеном патогенеза ДР, определяя ее тяжесть и склонность к развитию осложненных форм, включая неоваскуляризацию и диабетический макулярный отек. Сохраняющаяся высокая частота инвалидизации подчеркивает необходимость пересмотра клинической тактики с акцентом на выявлении и ведении ишемических форм заболевания [4, 5].
Морфологические особенности ишемии при ДР
Зоны неперфузии при ДР могут локализоваться в различных отделах сетчатки и иметь разное клиническое значение. Макулярная ишемия характеризуется нарушением кровоснабжения фовеолярной и парафовеолярной зон, что проявляется расширением аваскулярной области и снижением центрального зрения. Такие изменения часто происходят в отсутствие выраженных признаков отека или кровоизлияний, что затрудняет раннюю диагностику [6]. Периферическая ишемия проявляется в периферических зонах сетчатки и создает благоприятные условия для формирования неоваскуляризации, интраретинальных микрососудистых аномалий (ИРМА), преретинальных кровоизлияний и витреоретинальной тракции, особенно при переходе заболевания в пролиферативную стадию. Часто периферической неперфузии подвергаются нижненосовой и височный сегменты. Особое значение имеет глубокая капиллярная сеть (ГКС), преимущественно в парафовеолярной зоне. Поражение в этой зоне происходит раньше, чем в поверхностной капиллярной сети (ПКС), к тому же оно более выражено. Именно повреждение ГКС рассматривается как ключевой предиктор ухудшения макулярной функции и прогрессирования заболевания [7].
Клинические проявления, особенности диагностики и прогностическая значимость ишемии
Клиническая картина ишемической формы ДР нередко смещается в сторону функциональных нарушений в отсутствие выраженных структурных изменений. Пациенты могут предъявлять жалобы на снижение остроты зрения, метаморфопсии, затуманенность изображения и затруднения при чтении, особенно в условиях слабого освещения. При этом офтальмоскопически часто отсутствуют признаки макулярного отека или геморрагий, что затрудняет клиническую диагностику. Инструментальная диагностика в таких случаях приобретает решающее значение. Ангиографические методы, включая флуоресцентную ангиографию (ФАГ), позволяют визуализировать зоны капиллярной неперфузии, расширение фовеолярной аваскулярной зоны (ФАЗ) и утечку контраста. Однако наибольшую точность при оценке макулярной перфузии демонстрирует оптическая когерентная томография с ангиографией (ОКТ-А). ОКТ-А является неинвазивным методом, предоставляющим детальную количественную и топографическую информацию о состоянии сосудистой сети. С помощью ОКТ-А можно измерить площадь ФАЗ, сосудистую плотность, площадь ишемии, асимметрию капиллярного русла и глубинных изменений сетчатки. Уменьшение сосудистой площади и увеличение ФАЗ достоверно коррелируют с ухудшением остроты зрения [8, 9]. Одним из ключевых параметров, используемых для количественной оценки макулярной ишемии, является показатель геометрического дефицита перфузии, особенно в области ГКС. Согласно данным исследований, значение этого показателя ≥ 2,32% позволяет диагностировать клинически значимую ретинопатию (по крайней мере умеренной степени) с чувствительностью 95,7% и специфичностью 70%. При этом точность диагностики сопоставима с ультраширокопольной флуоресцентной ангиографией, что делает ОКТ-А надежной альтернативой инвазивным методам [10].
Рядом авторов подтверждена значимая связь между признаками диабетической макулярной ишемии, выявленными методом ОКТ-А, и риском прогрессирования ДР. Показано, что у наблюдаемого глаза в течение в среднем 50 месяцев наличие признаков ишемии в поверхностной капиллярной сети (ПКС) увеличивает риск прогрессирования заболевания в 2,7 раза, а ишемия в гКС – в 3,2 раза. Кроме того, диабетическая макулярная ишемия в области ГКС ассоциируется с повышенным риском развития макулярного отека и снижением остроты зрения [11]. Комбинированное применение ОКТ-А и микропериметрии позволяет установить взаимосвязь между структурными и функциональными изменениями сетчатки. У пациентов с ишемической макулопатией снижаются толщина ганглионарного клеточного комплекса и центральная светочувствительность. При этом обнаруживается достоверная корреляция между зрительной функцией и показателями светочувствительности, что подчеркивает значимость комплексной оценки при наблюдении больных [12].
По мнению некоторых авторов, расширение ФАЗ не всегда сопровождается пропорциональной потерей зрения. В связи с этим все чаще предлагается фенотипирование макулярной ишемии на основе глубины и локализации перфузионных нарушений [13].
Современные терапевтические подходы к лечению ДР
Тактика ведения пациентов с ишемической формой ДР определяется степенью и локализацией ишемических изменений. С учетом высокой частоты позднего выявления заболевания и глобального роста его распространенности становится очевидной необходимость оптимизации моделей наблюдения и расширения доступа к современным методам диагностики.
Согласно действующим отечественным клиническим рекомендациям, лечение ишемической формы ДР предусматривает применение интравитреальных анти-VEGF-препаратов, например ранибизумаба, лазерную коагуляцию и при необходимости витрэктомию. При тяжелой непролиферативной или пролиферативной форме с выраженной ишемией показана панретинальная лазеркоагуляция сетчатки (ПРЛКС). В случае макулярного отека возможно проведение фокальной лазерной коагуляции либо применение стероидов. Обязательной составляющей терапии остается достижение адекватной метаболической компенсации, что способствует замедлению прогрессирования ишемии и снижению риска осложнений [14].
Зарубежная практика также указывает на необходимость активного вмешательства при наличии неоваскуляризации или выраженных зон неперфузии. ПРЛКС в таких случаях позволяет уменьшить ишемический стимул, а интравитреальное введение анти-VEGF-препаратов применяется при наличии сопутствующего макулярного отека или пролиферации. Регулярный мониторинг с помощью ОКТ-А и фундус-фотографий позволяет выявлять прогрессирование ишемии до развития осложнений [15].
Особое внимание в последние годы уделяется персонализированным стратегиям лечения. Так, двухэтапный подход к терапии предполагает прицельное воздействие на микроочаги сосудистой дисфункции, в том числе телеангиэктазии. Согласно данным исследования TalaDME, у 30–66% пациентов с хроническим макулярным отеком выявляются сосудистые аномалии, недоступные стандартной ФАГ. Эти участки ассоциированы с гипоперфузией и устойчивым отеком, а прицельная фотокоагуляция позволяет добиться стойкого анатомического улучшения и сократить частоту инъекций анти-VEGF-препаратов. Такой подход может рассматриваться как один из элементов персонализированной терапии ишемических форм ДР [16]. Дополнительные исследования показали эффективность субпороговой лазерной терапии после курса анти-VEGF-терапии. Улучшение достигалось при умеренной толщине макулы, тогда как при выраженных отеках результативность была ограниченна. Это также подчеркивает важность морфологического мониторинга и индивидуализации подхода к лечению [17].
Исследований, демонстрирующих патофизиологические аспекты ишемии сетчатки и ее прогностическую значимость при ДР, становится все больше. Тем не менее в реальной клинической практике ключевыми остаются своевременное распознавание ишемических изменений и персонифицированный подход к терапии.
Рассмотрим клинический случай пациента с ишемической формой ДР, иллюстрирующий особенности диагностики, мониторинга и выбора терапевтической тактики в соответствии с современными рекомендациями.
Клинический случай: пролиферативная ДР с выраженным макулярным отеком и ишемическим компонентом
Пациент Е., 56 лет, с десятилетним анамнезом СД 2-го типа, находится на инсулинотерапии последние четыре года. Жалобы на постепенное снижение зрения на правом глазу, затруднения при чтении и метаморфопсии. Из офтальмологического анамнеза известно, что ранее ему выполнялась панретинальная лазерная коагуляция сетчатки правого глаза, однако дальнейшее наблюдение носило нерегулярный характер. За три месяца до обращения в ГБУЗ МО МОНИКИ пациенту в амбулаторных условиях провели три интравитреальные инъекции ранибизумаба 0,5 мг с месячным интервалом, на фоне которых регресс макулярного отека не превысил 20% от исходного, а клиническая картина оставалась неблагоприятной.
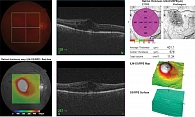
При первичном осмотре отмечалось снижение остроты зрения правого глаза до 0,3 (с коррекцией 0,4), на глазном дне – множественные микроаневризмы, единичные кровоизлияния, ИРМА в парамакулярной зоне и множественные пигментированные коагуляты на средней периферии. Результаты ОКТ продемонстрировали количественные изменения сетчатки: центральная толщина сетчатки (ЦТС) – 578 мкм, объем макулы –11,34 мм³, фовеолярная ямка сглажена. Во внутренних и наружных слоях сетчатки кистовидные полости с участками неоднородной рефлективности, гиперрефлективные очаги, соответствующие липидным и клеточным компонентам воспаления, а также отслойка нейроэпителия сетчатки в фовеолярной зоне (рис. 1).
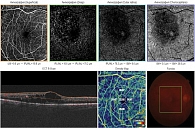
ОКТ-А (рис. 2) выявила выраженные изменения в капиллярной сети: значительное расширение фовеолярной аваскулярной зоны с нечеткими границами, явное снижение плотности сосудов в глубокой капиллярной сети; в парафовеальной зоне участки с разрывами капиллярного рисунка, отсутствием капиллярных петель и обрывами сосудов. Это указывало на выраженную макулярную ишемию с поражением именно тех слоев, которые наиболее критичны для центрального зрения.
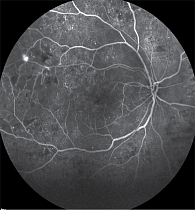
Флуоресцентная ангиография (рис. 3) показала множественные участки капиллярной неперфузии в нижненосовом и височном квадрантах, а также активный ликедж в зоне аркад. В поздних фазах наблюдалось стойкое просачивание контраста, что подтверждало наличие активных ангиогенных процессов. Четко определялись участки ИРМА и зоны неоваскуляризации, преимущественно в темпоральной части.
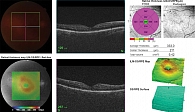
С учетом недостаточного ответа на ранибизумаб и сохранявшуюся ангиогенную активность было принято решение о переходе на афлиберцепт – препарат с более выраженным спектром действия. Пациенту провели три интравитреальные инъекции афлиберцепта 2 мг с четырехнедельным интервалом. Уже после второго введения наблюдалась положительная анатомическая динамика, а после третьей инъекции, по данным ОКТ (рис. 4), ЦТС составила 211 мкм, объем макулы уменьшился до 9,42 мм³, контурировался профиль фовеолярной ямки, значительно уменьшились кистозные полости и воспалительные включения, отслойка нейроэпителия не наблюдалась. Пациент отметил значительное улучшение зрения с коррекцией до 0,6, исчезновение искажений изображения и улучшение контрастности. Однако контрольное обследование выявило важную деталь: несмотря на уменьшение отека и улучшение макулярного профиля, ОКТ-А (рис. 5) и ФАГ зафиксировали признаки нарастания ишемии. ОКТ-А показала расширение зон неперфузии в пара- и перифовеолярных зонах, истончение капиллярной сети и прогрессирующее обеднение сосудистого рисунка. ФАГ подтвердила персистенцию зон ишемии и сохранение очага активного ликеджа. Это указывало на наличие ангиогенного стимула, несмотря на анатомическую стабилизацию.
Было принято решение о выполнении дополнительной панретинальной лазерной коагуляции с охватом всех ишемизированных участков, выявленных по данным визуализации. Коагуляция была выполнена одномоментно.
Через четыре недели, по данным ОКТ, сохранялась стабильная анатомия: ЦТС – 256 мкм, макулярный профиль восстановлен. ОКТ-А продемонстрировала частичное восстановление капиллярного рисунка, уменьшение площади ФАЗ и повышение плотности сосудов в глубоких слоях. На ФАГ не обнаружено признаков активного просачивания или новой неоваскуляризации.
Наиболее важным результатом стало то, что своевременно проведенная ПРЛКС позволила снизить уровень ишемического стимула и, как следствие, сократить потребность в дальнейшем частом введении афлиберцепта. В течение последующих восьми недель пациент находился под наблюдением, дополнительные инъекции препарата не потребовались. При этом сохранялась стабильная анатомическая и функциональная картина.
Таким образом, индивидуальный подход с оценкой не только выраженности отека, но и динамики ишемии по данным ОКТ-А и ФАГ, а также своевременное изменение схемы лечения позволили добиться стойкого терапевтического эффекта. Этот случай подтверждает необходимость детальной оценки сосудистого компонента при ведении пациентов с ДР и/или макулярным отеком и клиническую ценность комбинированного метода при резистентных формах заболевания.
Выводы
Ишемическая форма ДР относится к числу наиболее неблагоприятных вариантов течения заболевания, которые сопровождаются высоким риском стойкой утраты зрительных функций, развитием макулярного отека и переходом в пролиферативную стадию. Особенностью данной формы является ее бессимптомное прогрессирование: ишемические изменения сетчатки могут не сопровождаться выраженной офтальмоскопической картиной, что усложняет своевременную диагностику и начало терапии. Поэтому ключевую роль приобретает комбинированный диагностический подход, включающий использование структурных и ангиографических методов визуализации. ОКТ и ОКТ-А позволяют неинвазивно оценить состояние макулярной зоны: ЦТС, объем отека, размеры фовеолярной аваскулярной зоны и сосудистую плотность, особенно в глубоких капиллярных сплетениях, где ишемия развивается в первую очередь. Дополнительным компонентом комплексной диагностики остается ФАГ. Несмотря на инвазивность, данный метод сохраняет высокую информативность, особенно при оценке периферических отделов сетчатки. ФАГ позволяет определить зоны капиллярной неперфузии, уточнить степень ишемии и выявить признаки утечки красителя, что может быть важно для принятия решения о проведении лазерной коагуляции. Таким образом, ФАГ дополняет данные, получаемые с помощью ОКТ и ОКТ-А, особенно в ситуациях, когда требуется более полная оценка сосудистого русла. Представленный клинический случай демонстрирует эффективность сочетанного применения различных методов визуализации для диагностики и мониторинга ишемической формы ДР. Проведенное лечение, включавшее интравитреальное введение анти-VEGF-препарата и панретинальную лазерную коагуляцию, позволило достичь значимого уменьшения макулярного отека, восстановления фовеальной архитектуры и улучшения параметров макулярной перфузии.
Многоуровневая инструментальная диагностика, объединяющая возможности ОКТ, ОКТ-А и ФАГ, является необходимым условием раннего выявления ишемии, выбора оптимальной терапии и оценки ее эффективности. Немаловажно также развитие и внедрение персонализированных подходов к ведению пациентов с ДР, ориентированных на индивидуальные морфофункциональные особенности сетчатки, что становится важным направлением современной офтальмологической практики.
Прозрачность финансовой деятельности. Никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
E.N. Khomyakova, PhD, Prof., G.M. Gurbanova
M.F. Vladimirsky Moscow Regional Scientific Research Clinical Institute
Contact person: Gyunel M. Gurbanova, gurbanova98@inbox.ru
Diabetic retinopathy remains one of the main causes of visual impairment in diabetes mellitus and is an important clinical and social problem. Leading domestic and foreign studies emphasize the need for an integrated approach to the diagnosis and treatment of patients with severe forms of the disease. The use of multimodal imaging, including optical coherence tomography, angio-optical coherence tomography and fluorescence angiography, provides a more accurate assessment of the condition of the retinal vascular bed and allows detecting early signs of perfusion disorders. Of particular importance is the analysis of the parameters of the deep capillary network and the foveolar avascular zone as markers of the risk of progression. The modern therapeutic strategy includes the use of anti-VEGF drugs, laser treatment methods and personalized tactics depending on the morphofunctional state of the retina. The approach based on combining anatomical and angiographic data ensures an increase in the effectiveness of treatment and complies with current clinical recommendations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.