Подавление злокачественных опухолей внутриклеточными понижающими уровень натрия препаратами
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Исследования проведены in vivo на модели асцитной карциномы Эрлиха и in vitro на первичной культуре рака легкого. В качестве препаратов, изменяющих объем клеток, использовали фуросемид, оуабаин, инсулин и 2,7%-ный раствор NaCl. Адресную доставку фуросемида с целью предотвращения побочных эффектов осуществляли с помощью липосом, нагруженных фуросемидом и функционализированных аптамером LC17, селективным клеткам рака легкого.
Результаты. Эксперименты in vivo показали, что препараты, увеличивающие объем клеток (инсулин и оуабаин), провоцируют рост асцитной опухоли и, наоборот, препараты, уменьшающие размер клеток (2,7%-ный раствор NaCl и фуросемид), подавляют рост асцитной карциномы Эрлиха. В опухолях у мышей, которым вводили фуросемид, доля апоптотических и некротических клеток возрастала в 1,5 раза, тогда как инсулин не изменял долю клеток в состоянии апоптоза и некроза. Адресная доставка фуросемида в липосомах, функционализированных аптамером к раку легкого in vitro, вызывала массовую гибель клеток рака легкого человека, не влияя при этом на нормальные гепатоциты мыши.
Заключение. Новой стратегией лечения канцерогенеза может стать прямое или косвенное манипулирование уровнем внутриклеточного натрия в опухолевой клетке с помощью фармакологических препаратов.
Материал и методы. Исследования проведены in vivo на модели асцитной карциномы Эрлиха и in vitro на первичной культуре рака легкого. В качестве препаратов, изменяющих объем клеток, использовали фуросемид, оуабаин, инсулин и 2,7%-ный раствор NaCl. Адресную доставку фуросемида с целью предотвращения побочных эффектов осуществляли с помощью липосом, нагруженных фуросемидом и функционализированных аптамером LC17, селективным клеткам рака легкого.
Результаты. Эксперименты in vivo показали, что препараты, увеличивающие объем клеток (инсулин и оуабаин), провоцируют рост асцитной опухоли и, наоборот, препараты, уменьшающие размер клеток (2,7%-ный раствор NaCl и фуросемид), подавляют рост асцитной карциномы Эрлиха. В опухолях у мышей, которым вводили фуросемид, доля апоптотических и некротических клеток возрастала в 1,5 раза, тогда как инсулин не изменял долю клеток в состоянии апоптоза и некроза. Адресная доставка фуросемида в липосомах, функционализированных аптамером к раку легкого in vitro, вызывала массовую гибель клеток рака легкого человека, не влияя при этом на нормальные гепатоциты мыши.
Заключение. Новой стратегией лечения канцерогенеза может стать прямое или косвенное манипулирование уровнем внутриклеточного натрия в опухолевой клетке с помощью фармакологических препаратов.
Введение
Одной из наиболее важных констант, управляющих метаболизмом клетки, является ее объем. Изменение объема клетки зачастую влечет за собой нарушение ее функционального состояния. В частности, увеличение объема клетки до строго определенных размеров активирует в ней процессы пролиферации, причем это относится как к нормальной, так и к патологической клетке [1]. Увеличение объема клетки, спровоцированное ингибированием К+-каналов, активацией Na+/H+-обмена и Na+-K+-2Cl−-котранспорта, вызывает ее переход из стадии G1 в стадию S. Гипертоническое сжатие клетки, наоборот, ингибирует процессы пролиферации и стимулирует дифференцировку и апоптоз [2]. Таким образом, можно предположить, что индукторами апоптоза являются агенты, уменьшающие объем клетки, а индукторами пролиферации (митогенными факторами) – агенты, увеличивающие ее объем.
В норме клетки отвечают на нарушения своего объема компенсаторной активацией мембранного транспорта и/или метаболических процессов, которые приводят к изменению в ней содержания осмолитов и возвращению объема клетки к нормальному состоянию покоя. Повреждение механизмов поддержания размеров клетки вследствие нарушения транспорта ионов приводит к неспособности клетки поддерживать внутриклеточный баланс ионов натрия, калия, хлора, кальция, водорода и, следовательно, воды. Опухолевая клетка является ярким примером повреждения механизмов поддержания ионного гомеостаза, приводящего к аномально высокому содержанию внутриклеточного натрия, увеличению размеров клетки и, как следствие, высокому неконтролируемому пролиферативному потенциалу. Содержание Na+ в клетке определяет в ней уровень pH и Ca2+, величину мембранного потенциала, метаболизм, пролиферацию, миграцию, инвазию опухолевых клеток и, таким образом, метастазирование опухоли. Кроме того, высокий уровень внутриклеточного Na+ индуцирует воспалительную микросреду, которая еще в большей степени способствует прогрессированию опухоли [1, 2].
Таким образом, можно предположить, что прямое или косвенное манипулирование уровнем Na+ в опухолевой клетке, в том числе с помощью фармакологических препаратов, может стать новой стратегией лечения канцерогенеза, что уже показано несколькими исследованиями [3–5]. Для развития этой стратегии терапии канцерогенеза были использованы такие препараты, как оуабаин и фуросемид, изменяющие внутриклеточные концентрации Na+ и Cl− и приводящие к нарушению объема клетки [4, 6]. Причем оуабаин и фуросемид оказывали на внутриклеточное содержание катионов натрия разнонаправленный эффект, что сопровождалось изменением уровня опухолевого роста.
Противоопухолевый эффект сердечного гликозида оуабаина – ингибитора Na+,K+-ATФазы был связан с тем, что в результате подавления активного транспорта ионов натрия стимулировался цитотоксический приток Na+ в опухолевые клетки, что индуцировало их осмотический лизис [4]. Этот феномен был подтвержден в ретроспективном исследовании, показавшем улучшение выживаемости у онкологических больных, принимавших сердечные гликозиды [7]. Фуросемид, наоборот, уменьшает рост опухолевых клеток путем подавления активности Na+/K+/2Cl− (NKCC) [8]. С другой стороны, показано, что препараты, в частности инсулин, индуцирующий набухание клетки путем активации обмена Na+/H+ и симпорта Na+/K+/2Cl−, стимулируют суммарное накопление K+ и Na+ в клетке [9], приводящее к активации пролиферации клеток in vitro и увеличению риска развития злокачественной опухоли in vivo. Механизм этой взаимосвязи еще до конца не понятен.
Несмотря на многообещающие результаты, показывающие, что манипуляция уровнем внутриклеточного натрия может способствовать подавлению опухолевого роста, следует отметить, что применение этих препаратов вызывает системные нарушения ионного гомеостаза в организме в целом. Подобные нарушения приводят к неблагоприятным побочным эффектам, что делает актуальным разработку средств адресной доставки фуросемида в опухолевые клетки. Одними из наиболее подходящих средств адресной доставки таких препаратов являются аптамеры. Аптамеры – это РНК- или ДНК-олигонуклеотиды, получаемые с помощью технологии SELEX и способные связываться с любой заданной мишенью [10].
В данной работе in vitro и in vivo доказана возможность манипулировать скоростью роста опухоли с помощью препаратов, регулирующих клеточный объем. Кроме того, in vitro показано, что адресная доставка ингибитора Na+-K+-2Cl−-котранспорта фуросемида с помощью аптамеров вызывает гибель клеток рака легкого человека, но не влияет на жизнедеятельность нормальных гепатоцитов.
Материал и методы
Модель лечения опухоли. Для исследований были использованы мыши-самцы ICR (Imprinting Control Region) в возрасте 6–7 недель, полученные из питомника Государственного научного центра вирусологии и биотехнологии «Вектор» (Кольцово). Все исследования на животных были одобрены локальным этическим комитетом Красноярского государственного медицинского университета им. профессора В.Ф. Войно-Ясенецкого и проводились в соответствии с принципами и протоколами, изложенными в Руководстве по уходу и использованию животных Национального института здравоохранения.
В качестве модели опухоли была взята асцитная карцинома Эрлиха. Для получения мышей с опухолью животным было трансплантировано по 3 млн асцитных клеток. Мыши были разделены на пять групп по десять животных в каждой. Ежедневно, начиная с пятого дня, каждой мыши внутрибрюшинно вводили инсулин (первая группа), фуросемид (вторая группа), 2,7%-ный NaCl (третья группа), оуабаин (четвертая группа) или физиологический раствор (пятая контрольная группа).
Сбор асцитных клеток. Асцитные клетки в полном объеме выделяли из брюшной полости мышей ICR на 13-е сутки после трансплантации асцитной аденокарциномы Эрлиха. Клетки трижды промывали раствором Хенкса, содержащим (мМ): NaCl – 140, KCl – 5,4, CaCl2 – 1,3, MgSO4 – 1, KH2PO4 – 1, Na2HPO4 – 1, NaHCO3 – 1, глюкозу – 6, HEPES – 10. pH 7,2. Подсчет клеток проводили в камере Горяева.
Получение первичной культуры рака легкого человека. Первичную культуру клеток рака легкого человека получали из послеоперационного материала с одобрения этическим комитетом и информированного согласия пациента. Опухолевую ткань после хирургической резекции помещали в стерильную пробирку Falcon объемом 15 мл с 5 мл среды DMEM и с 5%-ным содержанием антибиотика-антимикотика. Через два часа ткань переносили в фосфатно-солевой буфер с добавлением 4%-ного раствора антибиотиков, где ее очищали от некротической ткани и скоплений кровеносных сосудов, измельчали с помощью скальпеля и фильтровали через 70-микронное клеточное сито в стерильную пробирку. Клетки дважды промывали в фосфатно-солевом растворе с последующим центрифугированием при 2000 об/мин в течение трех минут.
Полученный осадок ресуспендировали в фосфатно-солевом буфере и наслаивали на среду для разделения лимфоцитов с целью обогащения культуры клеток рака легкого и удаления эритроцитов и тромбоцитов, после чего центрифугировали в течение десяти минут при 2000 об/мин. Клетки, находившиеся на границе среды для разделения лимфоцитов и фосфатно-солевого буфера, собирали и центрифугировали пять минут при 2000 об/мин. После центрифугирования супернатант удаляли, осадок переносили в культуральный флакон или чашки Петри с питательной средой и помещали в CO2-инкубатор.
Через 24 часа клетки, прикрепившиеся ко дну, оставляли, а эритроциты и неприкрепившиеся клетки смывали фосфатно-солевым буфером, питательную среду обновляли. Культивирование проводили в течение двух-трех недель со сменой питательной среды каждые два-три дня по мере ее обеднения.
Для снятия клеток использовали раствор трипсин-ЭДТА (0,25%). После удаления питательной среды флаконы с культурой клеток промывали фосфатно-солевым буфером и наливали 2 мл раствора трипсина, после чего инкубировали семь минут. Открепившиеся клетки переносили в центрифужную пробирку и центрифугировали три минуты при 2500 об/мин.
Получение гепатоцитов. Свежевыделенную печень мыши переносили в фосфатно-солевой буфер с добавлением 4%-ного раствора антибиотиков, где очищали от пленки и кровеносных сосудов, измельчали с помощью скальпеля и фильтровали через 70-микронное клеточное сито в стерильную пробирку. Клетки дважды промывали в фосфатно-солевом растворе с последующим центрифугированием при 2000 об/мин в течение трех минут. Осадок гепатоцитов ресуспендировали в 1 мл питательной среды.
Измерение апоптоза и некроза. Жизнеспособность клеток определяли путем подсчета апоптотических и некротических клеток с помощью флуоресцентного микроскопа Axiostar plus (Carl Zeiss). Клетки инкубировали в течение десяти минут при комнатной температуре с флуоресцентными красителями Hoechst 33342 (Sigma, 2 мг/мл) и Propidium iodide (Sigma, 1 мг/мл). Долю живых клеток рассчитывали путем подсчета клеток с низким уровнем флуоресценции, апоптотических клеток – с более высоким уровнем синей флуоресценции, некротических клеток – проявляющих красную или красную и синюю флуоресценцию.
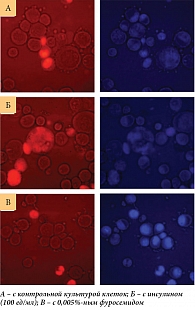
Влияние фуросемида и инсулина на асцитные клетки in vitro. Асцитные клетки в растворе Хенкса помещали на предметное стекло, накрывали покровным стеклом и фотографировали. Затем 0,005%-ный фуросемид в растворе Хенкса осторожно заливали под покровное стекло для замены раствора Хенкса, затем одни и те же клетки фотографировали каждые 30 секунд или одну минуту. Такая же процедура была проведена для изучения влияния инсулина на асцитные клетки. Концентрация инсулина в 100 мл составила 100 ед.
In vitro культивирование асцитных клеток. Суспензию асцитных клеток из брюшной полости мышей на девятые сутки после трансплантации культивировали в среде DMEM с высоким содержанием глюкозы, L-глутамина, 10%-ным FBS в течение 24 часов при 37 °C с 5%-ным CO2. Клетки первичной культуры рака легкого человека и гепатоциты культивировали в среде DMEM с высоким содержанием глюкозы, L-глютамина, 10%-ным FBS в течение 24 часов.
Приготовление мазков асцитных клеток для микроскопического исследования. Мазки наносили на предметные стекла с помощью стеклянной лопатки, клетки фиксировали в метаноле в течение 5–7 минут, высушивали на воздухе, а затем окрашивали по Романовскому – Гимзе в течение десяти минут.
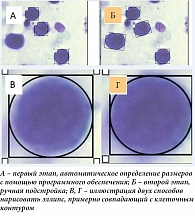
Оценка размера клеток. Размеры клеток оценивали по фотографиям мазков, сделанным на микроскопе Olympus. Изображения загружались в специально созданное программное обеспечение, где осуществлялось первичное автоматическое распознавание клеток по фотографии. Затем были сформированы эллипсы, примерно совпадающие с контурами клеток (рис. 1). После этого размеры эллипсов изменяли вручную, чтобы добиться минимального отличия от реальных контуров ячеек. Радиусы эллипсов были сохранены для дальнейших расчетов. На основе данных, полученных по фотографиям, были построены гистограммы распределения клеток по размерам. Было сделано предположение, что если площадь клетки А превышает площадь клетки Б, то объем А-клетки превышает объем В-клетки. С помощью этого метода было измерено около 250 клеток в каждой экспериментальной группе.
Оценка адекватности способа измерения размера клетки. Очевидно, что существует как минимум два способа нарисовать эллипс, примерно совпадающий с контурами клеток: первый – клетка лежит полностью внутри эллипса; второй – внутри эллипса нет ничего, кроме клетки. Мы использовали оба метода для измерения размеров клеток и получили два типа гистограмм (рис. 2). При этом гистограммы имели одинаковый вид и все эффекты повторялись независимо от метода. В итоге был сделан вывод, что оба способа рисования эллипса эквивалентны и не влияют на описанный эффект.
Получение липосом. Для получения липосом использовали липидную смесь для приготовления липосом (Sigma-Aldrich), содержащую холестерин, L-α-фосфатидилхолин и стеариламин. Липосомы, получаемые с использованием данной смеси, предназначены для инкапсулирования широкого спектра гидрофильных и амфипатических молекул низко-, средне- и высокомолекулярных (включая пептиды, белки, олиго- и полинуклеотиды). Липосомы положительно заряжены и могут применяться для включения различных веществ в клетки. Молярное соотношение L-α-фосфатидилхолина, стеариламина и холестерина в смеси составляло 63:18:9 соответственно.
Липосомы готовили методом пленочной гидратации с последующей обработкой ультразвуком. Липиды растворяли в 5 мл хлороформ-метанольной смеси (3:1). Липидную пленку получали путем выпаривания растворителей на роторном испарителе. Высушенную липидную пленку гидратировали добавлением 50 мл фосфатного солевого раствора (pH 7,4) в течение десяти минут при комнатной температуре с последующей обработкой ультразвуком в ультразвуковой ванне в течение 30 минут при 25 °C. Полученные липосомы хранили при 4 °С.
Функционализация липосом аптамерами. Для функционализации липосом использовали аптамер к раку легкого LC17, меченный холестерином и флуоресцентной меткой FAM, в конечной концентрации 0,5 мкМ. Для встраивания аптамера липидный слой липосомы с аптамерами инкубировали при температуре 60 °С в течение одного часа, после чего сразу помещали на пять минут на ледяную баню для восстановления конформации аптамера.
Включение фуросемида в функционализированные аптамером LC17 липосомы. Липосомы добавляли к пятикратному объему фуросемида и оставляли на 12 часов на шейкере при температуре 4 °С для замены в них фосфатно-солевого буфера на краситель. Концентрация фуросемида при этом была максимально возможной. После загрузки фуросемида в липосомы раствор переносили в диализный мешок, который помещали в фосфатно-солевой буфер на два часа при температуре 4 °С для удаления избытка фуросемида, который не вошел в липосомы.
Результаты анализировали с помощью программ Statistica 7 и Origin 7.0. Проверка различий между наборами данных оценивалась по непараметрическому критерию Манна – Уитни.
Результаты и обсуждение
Была проведена экспериментальная проверка гипотезы о возможности манипулирования скоростью роста опухоли с помощью препаратов, регулирующих клеточный объем. Для этого в асцитную карциному Эрлиха вводили препараты, вызывающие разнонаправленные изменения клеточного объема. Эксперименты показали, что инсулин увеличивал объем клеток, при этом клетки повышали свой объем в течение трех минут, а затем стабилизировались. Инсулин действует посредством активации Na+/H+-обмена и Na+-K+-2Cl−-котранспорта, что вызывает накопление натрия и хлора в клетке. Эффект фуросемида, подавляющего Na+/H+-обмен и Na+-K+-2Cl−-котранспорт [11], был противоположным. Объем асцитных клеток уменьшался в течение 3–5 минут. На популяционном уровне инсулин и фуросемид действовали аналогично.
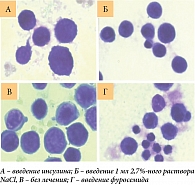
Известно, что даже незначительные колебания клеточного объема заметно меняют функциональное состояние клетки. В норме клетка имеет множество различных механизмов стабилизации своего объема. Эти механизмы могут зависеть от энергии или от ее отсутствия. Увеличение клеточного объема активирует анаболические процессы и стимулирует пролиферацию клеток. И наоборот, уменьшение клеточного объема активирует катаболизм и апоптоз [12]. Следовательно, можно предположить, что, изменяя клеточный объем, можно контролировать рост клеточной популяции, в том числе и опухолевой. В частности, если увеличить объем асцитных клеток, это может вызвать ускорение развития карциномы Эрлиха. А также можно подавить рост опухоли за счет уменьшения объема асцитных клеток. Сначала это влияние было изучено на культурах клеток in vitro. Было показано, что после 24 часов инкубации асцитных клеток с 0,005%-ным фуросемидом количество апоптотических клеток резко увеличивалось (рис. 3, В). В то же время количество апоптотических клеток после инкубации с инсулином было несколько меньше, чем в контроле (рис. 3, Б).
Эффект, полученный in vitro, не всегда воспроизводится in vivo. Поэтому проверку полученного эффекта проводили in vivo на мышах с асцитной карциномой. Для этого использовали гипертонический 2,7%-ный раствор NaCl и фуросемид для подавления клеточного объема, а инсулин и оуабаин – для его увеличения.
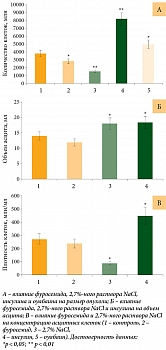
Результаты экспериментов подтвердили предположение о влиянии изменений объема клеток на рост опухоли. Так, в группах мышей, которым вводили фуросемид и 2,7%-ный раствор NaCl, количество асцитных клеток во всей опухоли по сравнению с контрольной группой снижалось на 26 и 59% соответственно (рис. 4). Введение инсулина или оуабаина приводило к увеличению количества асцитных клеток, превышающему уровень в контрольной группе, на 100 и 30% соответственно (рис. 4). При этом общий объем асцита у каждой мыши, получавшей фуросемид, уменьшался на 15%. Введение инсулина вызывало увеличение объема опухоли на 23%. Эти данные коррелировали с изменением количества асцитных клеток (рис. 4).
Хотя в группе мышей, которым вводили 2,7%-ный NaCl, количество асцитных клеток уменьшилось более чем в два раза, объем опухоли увеличился на 22% (рис. 4). При этом концентрация асцитных клеток в опухоли мыши резко изменялась в зависимости от введенного препарата. Так, под влиянием фуросемида концентрация клеток в асците снижалась на 15%, под действием инсулина повышалась на 46% (рис. 4). Но наиболее существенные изменения наблюдались при введении гипертонического раствора NaCl, что вызывало снижение концентрации асцитных клеток более чем в три раза (рис. 4).
При этом у мышей, которым вводили инсулин, клетки асцита были крупнее, чем в контрольной группе. Асцитные клетки, полученные из брюшной полости животных, получавших фуросемид и гипертонический раствор NaCl, имели меньший по сравнению с контролем размер (рис. 5).
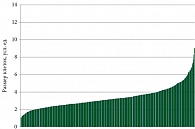
Для более точной оценки влияния препаратов, изменяющих содержание внутриклеточного натрия, был определен индивидуальный объем клеток в популяции. Данные представлены в виде кривой распределения клеточного объема (рис. 6).
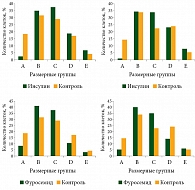
Всего было исследовано пять групп асцитных клеток в мазках в зависимости от их размера:
- самые маленькие клетки (A) – до 2 отн. ед.;
- мелкие клетки (B) – от 2 до 3 отн. ед.;
- средние клетки (C) – от 3 до 4,2 отн. ед.;
- большие клетки (D) – от 4,2 до 6,3 отн. ед.;
- очень большие клетки (E) – более 6,3 отн. ед.
Гистограмма распределения клеток по размерам при асцитной аденокарциноме по экспериментальным группам представлена на рис. 6.
При анализе распределения опухолевых клеток по размерам в разных экспериментальных группах было обнаружено, что в опухоли мышей, которым вводили инсулин, общее количество клеток из групп D и E было на 13% выше, чем в карциномах мышей, которым вводили фуросемид. Эти экспериментальные данные соответствовали нашему предположению, что увеличение объема клеток способствует стимуляции клеточного деления.
В целом результаты экспериментов показали, что в опухолях мышей, которым вводили фуросемид, присутствуют клетки меньшего объема, чем в контрольной и инсулиновой группе. Распределение клеточного объема под влиянием внутриклеточных натрий-изменяющих препаратов in vivo было аналогично кривым, полученным в тех же экспериментах in vitro.
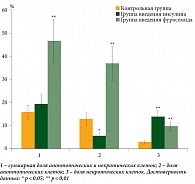
Для выяснения причин изменения скорости роста опухоли под влиянием различных препаратов была измерена доля апоптотических и некротических клеток в асцитной карциноме в каждой экспериментальной группе. Выявлено, что доля апоптотических и некротических клеток в опухолях мышей контрольной группы составляла 15%, введение инсулина существенно не изменило этот результат (рис. 7). В опухолях мышей, которым вводили фуросемид, доля апоптотических и некротических клеток возрастала до 47% (рис. 7). При этом инсулин увеличивал количество некротических клеток и уменьшал долю апоптотических. После введения фуросемида количество апоптотических и некротических клеток увеличивалось, причем доля апоптотических клеток возрастала многократно (рис. 7).
Механизмы, регулирующие рост клеточной популяции in vivo, до сих пор недостаточно ясны. Однако известно, что функциональное состояние клетки напрямую зависит от ее объема [13]. В частности, увеличение клеточного объема стимулировало деление, а уменьшение размера клеток вызывало апоптоз [12]. Итак, можно предположить, что если уменьшить размер клеток in vivo, то это может затруднить клеточную пролиферацию, включая популяции опухолевых клеток. Если вызвать увеличение объема клеток, то можно получить противоположный эффект. Была проведена экспериментальная проверка с использованием препаратов, которые могли вызывать противоположные изменения размеров клеток. Оуабаин, фуросемид, 2,7%-ный раствор NaCl и инсулин изменяют внутриклеточную концентрацию катионов натрия и, таким образом, изменяют объем клетки.
Оуабаин является специфическим ингибитором Na+,К+-АТФазы, который повышает внутриклеточное содержание натрия и, следовательно, объем клетки [14, 15]. Эффект инсулина аналогичен гипоосмотическому набуханию, он стимулирует увеличение клеточного объема за счет Na+/H+-обмена и активации Na+-K+-2Cl−-симпорта [9]. Показано, что гиперинсулинемия вызывает повышенную смертность от рака поджелудочной железы [16], рака молочной железы [17] и рака прямой кишки [18].
Наоборот, фуросемид ингибирует Na+/H+-обмен и Na+-K+-2Cl−-симпорт и, следовательно, вызывает уменьшение размера клеток [11]. А 2,7%-ный раствор NaCl уменьшает объем клеток, вызывая гипертонический шок клетки [19].
Петлевой диуретик фуросемид обычно назначают пациентам с отеком легких [6, 20]. Он действует на восходящую петлю Генле и блокирует белок-переносчик Na+/K+/2Cl− (NKCC) [21, 22]. Недавно появились доказательства того, что NKCC играет важную роль в росте злокачественных опухолей. В частности, показано, что сверхэкспрессия NKCC может индуцировать пролиферацию опухолевых клеток [23, 24]. В низкодифференцированных клетках экспрессия Na+/K+/2Cl−-котранспортера в три раза выше, чем в умеренно дифференцированных клетках аденокарциномы желудка [8]. Фуросемид в слабодифференцированных клетках блокирует NKCC и подавляет рост опухолевых клеток [8].
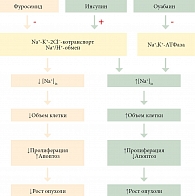
Проведенные нами эксперименты in vivo показали, что препараты, увеличивающие объем клеток, провоцируют рост асцитной опухоли и, наоборот, препараты, уменьшающие размер клеток, подавляют размножение аденокарциномы. Предположительная схема развития событий, приводящих к стимуляции или подавлению роста асцитной карциномы Эрлиха, представлена на рис. 8. В целом результаты показали, что введение в брюшную полость мышей с асцитной аденокарциномой Эрлиха препаратов, вызывающих набухание клеток, стимулировало рост опухоли. И наоборот, препараты, уменьшающие объем клеток, подавляли развитие рака. При этом основной причиной замедления роста опухоли под действием фуросемида является стимуляция апоптоза и некроза. Таким образом, результаты проведенных экспериментов открывают перспективы, позволяющие разработать новые способы подавления опухолевого прогресса с помощью препаратов, уменьшающих объем опухолевых клеток.
Таким образом, фуросемид является одним из перспективных препаратов терапии онкологических заболеваний, подавляющий рост опухоли, что было показано не только in vitro, но и in vivo. В то же время многочисленные исследования свидетельствуют о том, что применение этого препарата при терапии онкологических больных не увеличивает продолжительность их жизни, хотя и подавляет рост опухоли. По-видимому, это связано с системным побочным эффектом фуросемида на уровне всего организма, поскольку фуросемид оказывает воздействие не только на клетки злокачественных опухолей, но и на нормальные клетки, вызывая в целом нарушение ионного гомеостаза в организме.
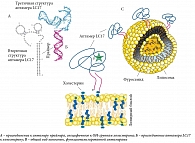
Следовательно, для подавления роста опухоли без проявления побочных эффектов необходима адресная доставка препаратов, изменяющих уровень внутриклеточного натрия. В качестве примера препарата для адресной доставки мы использовали фуросемид, блокирующий Na+/H+-обмен и Na+-K+-2Cl−-котранспорт. Для адресной доставки фуросемида были использованы липосомы, которые были нагружены этим препаратом и функционализированы аптамером, селективным к опухолевым клеткам. В качестве модели адресной терапии использовали клетки первичной культуры рака легкого человека. В качестве адресной распознающей молекулы использовали аптамер LC17, связанный с липосомами с помощью холестерина (рис. 9). Для доказательства специфичности аптамера были взяты гепатоциты мыши, которые не являлись мишенью для этого аптамера.
Клетки рака легкого человека, к которым были добавлены (1) фуросемид (0,05%); (2) липосомы, нагруженные фуросемидом, но не функционализированные аптамером, и (3) липосомы, нагруженные фуросемидом и функционализированные аптамером LC17, в течение 24 часов культивировались в СО2-инкубаторе, после чего были исследованы с помощью проточной цитометрии. Исследования показали, что чистый фуросемид и липосомы, нагруженные фуросемидом и функционализированные аптамером LC17, вызывали массовую гибель клеток рака легкого человека (рис. 10). Гепатоциты, прокультивированные с липосомами, нагруженными фуросемидом и функционализированные аптамером LC17, специфичным только клеткам рака легкого, не изменяли своей жизнедеятельности.
Заключение
В целом результаты исследований показали, что с помощью манипуляций размерами опухолевых клеток можно управлять скоростью роста опухоли. Фуросемид и гипертонический NaCl, уменьшающие клеточные размеры, подавляли рост асцитной карциномы Эрлиха, а инсулин и оуабаин, увеличивающие размеры опухолевых клеток, стимулировали ее рост in vivo. Причем введение фуросемида стимулировало апоптотическую гибель клеток, а инсулин практически не влиял на соотношение клеток в состоянии апоптоза и некроза. Адресная доставка фуросемида in vitro с помощью аптамеров LC17 способствовала гибели клеток рака легкого человека, но не влияла на жизнеспособность нормальных гепатоцитов.
Авторы выражают благодарность Евгению Николаевичу Еркаеву за разработку программы для оценки размеров асцитных клеток.
Исследование выполнено при финансовой поддержке Министерства науки и высшего образования РФ в рамках проекта № FWES-2022-0005.
R.A. Zukov, PhD, T.N. Zamay, PhD, A.V. Krat, PhD, O.S. Kolovskaya, PhD, G.S. Zamay, PhD, N.A. Luzan, V.D. Fedotovskaya, A.A. Koshmanova, K.A. Lukyanenko, I.A. Shchugoreva, PhD, I.P. Safontsev, PhD, Yu.S. Pats, PhD, S.S. Zamay, PhD, A.S. Kichkailo, PhD
V.F. Voino-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Krasnoyarsk Science Center of the Siberian Branch of the Russian Academy of Sciences
Contact person: Ruslan А. Zukov, priem@onkolog24.ru
Cell volume is an important parameter that controls its functional state. The work experimentally tested the hypothesis about the possibility of using drugs that change cell volume to manipulate the rate of tumor growth.
Material and methods. Studies were carried out in vivo on a model of Ehrlich ascitic carcinoma and in vitro on a primary culture of lung cancer. Furosemide, ouabain, insulin and 2.7% NaCl solution were used as drugs that change cell volume. Targeted delivery of furosemide to prevent side effects was carried out using liposomes loaded with furosemide and functionalized with the LC17 aptamer to selective lung cancer cells.
Results. In vivo experiments have shown that drugs (insulin and ouabain) that increase cell volume provoke the growth of ascitic tumors, and, conversely, drugs (2.7% NaCl solution and furosemide) that reduce cell size suppress the growth of Ehrlich ascitic carcinoma. In tumors of mice administered furosemide, the proportion of apoptotic and necrotic cells increased by 1.5 times, while insulin did not change the proportion of cells in apoptotic and necrotic states. Targeted delivery of furosemide in liposomes functionalized with an aptamer to lung cancer in vitro caused massive death of human lung cancer cells without affecting normal mouse hepatocytes.
Conclusion. A new strategy for the treatment of carcinogenesis may be direct or indirect manipulation of the level of intracellular sodium in a tumor cell using pharmacological drugs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.