Поражение сердечно-сосудистой системы и костной ткани при субклиническом тиреотоксикозе
- Аннотация
- Статья
- Ссылки
Введение
Тиреотоксикоз – синдром, встречающийся при различных патологических состояниях и проявляющийся повышением содержания трийодтиронина (Т3) и тироксина (Т4), оказывающих чрезмерное воздействие на органы-мишени.
На сегодняшний день доказано влияние манифестного тиреотоксикоза на сердечно-сосудистую систему, костную ткань и другие органы и системы.
Субклинический тиреотоксикоз характеризуется сниженным или неопределяемым уровнем тиреотропного гормона (ТТГ) при нормальном уровне свободного Т4 (св. Т4) и свободного Т3 (св. Т3). При этом, как правило, какие-либо симптомы отсутствуют или они неспецифичны [1–3].
Распространенность субклинического тиреотоксикоза
Результаты исследований показывают, что распространенность субклинического тиреотоксикоза варьирует от 0,6 до 3,9% населения – в зависимости от чувствительности метода исследования, используемого для определения ТТГ, и дефицита йода в регионе [1, 3]. Так, согласно данным исследования FHS, в котором участвовали 2007 пациентов 60 лет и старше, сниженный уровень ТТГ был выявлен у 3,9% больных (часть из них принимала препараты тиреоидных гормонов), манифестный тиреотоксикоз – у 0,2% [3]. В колорадском исследовании субклинический тиреотоксикоз диагностирован в 2,1% случаев, в 20% из них пациенты принимали препараты тиреоидных гормонов [1]. В исследовании NHANES III (1988–1994) субклинический тиреотоксикоз отмечен у 0,8% популяции от 12 до 80 лет, манифестный тиреотоксикоз – у 0,5% [2].
Низкий уровень ТТГ чаще наблюдается у лиц старшего возраста, женщин и представителей негроидной расы.
В среднем в популяции частота субклинического тиреотоксикоза составляет около 2% [4–6]. В йоддефицитных регионах распространенность субклинического тиреотоксикоза может быть значительно выше.
Диагностика
Диагностика субклинических состояний функциональной активности щитовидной железы (ЩЖ) стала возможной благодаря развитию лабораторных методов исследования. Она включает определение уровня ТТГ, T4 и T3, причем как свободных, так и связанных с белками.
Величина общего T4 и T3 в большей степени зависит от концентрации связывающих белков, чем от нарушения функции ЩЖ. При повышении содержания транспортных белков (использование контрацептивов, беременность) или его снижении (уровень андрогенов, цирроз печени, нефротический синдром, генетические нарушения) изменяется общая концентрация гормонов, но не содержание свободных фракций.
Изменение концентрации связывающих белков способно осложнить интерпретацию результатов исследования. В этой связи определение св. T4 и св. T3 имеет большую диагностическую значимость.
Для определения функциональных нарушений ЩЖ важное значение имеет уровень ТТГ [7]. Современные высокочувствительные методы третьего поколения позволяют определить концентрацию ТТГ < 0,01 мЕд/л, поэтому с их помощью удается выявить малейшие изменения данного показателя [2]. Созданная в 2002 г. рабочая группа, включавшая представителей Американской тиреоидологической ассоциации, Американской ассоциации клинических эндокринологов, Эндокринологического общества, установила референсный интервал для ТТГ – 0,45–4,50 мЕд/л. Уровень ТТГ < 0,1 мЕд/л предложено считать существенно сниженным, от 0,1 до 0,45 мЕд/л – незначительно сниженным [8].
Этиология
Субклинический тиреотоксикоз принято подразделять на экзогенный и эндогенный. Причинами первого являются передозировка левотироксином при заместительной терапии гипотиреоза или супрессивной терапии у пациентов, получающих лечение по поводу высокодифференцированного рака ЩЖ, а также прием йодсодержащих препаратов, в частности амиодарона, рентгеноконтрастных средств. Причинами второго – болезнь Грейвса, многоузловой зоб и функциональная автономия ЩЖ [8–13]. Среди эндогенных причин первое место занимает болезнь Грейвса. По данным В. Brownlie и соавт., около 20% пациентов, получавших радиойодтерапию или подвергнутых субтотальной тиреоидэктомии по поводу болезни Грейвса, имеют низкий уровень ТТГ при нормальных сывороточных концентрациях св. Т3 и св. Т4. Низкий уровень ТТГ наблюдался у аналогичного количества пациентов, получавших медикаментозную тиреостатическую терапию [14, 15]. Однако болезнь Грейвса может быть причиной субклинического тиреотоксикоза и без предшествующего лечения манифестного тиреотоксикоза – так называемая ранняя болезнь Грейвса. Ее подтверждением служит диффузное усиление захвата изотопа при сцинтиграфии ЩЖ, а также положительные уровни антител к рецептору ТТГ [6, 16]. Субклинический тиреотоксикоз может быть следствием медленного восстановления функции гипофиза после лечения манифестного тиреотоксикоза [6, 17].
Вторая по частоте причина эндогенного субклинического тиреотоксикоза – многоузловой зоб. Значительно реже он развивается на фоне автономно функционирующей аденомы ЩЖ [14].
Изменение сердечно-сосудистой системы при субклиническом тиреотоксикозе
Влияние повышенной секреции гормонов ЩЖ на сердечно-сосудистую систему отмечено более 200 лет назад. В 1785 г. врач из Великобритании К. Парри выявил связь между опухолью в области ЩЖ и развитием сердечной недостаточности, указав при этом на гипертрофию сердца. Спустя 50 лет ирландский врач Р. Грейвс и немецкий врач К. Базедов независимо друг от друга описали у пациентов с увеличенной ЩЖ сердцебиение и экзофтальм. В дальнейшем на фоне гиперфункции ЩЖ были зафиксированы аритмия, изменение сократительной функции миокарда и периферическая вазодилатация.
Если сердечно-сосудистые проявления манифестного тиреотоксикоза хорошо изучены, в отношении влияния субклинического тиреотоксикоза на сердечно-сосудистую систему однозначных данных пока не получено.
Тем не менее сердечно-сосудистая патология может развиваться уже при субклиническом тиреотоксикозе. Так, некоторые исследования доказали, что хронотропные, инотропные и лизинотропные (то есть диастолическое расслабление) эффекты избытка тиреоидных гормонов на сердце при манифестном тиреотоксикозе отмечаются и при субклиническом, что обусловливает повышение риска сердечно-сосудистой заболеваемости и смерти. У пациентов с субклиническим тиреотоксикозом 24-часовое мониторирование электрокардиограммы показало увеличение числа сердечных сокращений (по сравнению с пациентами с эутиреоидным состоянием) и преждевременных сокращений предсердий и желудочков [18, 19]. В двух небольших исследованиях у таких пациентов наблюдалось увеличение массы миокарда левого желудочка. Однако в более крупном исследовании эти данные не подтвердились [20, 21]. Неодинаковыми оказались результаты исследований по изучению систолической и диастолической функций различными неинвазивными методами [19, 22, 23]. Одни исследователи сообщали о нарушении диастолической функции, другие нет [22, 24].
Объяснить такие противоположные результаты можно различием в возрасте пациентов, выраженности снижения ТТГ, продолжительности субклинического тиреотоксикоза и причинах его развития. G. Leese и соавт. сравнивали частоту обращений по поводу ишемической болезни сердца пациентов, длительно принимавших препараты левотироксина. Установлено, что пациенты старше 65 лет, получавшие терапию, обращались по поводу данного заболевания чаще, чем пациенты, не получавшие подобную терапию (женщины – 2,7 против 0,7%, мужчины – 6,4 против 1,7%, р < 0,01) [25].
Субклинический тиреотоксикоз может быть связан и с изменениями показателей свертываемости крови [26, 27]. Некоторые из этих изменений не являются клинически актуальными. Однако имеются данные о случаях развития тромбоза у пациентов с манифестным тиреотоксикозом, что свидетельствует о необходимости дальнейших исследований [28].
К дополнительным факторам риска развития атеросклероза относят более выраженное увеличение комплекса «интима – медиа» у пациентов с субклиническим тиреотоксикозом по сравнению с пациентами с эутиреоидным состоянием или мягким гипотиреозом [29].
При субклиническом тиреотоксикозе повышается частота образования бляшек в каротидных артериях [30].
Мерцательная аритмия при субклиническом тиреотоксикозе
Манифестный и субклинический тиреотоксикоз, как правило, сопровождаются мерцательной аритмией и предсердной экстрасистолией
[3, 31, 32]. Тиреоидные гормоны изменяют частоту сердечных сокращений, увеличивая диастолическую деполяризацию синусового узла и облегчая проведение возбуждения через атриовентрикулярный узел. Кроме того, они влияют на предсердные миоциты, укорачивая их рефрактерный период. Это обусловливает электрическую гетерогенность и возможность повторной циркуляции возбуждения и предсердной фибрилляции. В условиях сокращения периода рефрактерности атриовентрикулярного узла и повышения его чувствительности к адренергической стимуляции регуляция ритма оказывается резистентной к лечению препаратами наперстянки. Желудочковые нарушения ритма встречаются редко – и как правило, у пациентов с патологией сердца [33].
Оценке степени риска развития фибрилляции предсердий при субклиническом тиреотоксикозе было посвящено несколько крупных исследований. Так, J. Auer и соавт. обследовали 23 000 человек в возрасте 65–70 лет. Частота развития фибрилляции предсердий при субклиническом тиреотоксикозе составила 13%, при манифестном тиреотоксикозе – 14%, при эутиреозе – 2% [34, 35]. В последующих исследованиях (n = 5860, возраст – 65 лет и старше) мерцательная аритмия диагностирована у 5–9% пациентов с субклиническим тиреотоксикозом против 4–7% пациентов контрольной группы. Распространенность мерцательной аритмии была одинаковой как при уровне ТТГ 0,1–0,4 мЕд/л, так и при уровне ТТГ < 0,1 мЕд/л [3, 36].
Субклинический тиреотоксикоз и минеральная плотность костной ткани
Избыток тиреоидных гормонов способствует ускорению процессов костного ремоделирования, что приводит к отрицательному кальциевому балансу и потере костной массы. Манифестный тиреотоксикоз является фактором риска развития остеопороза и переломов. Роль субклинического тиреотоксикоза в метаболизме костной ткани и повышении риска переломов в настоящее время обсуждается. В исследованиях с участием животных показано, что избыток Т4 является причиной остеопении, которая более выражена в кортикальной кости, чем в трабекулярной. Противоречивые результаты получены в отношении сывороточной концентрации остеокальцина, маркера костеобразования, при эндогенном и экзогенном субклиническом тиреотоксикозе. В трех исследованиях наблюдалась слабая отрицательная корреляция между уровнями ТТГ и остеокальцина в сыворотке крови [37–39].
Тиреоидные гормоны влияют на ремоделирование костной ткани у пациентов с заболеваниями ЩЖ, воздействуя прямо или косвенно на активность остеокластов. ТТГ может оказывать влияние на костную ткань через взаимодействие со специфическими рецепторами, расположенными на клетках костной ткани. В некоторых исследованиях с участием животных доказано, что снижение минеральной плотности кости (МПК) может быть обусловлено дефицитом ТТГ, а не избытком тиреоидных гормонов [40]. Хотя остеопороз, связанный с тиреотоксикозом, традиционно рассматривается как вторичное проявление нарушений функции ЩЖ. Следовательно, ТТГ напрямую влияет на процессы костного ремоделирования и резорбции.
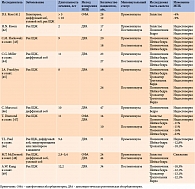
Было проведено большое количество исследований по оценке МПК у пациенток как репродуктивного возраста, так и в период постменопаузы с экзогенным субклиническим тиреотоксикозом на фоне супрессивной терапии левотироксином (см. таблицу).
Однако полученные результаты о влиянии медикаментозного субклинического тиреотоксикоза на изменение МПК оказались неоднозначными. Одни исследователи указывали на снижение МПК у данной категории больных, другие – отрицали воздействие супрессивной дозы левотироксина на МПК [41–49].
В настоящее время доказано повышение риска переломов при манифестном тиреотоксикозе [50–52]. В отношении субклинического тиреотоксикоза данные противоречивы. Так, в одном из наиболее крупных исследований, включавшем 1180 пациентов, получавших заместительную терапию левотироксином, не было отмечено увеличение риска переломов у пациентов с уровнем ТТГ < 0,05 МЕ/мл по сравнению с пациентами, у которых указанный показатель был в пределах нормы (0,5–5,5 МЕ/мл) [46]. Однако другое проспективное исследование показало, что у пациенток старше 65 лет с низким уровнем ТТГ (< 0,1 МЕ/мл) риск переломов был выше в три раза в области бедра и в четыре раза в поясничном отделе позвоночника [53].
Результаты исследования, проведенного Ж.Е. Белой, подтвердили у пациенток с эндогенным субклиническим тиреотоксикозом в период постменопаузы значимое снижение МПК, наиболее выраженное в костях кортикального строения. При экзогенном субклиническом тиреотоксикозе различий в МПК между пациентками основной и контрольной групп не выявлено. Кроме того, уровень маркеров костного ремоделирования и резорбции был достоверно выше у пациенток с субклиническим тиреотоксикозом в период постменопаузы [54].
Заключение
За последние десять лет клиническая тиреоидология обогатилась большим количеством исследований, выполненных с позиций доказательной медицины. Их авторы выявили поражение сердечно-сосудистой системы и изменение МПК у пациентов с субклиническим тиреотоксикозом. Однако имеющиеся на сегодняшний день данные противоречивы. Именно поэтому необходимо проведение дополнительных исследований с целью изучения влияния субклинического тиреотоксикоза на органы и системы, что позволит предотвратить развитие тяжелых осложнений.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.