количество статей
7120
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Применение аналога инсулина ультракороткого действия Хумалог у детей разных возрастных категорий
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №1 (9)
- Аннотация
- Статья
- Ссылки
Успех современной интенсифицированной инсулинотерапии зависит от вида инсулина и устройств для его введения. В статье представлен анализ данных клинических исследований инсулина ультракороткого действия лизпро (Хумалог) и устройств для его введения у подростков и детей разных возрастных категорий.
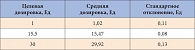
Таблица 1. Данные испытания шприц-ручки ХумаПен Люксура ДТ на точность дозирования с использованием 3 различных дозировок при 23 °C

Таблица 2. Объединенные данные испытания точности дозирования 0,5 Ед

Рисунок. Структурированная программа обучения детей и подростков с сахарным диабетом 1 типа, разработанная ФГБУ «Эндокринологический научный центр» в партнерстве с компанией «Эли Лилли»
Экспертами Всемирной организации здравоохранения (ВОЗ) сахарный диабет (СД) признан неинфекционной эпидемией XX века. Учитывая статистические данные, в XXI веке СД приобретает статус неинфекционной пандемии. Увеличение распространенности СД, в первую очередь, происходит за счет пациентов с СД 2 типа. Однако одновременно отмечается и увеличение популяции больных СД 1 типа [1]. Рост заболеваемости наблюдается не только среди взрослого населения, но, что самое тревожное, и среди детей и подростков. Так, по данным статистики г. Москвы, распространенность СД 1 типа среди подростков (15–18 лет) увеличилась в 2 раза за 15 лет – с 122 до 246 на 100 тысяч детского населения, а среди детей до 15 лет – с 80 до 94,5 на 100 тысяч детского населения за тот же период. При этом основной рост заболеваемости у детей отмечается за последние два года и преимущественно в младшей возрастной группе – до 7 лет. В связи с этим все более актуальными становятся вопросы эффективной инсулинотерапии детей с СД 1 типа, направленной на предотвращение развития и прогрессирования осложнений этого заболевания, а значит, на сохранение и продление периода социально активной и творческой жизни наших пациентов.
История инсулинотерапии, с момента открытия инсулина Фредериком Бантингом и его ассистентом Чарльзом Бестом, насчитывает уже более 90 лет. За это время были спасены миллионы жизней, в том числе детских. Однако в наши дни перед адекватной инсулинотерапией ставятся более широкие задачи: дети с СД должны иметь возможность учиться в общеобразовательных школах, посещать секции и кружки, стать активными и полноценными членами общества, достигать любых жизненных целей, дожить до преклонных лет без тяжелых осложнений СД. Изменились и препараты инсулина: инсулины животного происхождения полностью заменены на генно-инженерные человеческие, произведенные ДНК-рекомбинантным способом. Но полная имитация синтеза эндогенного инсулина стала возможна только после создания аналогов инсулина человека.
Эру аналогов открыл появившийся в 1995 г. первый аналог инсулина ультракороткого действия – инсулин лизпро (Хумалог). В последующем стали доступны другие ультракороткие аналоги инсулина: инсулин аспарт (НовоРапид, 2001 г.), инсулин глулизин (Апидра, 2006 г.). Благодаря особенностям их фармакокинетики – более быстрому по сравнению с человеческим инсулином началу действия, более раннему достижению пика действия и меньшей продолжительности действия – использование аналогов инсулина ультракороткого действия позволило пациентам с СД вести более гибкий образ жизни (режим питания и физической активности), что особенно важно для маленьких детей. В этой статье мы ставили перед собой цель проанализировать данные клинических исследований инсулина ультракороткого действия лизпро (Хумалог) и устройств для его введения у подростков и детей разных возрастных категорий.
Применение инсулина лизпро (Хумалог) у подростков
В исследовании J. Holcombe и соавт. (2002) изучалось применение инсулина Хумалог у 481 ребенка и подростка в возрасте от 9 до 18 лет [2]. Постпрандиальная гипергликемия в группе с применением инсулина лизпро была достоверно ниже по сравнению с группой пациентов, использующих растворимый человеческий инсулин, и составила после утреннего приема пищи 9,27 ммоль/л и 10,55 ммоль/л соответственно (p < 0,001). Через два часа после вечернего приема пищи одноименные показатели составили 8,56 ммоль/л и 9,27 ммоль/л соответственно (p = 0,003). Тот факт, что показатели гликемии крови перед сном, в 3 часа утра и натощак были ниже на фоне применения растворимого человеческого инсулина, подтверждает меньший риск развития гипогликемии в период с полуночи до 6 часов утра у подростков, находящихся на терапии инсулином лизпро. Уровень HbA1c у пациентов обеих групп был сопоставим. Средняя общая суточная доза инсулина составила 1,05 МЕ/кг в группе человеческого инсулина по сравнению с 1,08 МЕ/кг в группе инсулина лизпро (p < 0,001). Практическая значимость отмеченного различия представляется невысокой. Средняя суточная доза инсулина короткого действия в группе инсулина лизпро составила 0,54 МЕ/кг по сравнению с 0,53 МЕ/кг в группе человеческого инсулина (p = 0,004). Средняя суточная доза базального инсулина составила 0,54 МЕ/кг и 0,53 МЕ/кг в обеих группах соответственно (p = 0,002). Таким образом, клинически значимых различий между группами по количеству инъекций, суточной потребности в инсулине и соотношению инсулина короткого действия и базального инсулина выявлено не было. Применение инсулина лизпро приводило к уменьшению частоты эпизодов гипогликемии в целом и к статистически значимому уменьшению частоты гипогликемических реакций в ночное время.
В рамках рандомизированного перекрестного исследования [3] оценивалась постпрандиальная гликемия у 12 детей в возрасте от 12 до 16,5 лет. Исследуемые пациенты получали инъекции человеческого инсулина за 20 минут до завтрака, инсулина лизпро непосредственно перед завтраком и инсулина лизпро через 15 минут после завтрака. Результаты исследования показали, что постпрандиальная гликемия была ниже в случае введения инсулина лизпро как непосредственно перед приемом пищи, так и через 15 минут после завтрака по сравнению с инъекцией человеческого инсулина перед приемом пищи. Но статистически значимые различия в уровне гликемии в случае введения человеческого инсулина перед приемом пищи и инсулина лизпро после приема пищи отсутствовали. P. Fichna и соавт. (1998) наблюдали 40 пациентов в возрасте 12–19 лет, которые были переведены на интенсивную гибкую терапию инсулином лизпро в сочетании с инсулином НПХ (нейтральный протамин Хагедорна) и получали ее на протяжении года. В результате терапии пациенты достигли стабилизации уровня HbA1c, уменьшения частоты эпизодов гипогликемии и улучшения качества жизни при клинически не значимой прибавке в массе тела [4].
В исследовании A. Mohn и соавт. (1999) была проверена основанная на мнении практикующих врачей гипотеза о том, что человеческий инсулин перед вечерним приемом пищи может вызывать увеличение риска ночной гипогликемии у подростков. В рамках двойного слепого рандомизированного перекрестного исследования 14 подростков получали человеческий инсулин (за 30 минут до вечернего приема пищи) или инсулин лизпро (за 10 минут до приема пищи) в эквивалентных дозах. Содержание глюкозы в крови определяли каждые 15 минут, а концентрацию свободного инсулина и кетоновых тел – каждые 60 минут. По результатам данного исследования, терапия инсулином лизпро сопровождалась более низким по сравнению с человеческим инсулином уровнем гликемии крови после вечернего приема пищи. Однако после перекуса перед сном отмечалось резкое повышение уровня глюкозы крови в группе инсулина лизпро, сохранявшееся на неизменном уровне до 3 часов ночи. Несмотря на прием пищи перед сном, в группе человеческого инсулина отмечено 4 эпизода гипогликемии по сравнению с 1 эпизодом в группе инсулина лизпро. Содержание кетоновых тел между двумя группами лечения статистически значимо не различалось. Авторы пришли к заключению о способности инсулина лизпро уменьшать риск развития поздней гипогликемии и необходимости перераспределения потребления углеводов вечером [5].
Применение инсулина лизпро (Хумалог) у детей препубертатного возраста
Большой интерес представляет рандомизированное открытое перекрестное исследование с тремя периодами, в котором участвовали 60 детей в возрасте от 3 до 12 лет [6]. Каждая из групп последовательно получала либо инсулин лизпро перед приемом пищи, либо инсулин лизпро после приема пищи, либо человеческий инсулин перед приемом пищи. Показатели гликемии в течение 2 часов после завтрака и обеда были статистически значимо ниже у пациентов группы инсулина лизпро перед приемом пищи по сравнению с пациентами группы растворимого человеческого инсулина (11,7 ± 4,4 ммоль/л по сравнению с 15,0 ± 5,4 ммоль/л, p < 0,001; 8,8 ± 5,0 ммоль/л по сравнению с 10,8 ± 5,4 ммоль/л, p = 0,02 соответственно). Оптимальная динамика гликемии после завтрака и обеда наблюдалась у пациентов группы инсулина лизпро после приема пищи, далее – в порядке ухудшения показателей – следовала группа инсулина лизпро перед приемом пищи и группа детей, получавших человеческий инсулин перед приемом пищи. Бóльшая степень снижения гликемии на фоне терапии инсулином лизпро перед приемом пищи не сопровождалась увеличением частоты эпизодов гипогликемии. Хотя показатели гликемии через два часа после дневного приема пищи были статистически значимо выше в группе инсулина лизпро перед приемом пищи по сравнению с группой растворимого человеческого инсулина, большинство пациентов не получали инъекции инсулина короткого действия перед обедом. Группы лечения были сопоставимы по количеству приемов пищи, общей суточной дозе инсулина, общему количеству инъекций в сутки и дозе базального инсулина. Общая суточная доза инсулина короткого действия была несколько выше на фоне терапии растворимым человеческим инсулином по сравнению с инсулином лизпро, однако клиническая значимость отмеченного различия сомнительна.
В общей сложности пациенты и их родители отдавали предпочтение терапии инсулином лизпро. Более 73% пациентов и их родителей указали, что в будущем предпочтут инсулин лизпро растворимому человеческому инсулину. Предпочтение терапии инсулином лизпро перед приемом пищи отдали 55% пациентов и 71% родителей, в то время как введение инсулина лизпро после приема пищи выбрали 38% и 20% соответственно. Поскольку открытый дизайн исследования предусматривал оптимизацию времени введения инсулина короткого действия, нельзя исключить возможность того, что предпочтения пациентов и их родителей относились скорее ко времени введения препарата, чем к типу применяемого инсулина. Три группы лечения имели сопоставимые профили нежелательных явлений, возникших на фоне терапии. Не отмечено ни одного случая выбывания из исследования по причине развития нежелательных явлений. Частота эпизодов гипогликемии у пациентов трех групп статистически значимо не различалась.
B.N. Mukunda и соавт. (1998) провели исследование по оценке частоты и времени развития эпизодов гипогликемии у детей в возрасте от 8 до 11 лет с СД 1 типа на фоне терапии инсулином лизпро и человеческим инсулином средней продолжительности действия [7]. Исследование проводилось среди 58 детей, посещающих летний лагерь для детей с СД, 50% (n = 29) детей получали инсулин лизпро и 50% (n = 29) – человеческий инсулин. В первые 4 дня пребывания в лагере частота развития эпизодов гипогликемии в двух группах лечения была сопоставимой, однако время их развития различалось. В первые три часа после инъекции в группе инсулина лизпро у 5 пациентов из 71 развивались эпизоды гипогликемических реакций по сравнению с 15 из 68 эпизодов в группе человеческого инсулина (p = 0,03). В период от 6 до 12 часов после инъекции частота развития эпизодов гипогликемии между группами статистически значимо не различалась. Согласно заключению авторов, с целью предотвращения эпизодов гипогликемии у детей с СД, планирующих физическую активность в течение трех часов после инъекции, следует применять инсулин лизпро.
Применение инсулина лизпро (Хумалог) у детей дошкольного возраста
K.S. Rutledge и соавт. (1997) сравнили эффективность человеческого инсулина и инсулина лизпро, вводимого после приема пищи, у пяти детей младше 5 лет [8]. Авторы также провели сравнительный анализ эффективности пре- и постпрандиального введения инсулина лизпро еще у пяти детей. Показатели гликемии были статистически значимо ниже у пациентов группы инсулина лизпро после приема пищи по сравнению с пациентами, получавшими человеческий инсулин перед приемом пищи. В то же время профили постпрандиальной гликемии на фоне введения инсулина лизпро перед и после приема пищи были сопоставимы. На основании данных исследования был сделан следующий вывод: введение инсулина лизпро у детей раннего возраста после приема пищи является эффективным и позволяет корректировать дозу инсулина в соответствии с фактическим объемом съеденной пищи, что обеспечивает гибкость дозирования и оптимальный контроль гликемии.
R. Wasikowa и соавт. (2001) описали применение инсулина лизпро, начиная с грудного возраста, у 3 детей (в возрасте от 9 до 22 месяцев) [9]. Во всех трех случаях удалось достигнуть адекватного контроля гликемии (уровень HbA1c составил 6,71%, 6,46% и 6,42%) при отсутствии эпизодов тяжелой гипогликемии. В заключение авторы указали, что применение инсулина лизпро у детей раннего возраста позволяет достигнуть хорошего контроля метаболизма, а введение препарата после приема пищи сопровождается дальнейшим ростом эффективности терапии.
Способы введения инсулина Хумалог
Успех современной интенсифицированной инсулинотерапии во многом обеспечивается не только видом инсулина, но и устройством для его введения. Для каждой возрастной категории детей существуют свои особенности инъекций. Для детей младшего возраста крайне важным является введение инсулина с точностью дозировки 0,5 Ед. В таких случаях инсулинотерапию можно осуществлять с помощью шприц-ручки ХумаПен Люксура ДТ. Точность дозирования шприц-ручки ХумаПен Люксура ДТ соответствует стандартам, установленным Международной организацией по стандартизации (International Organization for Standardization, ISO). Шприц-ручку ХумаПен Люксура ДТ исследовали в соответствии со стандартами ISO при введении различных дозировок инсулина (табл. 1) и при различных температурах. Было проведено исследование для оценки точности дозирования начальной дозировки 0,5 Ед [10]. Данные по результатам всех испытаний начальной дозы 0,5 Ед были объединены для анализа с целью определения средней дозы (табл. 2). Все значения, полученные для 577 испытаний (независимо от номера партии устройства, оператора, температуры, при которой проводили испытания, а также номера партии картриджа), соответствовали техническим требованиям, а также соответствовали коэффициенту k, что свидетельствует о наличии 95%-ного доверительного интервала, согласно которому не менее 95% всех начальных доз по 0,5 Ед являются точными.
Для детей старшего возраста и подростков с их динамичным и нередко непредсказуемым образом жизни специально разработана одноразовая шприц-ручка КвикПен с инсулином Хумалог. Было проведено несколько клинических исследований шприц-ручки КвикПен с целью изучения точности дозирования и силы нажатия. В исследовании D.A. Ignaut и соавт. (2008) оценивались 50 шприц-ручек КвикПен и 50 шприц-ручек ФлексПен. Показано, что шприц-ручка КвикПен характеризуется меньшим усилием, необходимым для инъекции инсулина, и меньшей его вариабельностью [11]. В другом исследовании оценивалось удобство введения шприц-ручки КвикПен, а также сравнивались предпочтения пациентов в отношении шприц-ручек КвикПен и ФлексПен [12]. В исследовании приняли участие 232 больных СД в возрасте от 40 до 75 лет, 94% из них имели СД 2 типа. Оценивались следующие характеристики: легкость удержания во время инъекции, легкость нажатия на поршень при инъекции, простота использования. 87% (202/231) пациентов, использовавших шприц-ручку КвикПен, и 73% (170/232) пациентов, использовавших шприц-ручку ФлексПен (p = 0,002), выразили согласие или полное согласие с тем, что во время инъекции им было легко удерживать в руке шприц-ручку. 85% (197/231) пациентов, использовавших шприц-ручку КвикПен, и 66% (154/232) пациентов, использовавших шприц-ручку ФлексПен (p < 0,001), выразили согласие или полное согласие с тем, что им было легко нажимать на регулятор шприц-ручки во время инъекции. 94% (218/231) пациентов, использовавших шприц-ручку КвикПен, и 84% (193/231) пациентов, использовавших шприц-ручку ФлексПен (p = 0,006), выразили согласие или полное согласие с тем, что им было легко использовать шприц-ручку. Шприц-ручка КвикПен обладает также такими преимуществами, как эргономичность, меньшая по сравнению с ФлексПен длина (требуется меньший диапазон движения большого пальца при инъекции инсулина), больший диаметр. Кроме того, благодаря своей форме шприц-ручка КвикПен надежно фиксируется в руке. В целом, в этом исследовании шприц-ручку КвикПен предпочло большее количество пациентов, чем шприц-ручку ФлексПен, – 67% (155 пациентов из 231) против 37% (76 пациентов из 231) [12].
Независимо от возраста, наиболее предпочтительным вариантом инсулинотерапии является введение инсулина с помощью инсулиновой помпы. При проведении нескольких рандомизированных клинических исследований непрерывное подкожное введение инсулина с помощью помпы (НПИИ) сравнивали с режимом множественных инъекций инсулина (МИ) у детей и подростков. В ходе этих исследований отмечены схожие или меньшие показатели уровня HbA1c и сопоставимая частота возникновения гипогликемии при НПИИ (вводился инсулин лизпро) в сравнении с режимом МИ, при котором применяли обычный человеческий инсулин в сочетании с инсулином промежуточного или пролонгированного действия [13–16]. При проведении других исследований у детей и подростков, в которых сравнивали режимы НПИИ (вводился инсулин лизпро) и МИ (в качестве базального инсулина вводился инсулин НПХ), было продемонстрировано значительное снижение как концентрации гликированного гемоглобина HbA1c [17–19], так и глюкозы в крови натощак на фоне терапии НПИИ [18]. В двух из этих исследований было отмечено значительное сокращение частоты возникновения эпизодов тяжелой гипогликемии после начала применения НПИИ по сравнению с состоянием до применения НПИИ [17, 18].
Обучение пациентов
К одному из значимых методов лечения для длительного поддержания компенсации сахарного диабета отнесено обучение пациентов и их родителей методам самоконтроля диабета. Важность и необходимость обучения в настоящее время не вызывают сомнений. Как показывают результаты исследований, значимой причиной, препятствующей достижению длительной компенсации углеводного обмена, может служить низкий уровень адаптации семьи к заболеванию ребенка, конфликт «отцов и детей» в семьях подростков. Организация достаточного количества «Школ диабета», где занятия проводятся педиатрами-эндокринологами по специально разработанным структурированным программам, позволяет решать эту проблему и достигать целей терапии в большем проценте случаев. На сегодняшний день в России существует структурированная программа обучения детей и подростков с СД 1 типа, разработанная ФГБУ «Эндокринологический научный центр» в партнерстве с компанией «Эли Лилли». В программе используются следующие учебно-методические и наглядные пособия: 1) брошюра, состоящая из 9 тематических блоков по отдельным проблемам СД 1 типа, с четким пошаговым изложением материала на занятии, 2) глянцевые плакаты для всех тематических блоков, используемые в качестве визуальной поддержки, 3) наглядные тарелки с хлебными единицами, 4) круг для подсчета хлебных единиц, 5) отрывные листы для закрепления материала по каждому из 9 тематических блоков (рис.). Благодаря созданию обучающей компьютерной игры для детей и подростков с СД 1 типа, процесс обучения для детей стал более интересным. В программе есть много игровых заданий для закрепления знаний и навыков, а сложная информация о заболевании изложена простым языком.
Заключение
На основании проведенного анализа данных клинических исследований инсулина ультракороткого действия лизпро (Хумалог) и устройств для его введения у подростков и детей разных возрастных категорий можно сделать следующие выводы:
- Интенсивная терапия инсулином лизпро является приемлемой альтернативой у подростков с СД, уменьшая частоту гипогликемий и обеспечивая большую свободу выбора режима питания и активности.
- Инсулин лизпро перед или после приема пищи позволяет улучшить контроль постпрандиальной гликемии и является эффективным и безопасным препаратом для лечения СД у детей препубертатного возраста.
- Применение инсулина лизпро у детей раннего возраста является эффективным и позволяет корректировать дозу в соответствии с фактическим объемом съеденной пищи, что обеспечивает гибкость дозирования и оптимальный контроль гликемии.
- Для достижения компенсации углеводного обмена большую роль играет устройство введения инсулина, которое необходимо подбирать, учитывая возрастные особенности пациента и его потребности.
- Обязательным условием успеха терапии пациентов с СД 1 типа является обучение в школах диабета по структурированным и адаптированным с учетом особенностей детского и подросткового возраста программам.
1. Gale E.A.M. The rise of childhood type 1 diabetes in the 20thCentury // Diabetes. 2002. Vol. 51. P. 3353–3361.
2. Holcombe J.H., Zalani S., Arora V.K. et al. Comparison of insulin lispro with regular human insulin for the treatment of type 1 diabetes in adolescents // Clin. Ther. 2002. Vol. 24. № 4. P. 629–638.
3. Rami B., Schober E. Postprandial glycaemia after regular and lispro insulin in children and adolescents with diabetes // Eur. J. Pediatr. 1997. Vol. 156. № 11. P. 838–840.
4. Fichna P. Introduction of intensive flexible therapy with rapidly acting insulin-Humalog (Lispro) in IDDM adolescents // Hormone Research. 1998. Vol. 50. Suppl. 1. P. 101.
5. Mohn A., Matyka K.A., Harris D.A. et al. Lispro or regular insulin for multiple injection therapy in adolescence. Differences in free insulin and glucose levels overnight // Diabetes Care. 1999. Vol. 22. № 1. P. 27–32.
6. Deeb L.C., Holcombe J.H., Brunelle R. et al. Insulin lispro lowers postprandial glucose in prepubertal children with diabetes // Pediatrics. 2001. Vol. 108. № 5. P. 1175–1179.
7. Mukunda B.N. Hypoglycemia: Lispro versus regular insulin at a diabetic children’s summer camp // J. Investig. Med. 1998. Vol. 46. Suppl. 3. P. 240A.
8. Rutledge K.S., Chase H.P., Klingensmith G.J. et al. Effectiveness of postprandial Humalog in toddlers with diabetes // Pediatrics. 1997. Vol. 100. № 6. P. 968–972.
9. Wasikowa R., Barg E., Wikiera B. Therapy with insulin analogue Humalog in three infants with diabetes mellitus type 1: Case reports // Diabetologia Polska. 2001. Vol. 7. Suppl. 1. Abstract.
10. Clark P.E., Okenfuss C.R., Campbell M. Half-unit dose accuracy with HumaPen Luxura HD: an insulin pen for patients who need precise dosing // J. Diabetes Sci. Technol. 2010. Vol. 4. № 2. P. 353–356.
11. Ignaut D.A., Opincar M., Lenox S. FlexPen and KwikPen Prefilled Insulin Devices: A Laboratory Evaluation of Ergonomic and Injection Force Characteristics // J. Diabetes Sci. Technol. 2008. Vol. 2. № 3. P. 533–537.
12. Ignaut D.A., Schwartz S.L., Sarwat S. et al. Comparative device assessments: Humalog KwikPen compared with vial and syringe and FlexPen // Diabetes Educ. 2009. Vol. 35. № 5. P. 789–798.
13. Cohen D., Weintrob N., Benzaquen H. et al. Continuous subcutaneous insulin infusion versus multiple daily injections in adolescents with type I diabetes mellitus: a randomized open crossover trial // J. Pediatr. Endocrinol. Metab. 2003. Vol. 16. № 7. P. 1047–1050.
14. DiMeglio L.A., Pottorff T.M., Boyd S.R. et al. A randomized, controlled study of insulin pump therapy in diabetic preschoolers // J. Pediatr. 2004. Vol. 145. № 3. P. 380–384.
15. Weintrob N., Benzaquen H., Galatzer A. et al. Comparison of continuous subcutaneous insulin infusion and multiple daily injection regimens in children with type 1 diabetes: a randomized open crossover trial // Pediatrics. 2003. Vol. 112. № 3. Pt. 1. P. 559–564.
16. Wilson D.M., Buckingham B.A., Kunselman E.L. et al. A two-center randomized controlled feasibility trial of insulin pump therapy in young children with diabetes // Diabetes Care. 2005. Vol. 28. № 1. P. 15–19.
17. Ahern J.A., Boland E.A., Doane R. et al. Insulin pump therapy in pediatrics: a therapeutic alternative to safely lower HbA1c levels across all age groups // Pediatr. Diabetes. 2002. Vol. 3. № 1. P. 10–15.
18. Berhe T., Postellon D., Wilson B. et al. Feasibility and safety of insulin pump therapy in children aged 2 to 7 years with type 1 diabetes: a retrospective study // Pediatrics. 2006. Vol. 117. № 6. P. 2132–2137.
19. Sulli N., Shashaj B. Long-term benefits of continuous subcutaneous insulin infusion in children with Type 1 diabetes: a 4-year follow-up // Diabet. Med. 2006. Vol. 23. № 8. P. 900–906.
Новости на тему
02.02.2024
21.09.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.