Применение этацизина для подавления желудочковой экстрасистолии у пациентов после неэффективной катетерной аблации
- Аннотация
- Статья
- Ссылки
- English
Основные положения. У пациентов без структурного поражения сердца наиболее частой локализацией желудочковой экстрасистолии (ЖЭС) является зона выносящего тракта правого желудочка (ВТПЖ). Методом лечения первой линии в этом случае является радиочастотная аблация. В случае ее неэффективности пациенту может быть назначена антиаритмическая терапия. Наиболее эффективны в лечении ЖЭС антиаритмические препараты 1С класса.
Заключение. Показан хороший клинический результат лечения ЖЭС с помощью антиаритмических препаратов 1С класса после неэффективной попытки катетерной аблации.
Основные положения. У пациентов без структурного поражения сердца наиболее частой локализацией желудочковой экстрасистолии (ЖЭС) является зона выносящего тракта правого желудочка (ВТПЖ). Методом лечения первой линии в этом случае является радиочастотная аблация. В случае ее неэффективности пациенту может быть назначена антиаритмическая терапия. Наиболее эффективны в лечении ЖЭС антиаритмические препараты 1С класса.
Заключение. Показан хороший клинический результат лечения ЖЭС с помощью антиаритмических препаратов 1С класса после неэффективной попытки катетерной аблации.
Введение
Распространенным нарушением ритма сердца является желудочковая экстрасистолия (ЖЭС), ее проявления варьируют от бессимптомного течения до выраженного ухудшения состояния и снижения качества жизни. В большинстве случаев мономорфная ЖЭС у пациентов без структурного поражения миокарда является доброкачественным состоянием и не требует лечения [1, 2]. Тем не менее частая ЖЭС (более 15% от общего количества сердечных сокращений, по данным холтеровского мониторирования электрокардиограммы (ХМ-ЭКГ)) может приводить к дилатации камер сердца, снижению сократительной функции миокарда левого желудочка и, как следствие, к развитию вторичной кардиомиопатии, ассоциированной с аритмией [3–5].
У пациентов без структурного поражения сердца наиболее частой локализацией ЖЭС является зона выносящего тракта правого желудочка (ВТПЖ) – 70% всех идиопатических ЖЭС. В такой ситуации катетерная аблация является методом лечения первой линии. При инФЯой локализации эктопического очага (выносящий тракт левого желудочка, синусы Вальсальвы, аорто-митральное соединение, большая вена сердца, эпикардиальные зоны, проксимальный отдел легочной артерии) катетерную аблацию следует рассматривать в тех случаях, когда неэффективен хотя бы один антиаритмический препарат, назначенный в адекватной терапевтической дозе, при непереносимости лекарственной терапии и в случаях, когда пациент категорически не настроен на долгосрочную медикаментозную терапию [1, 2, 6].
При проведении радиочастотной катетерной аблации, или радиочастотной аблации (РЧА), аритмогенного источника широко применяется активационное картирование и/или картирование на фоне стимуляции в различных точках во время электрофизиологического исследования (ЭФИ). Применение современных систем электроанатомического картирования позволяет более точно установить локализацию источника ЖЭС и обеспечить эффективность катетерной аблации [1–4, 6].
Тем не менее в ряде случаев РЧА может быть неэффективна либо иметь частичный эффект, связанный с локализацией аритмии и риском развития интра- и постоперационных осложнений. В таких случаях обсуждается вопрос о назначении антиаритмической терапии у пациентов без структурного заболевания сердца. Наиболее эффективны в лечении ЖЭС антиаритмические препараты 1С класса [1, 2, 4, 7, 8].
Клинический случай
Пациентка, 19 лет, обратилась в консультативно-диагностическое отделение НМИЦ кардиологии им. акад. Е.И. Чазова Минздрава России в декабре 2024 г. с жалобами на перебои в работе сердца, снижение толерантности к физическим нагрузкам.
В 2020 г. в легкой форме перенесла COVID-19. В том же году при плановом медицинском осмотре в школе на ЭКГ была впервые зарегистрирована частая ЖЭС. При проведении ХМ-ЭКГ зарегистрировано 1142 ЖЭС/сут, по поводу чего была рекомендована терапия калия и магния аспарагинатом. В 2022 г. при ХМ-ЭКГ зарегистрировано 17010 ЖЭС/сут. Пациентка была госпитализирована в детскую клиническую больницу по месту жительства, где был поставлен диагноз «Неревматический миокардит с поражением проводящей системы сердца». Проводилась терапия глюкокортикостероидами, амиодароном. Спустя четыре месяца терапии амиодароном сохранялась частая ЖЭС, в связи с чем препарат был отменен. Назначена терапия этацизином 50 мг/сут (учитывая возраст пациентки, препарат был назначен по решению врачебной комиссии), на фоне его приема при серии контрольных ХМ-ЭКГ желудочковую экстрасистолию не регистрировали.
В начале 2023 г. этацизин был отменен. В конце 2023 г. ЖЭС рецидивировала в количестве 41466 в сут. При анализе серии ЭКГ, ХМ-ЭКГ – экстрасистолия мономорфная, соответствует локализации ВТПЖ. На фоне учащения экстрасистолии пациентка стала отмечать слабость, снижение толерантности к физическим нагрузкам, симптомные перебои в работе сердца. По данным эхокардиографии (ЭхоКГ), стенки сердца не утолщены, камеры не расширены, фракция выброса левого желудочка (ФВ ЛЖ) – 60%, зон нарушения локальной сократимости не отмечено.
Летом 2024 г. проведена магнитно-резонансная томография сердца с контрастированием гадодиамидом (Омнискан): ФВ ЛЖ – 54%, конечно-диастолический объем (КДО) ЛЖ – 110 мл, конечно-систолический объем (КСО) ЛЖ – 51 мл, участков патологического контрастирования в миокарде левого желудочка и нарушений локальной сократимости убедительно не выявлено, объемы предсердий не увеличены.
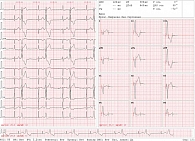
В феврале 2025 г. пациентка госпитализирована в НМИЦ кардиологии им. акад. Е.И. Чазова для проведения радиочастотной катетерной аблации источника ЖЭС. При поступлении на ЭКГ (рис. 1) в отсутствие антиаритмической терапии интервалы ЭКГ – в пределах нормальных значений. При ХМ-ЭКГ ритм синусовый, зарегистрировано 41583 ЖЭС/сут: экстрасистолия монофокусная, регистрируется как в дневные часы, так и в ночные, представлена одиночными ЖЭС и эпизодами бигеминии, паузы не зарегистрированы.
По данным ЭхоКГ, аорта не расширена, левое предсердие 3,2 см/38 мл, конечно-диастолический размер ЛЖ – 4,8 см, конечно-систолический размер ЛЖ – 3,8 см (размер полости ЛЖ на верхней границе конституциональной нормы), ФВ ЛЖ – 55%, зон нарушения локальной сократимости не выявлено, толщина межжелудочковой перегородки и задней стенки ЛЖ – 0,6 см. В анализах крови и мочи клинически значимых отклонений не выявлено.
В ходе внутрисердечного ЭФИ выполнена 3D-реконструкция ВТПЖ при помощи навигационной системы EnSite. По результатам активационного эндокардиального картирования на фоне спонтанных ЖЭС, зона наиболее ранней электрической активности (-20–25 мс) выявлена в широкой области, соответствующей заднесептальному сегменту ВТПЖ. По результатам стимуляционного картирования из данных зон совпадение комплексов QRS – на 85–90%. Выполнена серия радиочастотных катетерных воздействий (мощностью 30 Вт по 40–60 секунд) в зонах наиболее ранней электрической активности: во время воздействий регистрировалось учащение желудочковой эктопии (феномен «разогрева») без последующего исчезновения аритмии. После серии аблационных воздействий сохранялась частая ЖЭС.
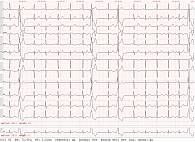
В послеоперационный период у пациентки сохранялась частая мономорфная желудочковая экстрасистолия (рис. 2).
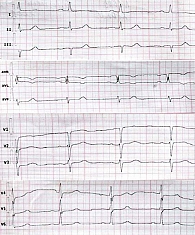
По данным контрольного ХМ-ЭКГ, после вмешательства зарегистрировано 40308 ЖЭС/сут. Учитывая положительный антиаритмический эффект этацизина в дозе 50 мг/сут в анамнезе и удовлетворительную переносимость препарата, принято решение возобновить терапию с этой дозировки. На фоне приема этацизина в дозе 50 мг/сут отмечено уменьшение экстрасистолии до 17507 в сут. На фоне увеличения дозы этацизина до 150 мг/сут достигнуто дополнительное снижение до 193 ЖЭС/сут, нарушений проводимости на фоне приема препарата не отмечено. На ЭКГ (рис. 3) длительность интервалов PQ и QRS сохранялась в пределах допустимых значений, переносимость терапии удовлетворительная. На фоне уменьшения экстрасистолии пациентка отметила значительное улучшение самочувствия, повышение толерантности к физическим нагрузкам, регресс ощущений перебоев в работе сердца.
На фоне продолжения антиаритмической терапии этацизином при плановом визите через три месяца на серии контрольных ЭКГ ЖЭС не регистрировалась. Субъективно нарушения ритма сердца пациентку не беспокоят, она продолжает прием этацизина в дозе 150 мг/сут, переносимость терапии удовлетворительная. Рекомендовано дальнейшее наблюдение у кардиолога, продолжение приема препарата под регулярным контролем параметров ЭКГ, ХМ-ЭКГ и ЭхоКГ.
Обсуждение
Согласно данным международных наблюдений, РЧА источника ЖЭС из области ВТПЖ является высокоэффективным методом лечения [1–3, 8, 9]. Тем не менее в клинической практике встречаются случаи, когда после катетерных аблаций у пациентов сохраняется частая симптомная экстрасистолия [3, 10, 11]. При иной локализации аритмогенного источника катетерная аблация может быть сопряжена с рядом осложнений, что может быть обусловлено интрамуральным расположением источника эктопии, его близостью к жизненно важным структурам, таким как коронарные артерии или проводящая система сердца [12]. В таких ситуациях обсуждается вопрос о назначении антиаритмической терапии при отсутствии органической патологии сердца. Наиболее эффективными средствами подавления ЖЭС являются препараты 1С класса [1, 2, 4, 5, 7, 8]. Многочисленные исследования показали, что эффективность антиаритмической терапии препаратами 1С достигает 90%, что в полной мере относится и к пациентам с предшествующей неуспешной катетерной аблацией [5, 7–10, 13].
В крупное многоцентровое международное исследование, где наблюдались пациенты из восьми центров, за период с 2004 по 2013 г. были включены 1185 пациентов с идиопатическими ЖЭС. Успешное устранение ЖЭС с помощью РЧА было достигнуто в 84% случаев. При долгосрочном наблюдении у ряда пациентов ЖЭС рецидивировала, вследствие чего показатель эффективности выполненного вмешательства снизился до 71%. Дополнительное назначение антиаритмической терапии позволило вновь повысить этот показатель до 85%. Важно отметить, что единственным предиктором успешной РЧА была локализация ЖЭС в области ВТПЖ, тогда как у пациентов с эпикардиальной локализацией и мультифокальными ЖЭС катетерная аблация была менее эффективна и связана с повышенным риском развития осложнений [3].
Этацизин – антиаритмический препарат 1С класса, действие которого обусловлено блокадой быстрых натриевых каналов мембран кардиомиоцитов [14]. Он вызывает медленно развивающуюся блокаду и медленное восстановление быстрого натриевого тока в волокнах Пуркинье, а также замедляет проведение по желудочкам, не влияя или незначительно удлиняя эффективный рефрактерный период, чем и обусловлена его выраженная активность в отношении желудочковых тахиаритмий [15].
Лишенный бета-адреноблокирующего или адреномиметического действия, этацизин не оказывает влияния на частоту сердечных сокращений, артериальное давление и гладкую мускулатуру внутренних органов, что делает возможным его применение у пациентов с сопутствующими обструктивными заболеваниями легких, артериальной гипертензией, а также у пациентов с тенденцией к синусовой брадикардии, тахикардии или артериальной гипотензии [14, 16, 17]. Наряду с этим этацизин оказывает холинолитическое действие, что делает его эффективным в отношении вагус-зависимых аритмий [14, 18]. После однократного приема 50 мг препарата внутрь, он достигает пиковой концентрации в крови через 2–2,5 часа, продолжительность его действия – 6–8 часов. Этим обусловлена кратность приема этацизина (по 50 мг 2–4 раза в день), при этом деление таблетки недопустимо [14].
В ряде российских и международных наблюдений была продемонстрирована высокая эффективность этацизина в лечении ЖЭС у пациентов без структурного поражения сердца и, наряду с этим, высокая безопасность, в том числе при сравнении с другими препаратами 1C класса [1, 13, 19]. В подавляющем числе случаев пациенты хорошо переносят этацизин, кроме того, он не оказывает заметного влияния на их ежедневную деятельность [20]. Лечение этацизином важно проводить при тщательным мониторировании параметров ЭКГ. Критерием эффективности является снижение ЖЭС на 75% от исходного числа. Среди нежелательных эффектов крайне редко можно отметить головокружение, головную боль, нарушение зрения, в большинстве случаев проходящие самостоятельно через несколько дней приема и крайне редко приводящие к отмене препарата [4, 1].
Представленный нами клинический случай служит примером успешного лечения ЖЭС с помощью этацизина после неэффективной попытки катетерной аблации. На фоне приема препарата в дозе 50 мг/сут отмечено снижение количества ЖЭС на 50%, а в дозе 150 мг/сут полностью подавлена экстрасистолия. Отмечена хорошая переносимость препарата и безопасность терапии, подтвержденная мониторированием параметров ЭКГ и данными ХМ-ЭКГ.
Заключение
Таким образом, на основании нашего наблюдения и опыта международной практики, заключаем, что терапия этацизином является успешной альтернативой катетерной аблации у пациентов с безуспешными попытками интервенционного вмешательства. Этацизин может быть использован вместо интервенционного лечения и при анатомически сложной локализации источника ЖЭС, когда попытки аблации сопряжены с высоким риском развития периоперационных осложнений.
A.I. Loginova, N.Yu. Mironov, V.V. Sviridova, P.S. Novikov, S.P. Golitsyn
National Medical Research Center for Cardiology named after academician Ye.I. Chazov
Contact person: Anastasiya I. Loginova, dr.loginova.a@gmail.com
Aim. To demonstrate a successful application of class 1C antiarrhythmic drugs for the treatment of ventricular extrasystole (VES) in a patient after a series of ablation procedures.
Key points. In patients without structural heart disease, the most common VES localization is the right ventricular outflow tract (RVOT). The first-line treatment modality in this case is radiofrequency ablation. If it is not effective, the patient may be prescribed antiarrhythmic therapy. Class 1C antiarrhythmic drugs are the most effective ones for treating VES.
Conclusion. The authors demonstrate a good clinical outcome of treating VES with class 1C antiarrhythmic drugs after the ineffective attempts to use catheter ablation.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


