Применение осимертиниба в первой линии терапии немелкоклеточного рака легкого у молодой пациентки с метастазами в центральной нервной системе
- Аннотация
- Статья
- Ссылки
- English

Введение
В последние десятилетия подходы к лекарственной терапии немелкоклеточного рака легкого (НМРЛ) существенно изменились. Это обусловлено открытием драйверных мутаций, пониманием механизмов противоопухолевого иммунитета и роли микроокружения опухоли, а также внедрением в клиническую практику новых препаратов. В 2000-х гг. первыми из класса таргетных препаратов появились ингибиторы тирозинкиназы (ИТК) рецептора эпидермального фактора роста (epidermal growth factor receptor, EGFR).
В исследовании IPASS препарат ИТК EGFR первого поколения гефитиниб продемонстрировал преимущество перед стандартной терапией первой линии у пациентов с активирующими мутациями в гене EGFR [1]. С 2017 г. арсенал онкологов, состоявший из препаратов первого (гефитиниб и эрлотиниб) и второго (афатиниб) поколений, пополнился препаратом третьего поколения – осимертинибом. В отличие от препаратов предыдущих поколений осимертиниб необратимо и селективно ингибирует тирозинкиназу EGFR при активирующих мутациях и мутации резистентности Т790М, а также проявляет активность в центральной нервной системе (ЦНС) [2].
Препарат, изначально зарегистрированный в России в качестве терапии распространенного НМРЛ с мутацией Т790М в EGFR у взрослых пациентов, в мае 2018 г. зарегистрирован в качестве первой линии терапии у пациентов с распространенным НМРЛ с наличием драйверной мутации в гене EGFR. Регистрация осимертиниба в первой линии терапии основана на результатах двойного слепого рандомизированного исследования III фазы FLAURA [3]. В исследовании эффективность и безопасность осимертиниба 80 мг один раз в сутки сравнивали с таковыми гефитиниба и эрлотиниба у больных распространенным НМРЛ с активирующей мутацией в гене EGFR. Исследование достигло первичной конечной точки с высокой степенью статистической значимости данных. По оценке исследователей, выживаемость без прогрессирования (ВБП) в группе осимертиниба составила 18,9 месяца (95%-ный доверительный интервал (ДИ) 15,2–21,4), в группе стандартной терапии – 10,2 месяца (95% ДИ 9,6–11,1). Относительный риск (ОР) – 0,46 (95% ДИ 0,37–0,57), p < 0,0001 при зрелости данных 62% (342 события у 556 пациентов на момент среза данных: группа осимертиниба – 136 (49%) событий, группа стандартной терапии – 206 (74%) событий). При этом осимертиниб продемонстрировал преимущество абсолютно во всех проанализированных подгруппах пациентов (пол, возраст, статус курения, наличие метастазов в ЦНС, вариант мутации и т.д.)[3]. Частота объективного ответа достигла 80% в группе осимертиниба и 76% в группе стандартной терапии, отношение шансов – 1,28 (95% ДИ 0,85–1,93; р = 0,2335). Таким образом, осимертиниб стал новой высокоэффективной опцией в терапии первой линии распространенного НМРЛ при наличии мутаций в гене EGFR.
Клинический случай
Пациентка Ш. 1980 года рождения, европейской этнической принадлежности. Семейный и индивидуальный онкологический анамнез не отягощен, не курит, профессиональная деятельность не связана с вредными и опасными условиями, жалоб нет.
Плановая флюорография в 2014 г. без патологии.
В сентябре 2016 г. после родов направлена на плановую флюорографию. Обнаружено образование в верхней доле правого легкого.
Компьютерная томография (КТ) отдела грудной клетки: в верхней доле правого легкого образование 33 × 30 × 30 мм, внутригрудные лимфоузлы не увеличены, данных об отдаленных метастазах нет.
10 октября 2016 г. выполнена видеоассистированная верхняя лобэктомия справа.
Гистологическое заключение: умеренно дифференцированная аденокарцинома легкого с метастазами в двух лимфоузлах. При проведении молекулярно-генетической диагностики операционного опухолевого материала выявлена мутация del19ex в гене EGFR.
Заключительный диагноз: периферический рак верхней доли правого легкого, T2N1M0.
В послеоперационном периоде с декабря 2016 г. по март 2017 г. проведено четыре курса адъювантной химиотерапии в режиме «винорелбин + цисплатин». На фоне терапии отмечалось развитие гематологической токсичности (нейтропения 3-й степени).
Контрольная позитронно-эмиссионная томография (ПЭТ)-КТ в марте и октябре 2017 г. – без признаков метастазов.
В декабре 2017 г. появились интенсивные головные боли, не купируемые анальгетиками, головокружение, снижение памяти.
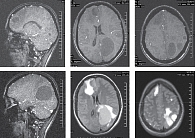
Магнитно-резонансная томография (МРТ) головного мозга от 19 декабря 2017 г.: в медиальных отделах полюса правой лобной доли округлое образование с кольцевидным накоплением контраста около 15 мм с большим перифокальным отеком. В левой теменной и затылочных долях несколько подобных образований до 50 × 40 мм, в левой лобной доле единичное кольцевидное образование до 7 мм без перифокального отека. Аналогичное кольцевидное образование в правой затылочной доле. Срединные структуры головного мозга смещены вправо на 7 мм. Желудочки поддавлены, деформированы, субарахноидальное пространство сужено. Участок накопления контрастного вещества в правой теменной кости, вероятно, вторичного генеза (рис. 1).
Назначены дексаметазон, ацетазоламид, маннитол. На фоне применения препаратов наблюдался незначительный положительный эффект.
27 декабря 2017 г. пациентка начала прием осимертиниба 80 мг. Уже через три дня отмечались существенное уменьшение головных болей и субъективное улучшение самочувствия.
ПЭТ-КТ в январе 2017 г.: гиперметаболическая активность в лимфоузлах шеи и надключичных лимфоузлах.
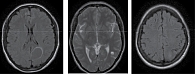
Контрольная МРТ в апреле 2018 г. показала положительную динамику. Образования, накапливающие контрастное вещество «по кольцу» парасагиттально в правой лобной доле 9 × 6 мм, в медиальных отделах левой теменной доли 28 × 37 мм и конвекситально 7 × 6 мм, в левой височной доле паравентрикулярно 123 × 9 мм. Ранее описываемый очаг в левой лобной доле не определен. Срединные структуры не смещены, желудочковая система обычной формы и размеров (рис. 2).
МРТ головного мозга от 20 июня 2018 г.: в веществе головного мозга визуализируются очаги солидно-кистозной структуры с признаками лечебного воздействия: в левой затылочной области парасагиттально до 2,5 × 1,5 см (ранее до 2,8 × 2,6 см), латеральнее заднего рога левого бокового желудочка до 1 см (без динамики). Желудочковая система обычных размеров и формы, срединные структуры не смещены. Положительная динамика.
ПЭТ-КТ в июне 2018 г.: остаточная опухолевая ткань с низкой метаболической активностью в лимфатических узлах шеи, дальнейшая положительная динамика (по сравнению с результатами предыдущих обследований).
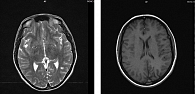
МРТ головного мозга в августе 2018 г.: в веществе головного мозга сохраняются два очага солидно-кистозной структуры с признаками лечебного воздействия – в левой затылочной области 1,7 × 0,8 см, латеральнее заднего рога левого бокового желудочка до 1 см (без динамики). Положительная динамика (рис. 3).
ПЭТ-КТ в августе 2018 г.: на момент обследования данных об активной опухолевой ткани нет – полная ремиссия.
Пациентка продолжает терапию осимертинибом. Лечение переносит хорошо. На текущий момент ВБП достигла восьми месяцев.
Обсуждение
Метастатическое поражение головного мозга (как солидные метастазы, так и канцероматоз мозговых оболочек) развивается у 25–40% пациентов с НМРЛ (у 8–10% пациентов с другими злокачественными новообразованиями). У 20% пациентов изначально диагностируются очаги в головном мозге, еще у 30% больных с первичным неметастатическим НМРЛ очаги в ЦНС возникают при рецидиве или в результате развития резистентности к ИТК [4].
ИТК EGFR первого и второго поколений у пациентов с активирующими мутациями в гене EGFR имеют преимущество перед химиотерапией, но демонстрируют умеренную активность в очагах в ЦНС (таблица) [5–12].
Осимертиниб отличается от других представителей этого класса повышенной активностью в отношении метастатических очагов в ЦНС. В доклинических исследованиях осимертиниб сравнивали с гефитинибом, афатинибом и другими ИТК. Он показал значительное накопление в ЦНС по сравнению с плазмой и другими органами [13].
На момент включения в исследование FLAURA около 20% пациентов имели метастатическое поражение ЦНС. Анализ ВБП в этой подгруппе пациентов показал снижение риска прогрессирования и смерти на 53%, при этом медианы ВБП в группе осимертиниба и стандартной терапии составили соответственно 15,2 (95% ДИ 12,1–24,4) и 9,6 (95% ДИ 7,0–12,4) месяца, ОР – 0,47 (95% ДИ 0,30–0,74), p < 0,0009 [3]. Таким образом, высокая терапевтическая активность препарата подтверждена и в клинических исследованиях.
Интерес к рассмотренному клиническому случаю обусловлен тем, что НМРЛ развился у молодой пациентки (возраст 36 лет) в отсутствие факторов риска. Кроме того, имело место хотя характерное для НМРЛ, но весьма драматическое прогрессирование через год (множественные крупные метастазы в головном мозге и поражение лимфоузлов на шее).
Опираясь на научные данные, а также учитывая молодой возраст пациентки, размер метастазов, необходимость сохранения качества жизни и интеллектуальной активности, в качестве первой линии терапии мы выбрали именно осимертиниб. Мы понимали, что необходимо максимально быстро достичь эффекта, чтобы избежать осложнений, угрожающих жизни. Осимертиниб оправдал наши ожидания. Значительное уменьшение симптомов наблюдалось уже через три дня терапии, уменьшение перифокального отека и смещения срединных структур мозга зафиксировано через месяц терапии.
В настоящее время (спустя восемь месяцев) достигнуто значительное уменьшение размеров очагов в ЦНС и получен полный ответ в лимфоузлах шеи. Наблюдается продолжение нарастания ответа.
Заключение
Осимертиниб – уникальная терапевтическая опция для пациентов с распространенным НМРЛ с мутациями в гене EGFR при наличии метастатических очагов в головном мозге.
D.D. Sakayeva
Republican Oncologic Dispensary, Ufa
Contact person: Dina Damirovna Sakayeva, d_sakaeva@mail.ru
The treatment approaches for advanced non-small cell lung cancer (NSCLC) have been dramatically changed over the past decades. In particular, the target medicines, which effective affect cancer cells with activating mutations, such as EGFR, are in clinical oncological practices. Nowadays, oncologists have TKIs of the first generation (gefitinib and erlotinib), the second generation (afatinib) and since 2017 the newest third generation (osimertinib). In this article we present the case of young women with major central nervous system lesions with successful osimertinib administration in the first line of EGFR + NCSLC therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.