Применение препарата Лейкостим® для мобилизации и сбора гемопоэтических стволовых клеток
- Аннотация
- Статья
- Ссылки
Г-КСФ – гликопротеин с молекулярной массой 18-22 кД, который, взаимодействуя с рецепторами на наружной мембране гемопоэтических клеток гранулоцитарного ростка кроветворения, стимулирует их пролиферацию. Он также регулирует некоторые функции зрелых нейтрофилов, включая хемотаксис, миграцию и образование супероксида.
Г-КСФ – гликопротеин с молекулярной массой 18-22 кД, который, взаимодействуя с рецепторами на наружной мембране гемопоэтических клеток гранулоцитарного ростка кроветворения, стимулирует их пролиферацию. Он также регулирует некоторые функции зрелых нейтрофилов, включая хемотаксис, миграцию и образование супероксида.



Создание рекомбинантных препаратов Г-КСФ позволило активно использовать их для коррекции иммунодефицитных состояний, обусловленных недостаточной продукцией гранулоцитов. Применение препаратов Г-КСФ для профилактики инфекционных осложнений у онкологических больных и ВИЧ-инфицированных пациентов позволяет уменьшать выраженность нейтропении после применения цитостатиков или противовирусных препаратов (3). Кроме того Г-КСФ способствует миграции кроветворных клеток из костного мозга в периферическую кровь. Это позволяет выделять кроветворные клетки из крови, не прибегая к эксфузии костного мозга, что сокращает риск осложнений. Почти 15 лет Г-КСФ является одним из наиболее распространенных ростовых факторов, используемых в трансплантологии для мобилизации клеток-предшественников гемопоэза (CD34+ клеток) (4,5).
Целью нашего исследования была оценка эффективности использования препарата Лейкостим® (филграстим) для мобилизации КПГ.
Задачи исследования
- Определение эффективности препарата, назначаемого в стандартной рекомендуемой дозе.
- Сравнение полученных результатов с данными о применении оригинального препарата Г-КСФ Нейпоген (группа исторического контроля).
Материалы и методы
В настоящее исследование было включено 10 пациентов с солидными и гематологическими новообразованиями, которым на данном этапе лечения планировалось проведение высокодозной химиотерапии с трансплантацией аутологичных КПГ. Средний возраст больных составил 32,9 года (от 18 до 55 лет). Среди этих больных было 2 женщины (20%) и 8 мужчин (80%). Распределение пациентов по нозологиям представлено в таблице 1.
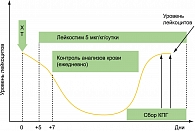
С целью мобилизации и сбора CD34+ клеток периферической крови все пациенты получали подкожно Лейкостим®. Девяти пациентам Лейкостим® назначался после проведения миелосупрессивной химиотерапии. Введение препарата в дозе 5 мкг/кг в сутки начиналось на пятые сутки после последнего введения цитостатиков (рисунок 1).
Использовавшиеся режимы химиотерапии представлены в таблице 2.
При восстановлении гемопоэза после прохождения точки максимального падения содержания лейкоцитов (надира) и достижения уровня лейкоцитов более 3х109 /л мониторировался уровень CD34+ клеток в периферической крови, отражающий содержание КПГ. Сбор КПГ начинался в случае наличия одного из ниже перечисленных условий:
- содержание CD34+ клеток более 10 в 1 мкл периферической крови;
- содержание CD34+ клеток в периферической крови менее 10, но более 5 в 1 мкл на протяжении двух и более дней на фоне продолжающейся стимуляции и роста уровня лейкоцитов.
Сбор проводился ежедневно на фоне продолжающейся стимуляции до получения количества гемопоэтического материала, необходимого для быстрого восстановления кроветворения после проведения высокодозной химиотерапии (не менее 2х106/кг CD34+ клеток на каждую планируемую трансплантацию). Перед каждой процедурой сбора у пациентов, имевших накануне содержание CD34+ клеток в периферической крови менее 5 в мкл, осуществлялось повторное их определение в крови. В случае снижения их уровня стимуляция и сбор прекращались досрочно.
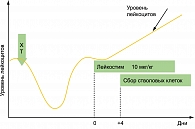
У одного пациента Лейкостим® использовался в фазе стабильного кроветворения (вне периода индуцированной химиотерапией миелосупрессии). Препарат вводился в дозе 10 мкг/кг в сутки (рисунок 2). Этому пациенту стимуляция проводилась после неудачной первой попытки стимуляции и сбора КПГ препаратом Нейпоген.
На 7 день стимуляция была досрочно остановлена в связи с крайне низкой ее результативностью (количество СD34+ клеток в 1 мкл крови менее 1).
Процедура сбора клеток – предшественников гемопоэза
Перед началом сбора осуществлялась катетеризация центральной вены (подключичная, внутренняя яремная или бедренная вена). Катетеризация осуществлялась по методу Сельдингера под местной анестезией. Использовался двухпросветный катетер, обеспечивающий скорость потока крови не менее 50 мл/минуту. Процедура сбора осуществлялась с использованием сепараторов клеток крови фирмы Baxter (CS 3000 Plus или Amicus) (6).
При использовании сепаратора CS 3000 Plus обработке подвергалось 8-12 литров крови пациента, в зависимости от скорости расхода антикоагулянта из штатной системы сепаратора. Поддерживалось соотношение цитрат/кровь 1:10 – 1:11. Для сбора использовались стандартные программы сбора КПГ Special-1 или Special-2. Скорость потока крови составляла от 50 до 60 мл/мин., в зависимости от пропускной способности венозного доступа.
При использовании сепаратора крови Amicus объем обрабатываемой крови также зависел от скорости расхода антикоагулянта из штатной системы, и составлял от 12 до 15 литров. Скорость потока зависела от максимально допустимой скорости инфузии цитрата, автоматически определяемой аппаратом исходя из массы тела пациента.
В период процедуры сепарации пациент находился под наблюдением врача. Регистрировались побочные явления, при необходимости проводились лечебные мероприятия для их купирования.
После окончания процедуры из полученного материала в асептических условиях забирались пробы для анализа на содержание ядросодержащих клеток и CD34+ клеток.
Определение содержания CD34+ клеток в периферической крови и гемопоэтическом материале
Определение содержания КПГ в периферической крови и продукте сепарации осуществлялось методом проточной цитометрии (7). Подсчет клеток, несущих на мембране антиген CD34, проводился на цитометре FACScan (Becton Dickinson, USA).
Введение Лейкостима® у пациентов после цитостатической терапии (n=9) позволило начать сбор КПГ у всех пациентов в сроки от 4 до 10 дней от начала стимуляции, в среднем на 6-й день. Уровень лейкоцитов в периферической крови колебался от 6,7 до 42 тысяч в микролитре (в среднем 18,2 тысячи в микролитре). Процент CD34+ клеток в периферической крови колебался от 0,03% до 0,47% (в среднем 0,09%). Абсолютное число CD34+ клеток в микролитре варьировало от 5 до 31 (в среднем 12,1 в микролитре) (таблицы 2, 3).
Пациентам этой группы было проведено от 2 до 3 сепараций. У 6 пациентов процедуры по сбору КПГ были прекращены в связи с получением достаточного количества гемопоэтического материала (от 2 до 7×106/кг CD34+ клеток), у 3 пациентов – в связи с отсутствием дальнейшего повышения уровня CD34+ клеток в периферической крови.
У пациента, которому проводилась повторная стимуляция после неудачной стимуляции Нейпогеном, введение Лейкостима® в течение 7 дней не привело к достаточному выбросу CD34+ клеток в кровь. Процент CD34+ клеток в периферической крови не повышался более 0,01%. В связи с этим дальнейшая стимуляция была признана нецелесообразной, и введение Лейкостима® было прекращено.
Таким образом, запланированное количество КПГ получено у 60% больных. По нашим данным, применение других препаратов Г-КСФ (Нейпоген, Граноцит) в аналогичной группе пациентов позволяет добиться успеха у 56,6% пациентов, что сопоставимо с результатами, полученными при применении Лейкостима®, хотя и в ограниченном по объему исследовании.
В процессе применения препарата не было выявлено каких-либо серьезных побочных эффектов. Трое пациентов отметили неприятные ощущения (покалывания) в области подкожных инъекций Лейкостима®, продолжавшиеся 15-20 минут после введения. Изменений биохимических параметров крови не отмечено.
Из вышесказанного можно сделать следующие выводы:
- Лейкостим® является эффективным препаратом для мобилизации и сбора клеток – предшественников гемопоэза у онкологических больных;
- отмечена хорошая переносимость препарата Лейкостим®.
В последние годы во всем мире высокодозная химиотерапия с трансплантацией аутологичных КПГ является предпочтительным методом лечения пациентов с неблагоприятным вариантом течения многих злокачественных лимфом и реже – солидных опухолей (8). Принципиальным для проведения данного метода лечения является получение клеток – предшественников кроветворения, позволяющих восстановить гемопоэз после агрессивной цитостатической терапии. Долгие годы эти клетки получали путем эксфузии костного мозга, однако данный метод не является оптимальным ввиду его травматичности, необходимости общего наркоза и малой эффективности при предшествующем облучении тазовой области. Разработка методов мобилизации КПГ из костного мозга в периферическую кровь с помощью Г-КСФ (9) позволила получать КПГ в большем количестве и быстрее восстанавливать кроветворение, снижая риск инфекционных и геморрагических осложнений (10). До последнего времени в нашей стране с этой целью использовались рекомбинантные Г-КСФ зарубежного производства. В настоящее время разработан отечественный препарат человеческого рекомбинантного Г-КСФ Лейкостим® (филграстим). Препарат является аналогом препарата Нейпоген (филграстим) (F.Hoffmann-La Roche Ltd., Швейцария). Как показало наше небольшое исследование, российский аналог обладает сопоставимой эффективностью и низкой токсичностью.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.