Принципы рациональной патогенетической терапии спондилогенных болевых неврологических синдромов шейной и пояснично-крестцовой локализации
- Аннотация
- Статья
- Ссылки
- English
Болевые спондилогенные синдромы шейной и пояснично-крестцовой локализации не просто входят в десятку самых частых хронических заболеваний, но и лидируют в этом списке. Эти страдания преследовали и продолжают преследовать человечество на протяжении всей его истории. Пожалуй, нет того, кто не столкнулся хотя бы раз в жизни с болью в пояснице или шее.
Несмотря на интенсивное многолетнее и всестороннее изучение этой проблемы, патогенез хронической боли в спине до конца не ясен [1]. По мнению большинства исследователей, важную роль в патогенезе играют механические нагрузки, хронические травмы, стресс, поражение околопозвоночных тканей, воспаление и дегенерация межпозвонковых дисков и т.п. Ряд авторов придают значение также генетическим факторам [2].
Было предложено множество способов лечения этой патологии, как лекарственных, так и немедикаментозных, многие из которых эффективно применялись на протяжении столетий, а некоторые не выдержали проверку временем.
Еще во времена отца европейской медицины Гиппократа были разработаны и с успехом использовались методы немедикаментозного лечения этих заболеваний. Пациента фиксировали вниз головой на наклонном деревянном щите под углом в 45º, и после предварительного разогревания горячим паром зоны боли в спине осуществляли скелетное вытяжение с хорошим клиническим эффектом. Кроме того, во времена Гиппократа при боли и лихорадке активно применяли кору и листья ивы, богатые салицином.
К сожалению, в настоящее время не всякая неврологическая клиника может похвастаться тем, что может провести аппаратную тракционную терапию. Значительная часть врачей и пациентов по-прежнему ассоциирует боли в области шеи и нижней части спины с понятием «остеохондроз», опрощая взаимосвязь «грыжа диска – боль». Более того, повсеместное применение методов нейровизуализации, в частности магнитно-резонансной томографии, привело к «механизированию» диагностики. И как следствие пациенты обращаются за медицинской помощью, имея протоколы и снимки магнитно-резонансных томограмм с заключением о дегенеративно-дистрофических изменениях позвоночника, протрузиях и грыжах межпозвонковых дисков.
По мнению D. Anderson и C. Tannoury (2005), в основе хронической люмбалгии лежит дегенерация межпозвонкового диска [3]. Такой же точки зрения придерживается значительная часть исследователей этой проблемы. В действительности, помимо протрузий и грыж межпозвонковых дисков, есть и другие источники хронических болей в спине. Например, паравертебральные мышцы, в которых в результате длительных и нефизиологичных статических нагрузок формируются так называемые болезненные мышечные уплотнения, или миофиброзы, – узелки Мюллера, Корнелиуса и Шаде. Еще один возможный источник боли – дугоотростчатые (фасеточные), крестцово-подвздошные и тазобедренные суставы, при развитии в которых признаков асептического воспаления нарушается двигательный стереотип человека. При этом, по мнению Н.М. Жулева и соавт. (1992, 2013), так называемые некорешковые проявления дегенеративно-дистрофического поражения позвоночника встречаются гораздо чаще, чем классические корешковые [4, 5]. В этих случаях нередко приходится выполнять дифференциальную диагностику и с иными патологическими состояниями, например системными воспалительными поражениями опорно-двигательного аппарата, висцеральными болями, психогениями, онкологическими заболеваниями.
Таким образом, при всем многообразии этиологических теорий и патогенетических концепций хронической боли в спине решать вопрос о рациональной патогенетической терапии следует только после тщательного анализа всей совокупности клинических признаков болезни и результатов дополнительных лабораторных и инструментальных исследований. Придерживаясь классического принципа петербургской школы неврологии Clinica prima, вначале необходимо сфокусировать внимание на вопросе «вертеброгенности» болевого синдрома, учитывая возраст пациента, его пол, род занятий, профессиональные и бытовые вредности и нагрузки и т.п. Затем следует обратить внимание на позу больного, особенности статики и динамики позвоночника, походку. При этом простейший нейроортопедический осмотр может стать существенным подспорьем в дифференциации спондилогенных и артрогенных болей или их сочетания. Далее при традиционном клинико-неврологическом осмотре необходимо изучить степень выраженности и характер симптомов раздражения, натяжения или выпадения спинномозговых корешков. Увеличение интенсивности боли, парестезии и формикации в ночные или утренние часы, трудности при вставании с постели могут свидетельствовать о наличии венозного застоя и отеке нервного корешка.
Клинический опыт показывает, что практические врачи, как правило, в повседневной работе не уделяют достаточного внимания исследованию корешковых симптомов, в лучшем случае изучая степень выраженности симптома Ласега или Вассермана. При поражении корешков шейной локализации редкий специалист знает, как оценить симптомы натяжения Спурлинга, Сковилля, компрессионную пробу Берчи. В действительности корешковых симптомов известно свыше 70 [6]. Они различаются по топике патологического процесса и патофизиологическим особенностям возникновения и исследования и могут быть разделены на четыре основные группы (компрессионные, ирритативные, ликвородинамические и позные). Здесь уместно процитировать классика отечественной клинической неврологии профессора М.И. Аствацатурова, написавшего в 1929 г. выдающуюся работу «Ошибки в диагностике и терапии нервных болезней». По мнению М.И. Аствацатурова, беда большинства врачей не в том, что они недостаточно знают, а в том, что недостаточно видят, а на одну ошибку вследствие незнания приходится десять ошибок по «недосмотру» больного.
После всестороннего клинического осмотра и изучения лабораторных показателей (исключения признаков системного воспаления) необходимо проанализировать результаты нейровизуализационных исследований. При этом не ограничиваться просто чтением протокола спондилограмм, компьютерных или магнитно-резонансных томограмм, а самостоятельно изучить выполненные снимки и соотнести увиденное с результатами клинического осмотра. Так, определение грыжи или протрузии межпозвонкового диска можно сопоставить с уровнем и особенностями корешковой симптоматики, выраженностью мышечно-тонических нарушений.
А.Б. Данилов и Н.В. Григоренко (2016) полагают, что даже при интактном внешнем контуре диска множество процессов (дегенерация, повреждение концевой пластинки, воспаление и т.п.) могут способствовать возбуждению болевых рецепторов непосредственно внутри диска, приводя к развитию болевого синдрома без корешковой симптоматики [7]. Пациенты могут испытывать ноющие боли различной интенсивности, чаще на уровне пораженного позвонка, усиливающиеся при перкуссии остистого отростка. Следует учесть, что подобная клиническая картина может наблюдаться и при разрушении дужки или тела позвонка онкологической природы, как при описанном И.Я. Раздольским «симптоме звонка».
Чрезмерные нагрузки вкупе с генетической предрасположенностью вызывают дегидратацию пульпозного ядра, сопровождаясь микротрещинами и разрывами фиброзного кольца диска. По мере прогрессирования дегенеративного процесса клетки диска способны генерировать воспалительную реакцию, высвобождая большое количество провоспалительных цитокинов. В ряде исследований приводятся данные о более высоких уровнях интерлейкинов 1, 6 и 8 у пациентов с дискогенной болью в спине по сравнению с пациентами с грыжей межпозвонкового диска [8].
Есть мнение, что медиаторы воспаления, распространяющиеся в область наружной части фиброзного кольца и замыкательной хрящевой пластинки, стимулируют болевые рецепторы и вызывают мощный поток афферентной болевой импульсации. Следовательно, для возникновения спондилогенной боли требуется два условия – воспалительный процесс и свободные нервные окончания.
Большинство авторов подчеркивают, что одним из ключевых механизмов, индуцирующих хронические боли цервикальной или пояснично-крестцовой локализации, является экспрессия интерлейкина 1-бета, стимулирующая синтез циклооксигеназы (ЦОГ) 2, интерлейкина 6, фактора некроза опухоли альфа, а также металлопротеиназ и ADAM-протеазы, вызывающих ускоренное разрушение диска.
Существующие подходы к терапии можно условно разделить на несколько этапов. Прежде всего это поиск доступных методов купирования острой боли, пока не сложились условия для ее перехода в хроническую, приобретающую характер невропатической и требующую гораздо больше усилий для лечения. Острые боли, наподобие цервикаго или люмбаго, как правило, хорошо купируются обезболивающими препаратами, миорелаксантами, противоотечными средствами, а также немедикаментозными воздействиями (физиотерапией, массажем, элементами постизометрической миорелаксации, корсетированием и т.п.). При наличии показаний и отсутствии противопоказаний хорошо себя зарекомендовали лечебно-медикаментозные блокады с использованием обезболивающих и противовоспалительных смесей. Пациентам с интенсивными болями в сочетании с симптомами натяжения и выпадения функций спинномозговых корешков (радикулопатии) в соответствии с действующими в России стандартами оказания помощи показаны:
- консультации врачей-специалистов, в том числе невролога, нейрохирурга, специалиста по лечебной физкультуре, мануального терапевта, врача-терапевта, уролога и рефлексотерапевта;
- полный спектр лабораторных исследований;
- магнитно-резонансная томография, электронейромиография, электрокардиография, рентгенография позвоночника и костей таза, в ряде случаев миелография и сцинтиграфия костей.
Немедикаментозное воздействие предполагает чрескожную электронейростимуляцию, магнитотерапию, воздействие синусоидальными модулированными токами, сантиметроволновую терапию, индуктотермию, гидрокинезиотерапию, грязелечение, радоновые ванны и рефлексотерапию, а также массаж и лечебную физкультуру.
Предписанное стандартами медикаментозное лечение подразумевает назначение витаминов группы В, сульфонамидов, производных пурина, глюкокортикостероидов, производных уксусной кислоты, оксикамов, пропионатов, коксибов, миорелаксантов, прокаина, иногда трамадола и целого ряда средств из группы антиконвульсантов и антидепрессантов.
Таким образом, оптимальная лечебная тактика при болевых синдромах шейной и пояснично-крестцовой локализации предусматривает этап клинико-неврологической, нейроортопедической и нейровизуализационной оценки «вертеброгенности» болевого синдрома с определением ведущего звена патогенеза. Чаще всего приходится выполнять исследовательскую часть параллельно с купированием боли. В этом направлении хорошо зарекомендовали себя нестероидные противовоспалительные препараты, которых, по приблизительным подсчетам, на территории Российской Федерации зарегистрировано около 100. Они подразделяются на три группы в зависимости от тропности к ЦОГ-1 и ЦОГ-2. Первая группа – неселективные ингибиторы ЦОГ-2 (диклофенак, ибупрофен, индометацин, кетопрофен, кеторолак, лорноксикам, напроксен, пироксикам). Вторая группа – селективные ингибиторы ЦОГ-2 (коксибы (рофекоксиб, целекоксиб, эторикоксиб), а также мелоксикам, нимесулид и этодолак). Третья группа – селективные ингибиторы ЦОГ-1 (низкие дозы ацетилсалициловой кислоты).
К сожалению, ни один из нестероидных противовоспалительных препаратов не свободен от побочных эффектов, к которым относятся гастротоксическое, ульцерогенное действие, увеличение склонности к кровотечениям, нежелательным сердечно-сосудистым реакциям. В последние годы появились сведения о том, что оксикамы – сильнодействующие ингибиторы микросомальной простагландин E2 синтетазы 1, осуществляющей конечный синтез основного медиатора воспаления простагландина E2. Эти данные открывают перспективы к созданию нового класса селективных ингибиторов простагландина E2. Макрофаги выделяют ангиотензин-конвертазу, которая инактивирует брадикинин, превращает ангиотензин 1 в ангиотензин 2. Они синтезируют простагландин E2, что препятствует высвобождению клеточных медиаторов воспаления и подавляет агрегацию тромбоцитов. Кроме того, макрофаги, помимо провоспалительных, обладают и противовоспалительными свойствами. Они синтезируют различные компоненты комплемента, обладают свертывающей и фибринолитической активностью.
Следует отметить, что нестероидные противовоспалительные препараты отличаются силой обезболивающего и противовоспалительного действия и периодом полувыведения. Кроме того, препараты различаются по влиянию на метаболизм хрящевой ткани. Условно можно выделить три группы: хондронегативные, нейтральные по отношению к хрящевой ткани и хондропротективные. Хондронегативным действием характеризуются индометацин, пироксикам и напроксен, чуть лучше в этом отношении диклофенак, ибупрофен и нимесулид. К хондропротективным препаратам относятся мелоксикам (Мовалис), ацеклофенак и кетопрофен. Хондротропное влияние Мовалиса обусловлено его биологическими эффектами [9]:
- анаболическим действием;
- ингибированием интерлейкинов 1-бета, 6, фактора некроза опухоли альфа;
- экспрессией факторов роста, включая трансформирующий фактор роста 1;
- подавлением высвобождения лизосомальных ферментов;
- торможением апоптоза хондроцитов;
- стимуляцией синтеза протеогликанов и гиалуроновой кислоты.
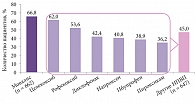
Клинический опыт показывает, что мелоксикам (Мовалис) – один из наиболее надежных препаратов, обладающих высокой эффективностью и безопасностью. С момента выхода на фармацевтический рынок России в 1996 г. он не раз демонстрировал обезболивающее и противовоспалительное действие как при острых, так и при хронических спондилогенных болях. Эффективность и безопасность данного средства подтверждена в многочисленных многоцентровых исследованиях. Так, исследование IMPROVE (n = 1323) показало клинические преимущества препарата Мовалис перед другими нестероидными противовоспалительными препаратами при лечении остеоартрита. Частота успешного завершения исследования без переключения на другой препарат в группе Мовалиса составила 66,8%, а у других нестероидных противовоспалительных препаратов – в среднем 45% (рис. 1) [10].
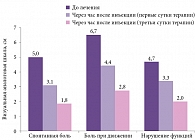
В.В. Алексеев (2012) оценивал выраженность болевого синдрома в динамике под воздействием инъекционной формы Мовалиса. Представленные результаты исследования показали достаточную эффективность инъекционной формы ингибитора ЦОГ-2 Мовалиса, закрепленную последующим пероральным применением препарата, который оказался эффективным и безопасным в комплексной терапии болей в спине, обусловленных мышечно-тоническим, миофасциальным синдромом или компрессионной радикулопатией (рис. 2) [11].
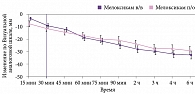
У практических врачей бытует представление, что для купирования острых спондилогенных болей предпочтительнее использовать инъекционные лекарственные формы. Тем не менее ряд работ свидетельствуют о том, что обезболивающий эффект Мовалиса развивается и при пероральном приеме препарата. Согласно клиническому исследованию мелоксикама (n = 113), статистически значимое развитие эффекта (снижение интенсивности боли по Визуальной аналоговой шкале) происходит через 30 минут после применения препарата как при пероральном, так и при внутримышечном введении (рис. 3) [12].
Таким образом, в комплексной патогенетически обоснованной терапии спондилогенных болевых синдромов шейной и пояснично-крестцовой локализации наилучший результат достигается с помощью нестероидных противовоспалительных препаратов, избирательно ингибирующих ЦОГ-2, и в частности мелоксикама. Тем не менее пациенты нередко используют дженерики, рассчитывая получить такой же эффект, как при использовании оригинального препарата. Наш клинический опыт показывает, что такие ожидания чаще всего напрасны, а эффективность и безопасность дженериков на поверку существенно ниже.
Проблема рациональной патогенетической терапии спондилогенных болевых синдромов шейной и пояснично-крестцовой локализации представляется весьма сложной и многоступенчатой. Следует выбирать препараты с максимальной противоболевой активностью и минимумом побочных эффектов. В этом отношении можно рекомендовать использовать Мовалис как в инъекционной, так и в таблетированной форме.
S.V. Lobzin
North-Western State Medical University named after I.I. Mechnikov, Saint Petersburg
Contact person: Sergey Vladimirovich Lobzin, slobzin58@mail.ru
The article contains discussion of modern approaches to the diagnostic and treatment of various cervical and lumbosacral pain syndromes. Discusses main reasons of these conditions, its diagnostic and nonsurgical treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.