Рекомпенсация пациентов с терминальными заболеваниями печени – трудная, но реально достижимая цель терапии
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведено проспективное исследование по типу «случай – контроль». В когорту «случай» вошли 24 взрослых пациента с декомпенсированными заболеваниями печени различной этиологии, включенных в лист ожидания трансплантации печени и впоследствии выбывших из него в связи с рекомпенсацией ЦП. Когорту «контроль» составил 71 пациент с декомпенсированными заболеваниями печени, включенный в лист ожидания в тот же период времени, и развившейся впоследствии субкомпенсацией ЦП.
Результаты. Для определения независимых предикторов делистинга вследствие рекомпенсации ЦП использовалась логистическая регрессионная модель. Значимым предиктором рекомпенсации ЦП стал уровень лейкоцитов крови при включении пациентов в лист ожидания (р = 0,005). Предсказательная ценность выявленного предиктора была подтверждена с помощью ROC-анализа (Receiver Operating Characteristic). Площадь под ROC-кривой (Area Under Curve) для уровня лейкоцитов в крови оказалась равной 0,805 (95%-ный доверительной интервал (ДИ) 0,711–0,898, p < 0,001). Отношение шансов для исхода рекомпенсации при условии, что содержание лейкоцитов при включении в лист ожидания ≥ 3,1 × 109/л, оказалось равным 1,745 (95% ДИ 1,391–2,188). На фоне терапии отмечались значимое увеличение уровней тромбоцитов и лейкоцитов крови, снижение щелочной фосфатазы, билирубина, международного нормализованного отношения (МНО), показателей по шкалам MELD и Чайлда – Пью у больных с рекомпенсацией ЦП.
Заключение. Как показали результаты исследования, рекомпенсация ЦП возможна после прекращения действия факторов, вызывающих его декомпенсацию. Независимым предиктором развития рекомпенсации ЦП и последующего делистинга оказался уровень лейкоцитов крови ≥ 3,1 × 109/л на момент включения пациентов в лист ожидания трансплантации печени. Комбинированная терапия обусловила значимое снижение индексов по шкалам MELD и Чайлда – Пью, увеличение количества тромбоцитов и лейкоцитов крови, снижение показателей билирубина, щелочной фосфатазы, МНО у больных с рекомпенсацией ЦП.
Материал и методы. Проведено проспективное исследование по типу «случай – контроль». В когорту «случай» вошли 24 взрослых пациента с декомпенсированными заболеваниями печени различной этиологии, включенных в лист ожидания трансплантации печени и впоследствии выбывших из него в связи с рекомпенсацией ЦП. Когорту «контроль» составил 71 пациент с декомпенсированными заболеваниями печени, включенный в лист ожидания в тот же период времени, и развившейся впоследствии субкомпенсацией ЦП.
Результаты. Для определения независимых предикторов делистинга вследствие рекомпенсации ЦП использовалась логистическая регрессионная модель. Значимым предиктором рекомпенсации ЦП стал уровень лейкоцитов крови при включении пациентов в лист ожидания (р = 0,005). Предсказательная ценность выявленного предиктора была подтверждена с помощью ROC-анализа (Receiver Operating Characteristic). Площадь под ROC-кривой (Area Under Curve) для уровня лейкоцитов в крови оказалась равной 0,805 (95%-ный доверительной интервал (ДИ) 0,711–0,898, p < 0,001). Отношение шансов для исхода рекомпенсации при условии, что содержание лейкоцитов при включении в лист ожидания ≥ 3,1 × 109/л, оказалось равным 1,745 (95% ДИ 1,391–2,188). На фоне терапии отмечались значимое увеличение уровней тромбоцитов и лейкоцитов крови, снижение щелочной фосфатазы, билирубина, международного нормализованного отношения (МНО), показателей по шкалам MELD и Чайлда – Пью у больных с рекомпенсацией ЦП.
Заключение. Как показали результаты исследования, рекомпенсация ЦП возможна после прекращения действия факторов, вызывающих его декомпенсацию. Независимым предиктором развития рекомпенсации ЦП и последующего делистинга оказался уровень лейкоцитов крови ≥ 3,1 × 109/л на момент включения пациентов в лист ожидания трансплантации печени. Комбинированная терапия обусловила значимое снижение индексов по шкалам MELD и Чайлда – Пью, увеличение количества тромбоцитов и лейкоцитов крови, снижение показателей билирубина, щелочной фосфатазы, МНО у больных с рекомпенсацией ЦП.


Введение
Прогрессирование хронических заболеваний печени независимо от их этиологии способствует развитию печеночной декомпенсации – маркера начала терминальной стадии, ассоциируемой с клиническими синдромами цирроза печени (ЦП): асцитом, печеночной энцефалопатией (ПЭ), кровотечениями из варикозных узлов пищевода или желудка, печеночно-клеточной недостаточностью, гепаторенальным синдромом (ГРС), нарушениями гемостаза и др. [1]. Декомпенсация существенно снижает выживаемость пациентов [2, 3], является причиной госпитализации и/или увеличения показателя смертности до 50% в течение пяти лет [4]. В случае развития асцита одногодичная смертность достигает 15%, а в случае присоединения гипонатриемии, ГРС и спонтанного бактериального перитонита – 60% [5, 6]. Смертность также увеличивается с присоединением явной ПЭ [7] и кровотечений из варикозных узлов пищевода и/или желудка [8].
Трансплантация печени (ТП) – единственный надежный способ спасти больных с терминальной стадией заболеваний печени и повысить их выживаемость. По данным Европейского регистра трансплантаций печени (European Liver Transplant Registry), после проведения ТП одногодичная выживаемость достигает 90%, пятилетняя – 80% [9]. Повсеместно в разных странах сдерживающим фактором развития ТП является дефицит донорского органа. Как следствие – декомпенсация пациентов, находящихся в листе ожидания (ЛО) трансплантации, и увеличение смертности [10].
Тем не менее данные разных исследователей свидетельствуют о значительном улучшении функции печени у части пациентов, даже включенных в ЛО [11]. Как в таком случае определить новое состояние пациента: рекомпенсация, избежание дополнительных осложнений ЦП, состояние отложенной трансплантации? Эти термины остаются предметом дискуссии, равно как и сроки наблюдения за пациентами с улучшением функции печени – 3, 6 или более 12 месяцев в целях окончательного принятия решения о стабилизации состояния [12].
По мнению A.D. Aravinthan и соавт. [13], рекомпенсация ЦП является клиническим диагнозом, характеризующимся отсутствием асцита, или печеночного гидроторакса, или периферических отеков, несмотря на прекращение приема диуретиков, а также отсутствием признаков ПЭ без профилактического приема препаратов. Важным критерием рекомпенсации считается снижение индекса MELD (Model for End Stage Liver Diseases) с достижением целевого значения 15 и менее пунктов. Авторы рекомендуют наблюдать за всеми пациентами с клиническим диагнозом «рекомпенсация» как минимум в течение шести месяцев для подтверждения диагноза устойчивой рекомпенсации. В последнем случае учитывается мнение как минимум двух гепатологов для принятия решения – перманентного исключения пациента из ЛО (делистинг) ТП [13].
Целью настоящего исследования стала оценка возможности терапии больных с декомпенсированными ЦП различной этиологии.
Материал и методы
Нами проведен ретроспективный анализ результатов терапии 151 пациента с декомпенсированным циррозом, включенного в ЛО ТП Центра хирургии и координации донорства Ростовской областной клинической больницы в период с 2015 по 2019 г. Данный вид анализа был одобрен Этическим комитетом при Ростовской областной клинической больнице.
Критерии включения больных в ЛО ТП: безуспешность предшествующей терапии, развитие асцита или печеночного гидроторакса, периферических отеков, анамнестические указания на перенесенный спонтанный бактериальный перитонит, проявления которого были купированы назначением антибиотиков, ГРС, наличие ПЭ, наличие варикозных кровотечений, желудочно-кишечных кровотечений, индекс MELD ≥ 16.
Дополнительные критерии: абстиненция у больных с алкогольной болезнью печени (АБП) как минимум в течение трех месяцев, подтвержденная заключениями наркологов и психиатров.
Критерии исключения: выраженная легочно-сердечная патология, продолжение приема алкоголя на момент исследования, наличие гепатоцеллюлярной карциномы, острой печеночной недостаточности, поликистоза печени, амилоидоза.
Дополнительные критерии исключения: распространенный тромбоз воротной вены и ее магистральных притоков, синдром Бадда – Хиари, синдром синусоидальной обструкции, рецидивирующий холангит при первичном склерозирующем холангите (ПСХ), пациенты, включенные в ЛО для ретрансплантации или с предшествующей трансплантацией других органов.
Исследование проводилось в двух когортах больных по типу «случай – контроль». Когорту «случай» составили 24 взрослых пациента с декомпенсированными заболеваниями печени различной этиологии, включенных в ЛО и впоследствии выбывших из него (делистинг). Основанием для делистинга послужило устойчивое состояние стабильности пациентов, удовлетворяющее критериям рекомпенсации (отсутствие асцита, печеночного гидроторакса, периферических отеков, несмотря на прекращение приема диуретиков, отсутствие ПЭ и необходимости ее профилактической терапии, снижение индекса MELD < 15) [13]. Когорту «контроль» составил 71 пациент с декомпенсированными заболеваниями печени. У этих больных в результате терапии развилась субкомпенсация функции печени, они продолжают получать патогенетическую терапию в настоящее время.
Больным когорт «случай» и «контроль» на момент включения в ЛО проводили скрининг и диагностику инфекции, вызванной вирусом гепатита B (Hepatitis B Virus – HBV) и гепатита C (HCV), эластографию, части больных – биопсию печени и анализ асцитической жидкости. Перед включением в ЛО, а также в динамике проводимого лечения выполнялись клинические исследования крови и мочи, биохимические анализы, исследования параметров гемостаза, рассчитывались оригинальный и усовершенствованный индексы: MELD [14] и MELD-Na [15], индекс ПЭ (The West Haven Criteria) [16], индекс коморбидности Чарлсона (Charlson) [17].
При HCV-ассоциированном ЦП пациентам обеих когорт назначали противовирусную терапию препаратами прямого противовирусного действия (комбинация софосбувира, даклатасвира и рибавирина) в течение 12 недель. При наличии противопоказаний к применению рибавирина продолжительность терапии софосбувиром/даклатасвиром составила 24 недели. Контроль элиминации вируса подтверждался устойчивым вирусологическим ответом.
У больных с HBV-ассоциированным ЦП терапия включала назначение нуклеозидных аналогов (энтекавира, тенофовира). Вирусологический ответ регистрировали в отсутствие ДНК HBV в крови c помощью высокочувствительной ПЦР-диагностики.
Пациенты с аутоиммунными заболеваниями печени в качестве патогенетической терапии получали урсодезоксихолевую кислоту, иммуносупрессанты (азатиоприн), глюкокортикостероиды (метилпреднизолон).
Пациентам обеих когорт проводили патогенетическую терапию неселективными бета-блокаторами (карведилол), мочегонными средствами. Для купирования проявлений явной ПЭ использовали комбинацию рифаксимина, лактулозы (перорально) в сочетании с внутривенными введениями L-орнитина-L-аспартата. У ряда пациентов применялись методики экстракорпоральной геморрекции, предполагавшие плазмасорбцию и продленную вено-венозную гемодиафильтрацию.
В целях профилактики рецидива кровотечений из варикозных узлов желудка и пищевода часть пациентов подверглась оперативному лечению: наложению TIPS (трансъюгулярное портосистемное шунтирование) и азигопортальному разобщению по оригинальной методике [18].
Все демографические, клинические и лабораторные данные для последующего статистического анализа были получены из непрерывно обновляющейся электронной базы данных Центра хирургии и координации донорства Ростовской областной клинической больницы.
Статистический анализ данных проведен с использованием программы IBM SPSS Statistics, версия 21. Для проверки нормальности распределения полученных данных использовали критерий Колмогорова – Смирнова. Данные выборок с нормальным распределением представлены средней арифметической величиной (М) и стандартным отклонением (SD, standard deviation) с определением 95%-ного доверительного интервала (ДИ). Статистическую значимость различий между сравниваемыми параметрами при нормальном распределении оценивали по t-критерию Стьюдента. В отсутствие нормального распределения данных применяли непараметрические критерии: Уилкоксона – для парных сравнений зависимых переменных, Манна – Уитни (U-критерий), хи-квадрат Пирсона – для сравнения независимых переменных. Количественные показатели в выборках с распределением, отличным от нормального, представлены в виде медианы и интерквартильного размаха (интервал между 25-м и 75-м процентилями). Для качественных данных рассчитывали частоты и доли (%). Различия между сравниваемыми параметрами считали статистически значимыми при вероятности ошибки менее 0,05 (p < 0,05).
Результаты
Характеристика пациентов группы «случай» (рекомпенсация)
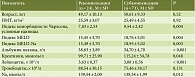
Группу пациентов с рекомпенсацией составили 11 (45,83%) мужчин и 13 (54,17%) женщин. Средний возраст на момент включения в ЛО составил 49,2 ± 10,7 года, индекс массы тела (ИМТ) – 25,6 ± 5,1 кг/м2. Среднее пребывание в ЛО – 33 ± 14 дня. Индекс MELD-Na на момент включения больных в ЛО в 83,33% случаев был менее 20 пунктов, в 4,17% случаев – 20 пунктов, в 12,50% случаев – от 21 до 30 пунктов. ГРС диагностирован у 16,65% пациентов. Диагноз явной ПЭ установлен в 79,17%, скрытой ПЭ – в 20,83% случаев. По этиологии больные с терминальной стадией заболевания печени распределились следующим образом: ЦП в исходе хронического гепатита C – 10 (41,67%) пациентов, ЦП в исходе АБП – 5 (20,83%), первичный билиарный цирроз (ПБЦ) – 2 (8,33%), перекрест ПБЦ и аутоиммунного гепатита (АИГ) – 1 (4,17%), криптогенный ЦП – 4 (16,67%) пациента. У 16 (66,67%) больных ЦП установлен класс С, у 7 (29,17) – класс В, у 1 (4,17%) – класс А по шкале Чайлда – Пью. Индекс коморбидности Чарлсона – 7,8 ± 2,6 пункта.
В 54,2% случаев больным этой группы назначали этиологическую терапию, в 83,3% случаев – неселективные бета-адреноблокаторы, в 100% случаев пациенты получали мочегонные средства и терапию ПЭ (внутривенные введения L-орнитина-L-аспартата в комбинации с пероральным приемом лактулозы и рифаксимина). В дополнение к медикаментозной терапии проведено азигопортальное разобщение по оригинальной методике – 33,3% случаев, однократное эндоскопическое лигирование вен пищевода – 12,5%, экстракорпоральная гемокоррекция (комбинация методов плазмасорбции и продленной вено-венозной гемодиафильтрации) – 12,5% случаев.
Характеристика больных группы «контроль» (субкомпенсация)
Группу пациентов с субкомпенсацией (находящихся в ЛО) составили 31 (43,7%) мужчина и 40 (56,3%) женщин. Средний возраст на момент включения в ЛО – 50,1 ± 10,7 года, ИМТ – 25,5 ± 4,5 кг/м2. Среднее пребывание в ЛО – 19 ± 14 месяцев. Индекс MELD-Na на момент включения больных в ЛО в 56,34% случаев был менее 20 баллов, в 29,58% случаев равнялся от 20 до 24 баллов, в 14,08% случаев – от 25 до 31 баллов. ГРС диагностирован у 40,85% пациентов. Диагноз явной ПЭ установлен в 90,14%, скрытой ПЭ – в 9,86% случаев.
По этиологии больные этой группы распределились следующим образом: ЦП в исходе вирусных гепатитов – 35 (49,30%) пациентов. Из этой когорты у 28 пациентов имела место моно-HCV-инфекция, у одного пациента – микст-инфекция (HCV + HBV + HDV), у одного – микст-инфекция (HBV + HDV), у одного пациента с ЦП в исходе HCV + АИГ и у одного пациента с ЦП в исходе HCV + ПБЦ. У трех пациентов диагностирован цирроз печени в исходе микст-инфекции (HBV + HDV), ЦП в исходе АБП – у 13 (18,31%) пациентов, ПБЦ – у 9 (12,68%), перекрест ПБЦ и АИГ – у 8 (11,27%), криптогенный ЦП – у 2 (2,82%) пациентов. 4 (5,64%) пациента имели ЦП в исходе болезни Кароли, ПСХ, АИГ. У 59 (83,10%) больных ЦП установлен класс C, у 10 (14,09%) – класс B, у 1 (2,82%) – класс А по шкале Чайлда – Пью. Индекс коморбидности Чарлсона составил 9,5 ± 2,6 пункта. В 53,52% случаев больным этой группы назначали этиологическую терапию, в 92,86% случаев – неселективные бета-адреноблокаторы, в 100% случаев пациенты получали мочегонные средства и терапию ПЭ (внутривенные введения L-орнитина-L-аспартата в комбинации с пероральным приемом лактулозы и рифаксимина), компоненты крови. В дополнение к медикаментозной терапии проведено азигопортальное разобщение по оригинальной методике в 8,45% случаев, однократное эндоскопическое лигирование вен пищевода – в 5,64%, TIPS – в 2,82% случаев. Лапароцентез выполнен 9,86% больных, экстракорпоральная гемокоррекция (комбинация методов плазмасорбции, плазмообмена, плазмасепарации, продленной вено-венозной гемодиафильтрации) – 6,06% .
Сравнение показателей в группах «случай» и «контроль»
При проверке распределения полученных данных с использованием критерия Колмогорова – Смирнова нормальному распределению соответствовали показатели возраста пациентов, содержания лейкоцитов и тромбоцитов на момент включения в ЛО, концентраций альбумина, креатинина, Na, индексы MELD, MELD-Na, ИМТ, Чарлсона, которые анализировались с помощью параметрической статистики. Все остальные показатели (степень ПЭ, активность щелочной фосфатазы, билирубина и международное нормализованное отношение (МНО) на момент включения в ЛО, индекс по шкале Чайлда – Пью) не соответствовали нормальному распределению. Для их анализа использовали непараметрические методы статистики (критерий Манна – Уитни – U-критерий, хи-квадрат).
В таблицах 1 и 2 представлены демографические, клинические, лабораторные показатели, индексы (ИМТ, коморбидности) в группах больных с рекомпенсацией (n = 24) и субкомпенсацией ЦП (n = 71).
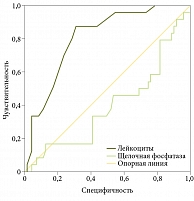
Показатели пациентов с исходами (рекомпенсация/субкомпенсация) были подвергнуты регрессионному анализу (логистическая регрессия). Значимыми предикторами рекомпенсации ЦП стали уровни лейкоцитов крови и щелочной фосфатазы при включении пациентов в ЛО (р = 0,005 и р = 0,045 соответственно).
Площадь под кривой AUC (Area Under Curve) была рассчитана для показателей концентрации количества лейкоцитов и щелочной фосфатазы при включении пациентов в ЛО. Для этих показателей построены кривые ROC (рис. 1). AUC ROC для концентрации щелочной фосфатазы оказалась равной 0,396 (95% ДИ 0,262–0,530; p = 0,128), AUC ROC для уровня лейкоцитов – 0,805 (95% ДИ 0,711–0, 898; p < 0,001).
В силу того что концентрация щелочной фосфатазы, по результатам ROC-анализа, не является достоверным предиктором (AUC ROC = 0,396; 95% ДИ 0,262–0,530; p = 0,128), в данной модели логистической регрессии было рассчитано отношение шансов (ОШ) для уровня лейкоцитов.
ОШ для исхода рекомпенсации ЦП с последующим делистингом при условии, что концентрация лейкоцитов при включении в ЛО ≥ 3,1 × 109/л, оказалось равным 1,745 (95% ДИ 1,391–2,188).
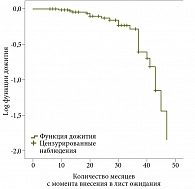
Проведен анализ развития рекомпенсации ЦП методом Каплана – Мейера. Функция дожития по созданной модели отождествлялась с развитием рекомпенсации ЦП в определенный срок для конкретных пациентов (рис. 2). На рис. 2 показано время ожидания развития рекомпенсации ЦП (период от включения больных в ЛО до развития рекомпенсации ЦП и делистинга).
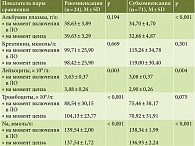
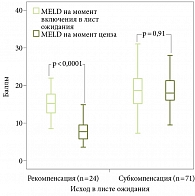
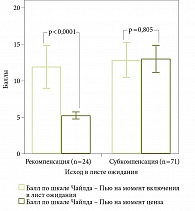
Мы сравнили основные показатели функции печени и индексов в динамике проведенной терапии (сравнение данных на момент включения в ЛО и данных на момент ценза). В таблице 3 отражена динамика показателей с нормальным распределением, а в табл. 4 – динамика показателей, отличавшихся от нормального распределения. На рис. 3 показана динамика показателя MELD-Na, на рис. 4 – динамика показателя по шкале Чайлда – Пью.
Обсуждение
В группе больных с развившейся рекомпенсацией ЦП на момент включения в ЛО уровни лейкоцитов, альбумина в плазме крови, Na в крови оказались значимо выше, чем в группе больных с субкомпенсацией ЦП. Показатели МНО, щелочной фосфатазы, креатинина, билирубина, индексы MELD и MELD-Na, индекс коморбидности Чарлсона в группе пациентов с рекомпенсацией ЦП на момент включения в ЛО также были значимо ниже аналогичных показателей в группе больных с субкомпенсацией ЦП.
Безусловно, развитие рекомпенсации ЦП у пациентов с декомпенсацией функции печени в нашем исследовании обусловлено эффективностью комбинированной терапии. В этой группе примерно у 40% пациентов ЦП был ассоциирован с прогрессированием фиброза, вызванного HCV-инфекцией. Элиминация HCV у пациентов с декомпенсированным ЦП и портальной гипертензией позволила снизить уровень фиброза и портальной гипертензии [19–22], значимо уменьшить градиент печеночного венозного давления [21, 22].
В 2016 г. L.S. Belli и соавт. [23] продемонстрировали возможность делистинга в 19,2% случаев вследствие развития рекомпенсации ЦП у больных, включенных в ЛО ТП. Авторы многоцентрового европейского исследования пришли к выводу о несомненной пользе эрадикации HCV у больных с декомпенсированным ЦП до проведения ТП. Обусловливая рекомпенсацию и делистинг, эрадикация позволяет значимо снизить количество ТП, что немаловажно в условиях дефицита органа и высокой распространенности HCV-ассоциированных заболеваний печени [23].
В недавнем исследовании, проведенном в Великобритании, у 39 пациентов с декомпенсацией ЦП терапия прямыми противовирусными средствами (омбитасвир/паритапревир/дасабувир плюс рибавирин) обеспечила высокий уровень достижения устойчивого вирусологического ответа (91% случаев) и развитие рекомпенсации (51% случаев) [24].
Следует подчеркнуть, что достижение рекомпенсации ЦП не отменяет динамичное наблюдение за пациентами, поскольку в ряде случаев не исключены прогрессирование ЦП и повторное включение пациентов в ЛО ТП. Так, в исследовании G. Perricone и соавт. успешная противовирусная терапия HCV-ассоциированного декомпенсированного ЦП приводила к рекомпенсации с последующим делистингом в 30,9% случаев. Однако через два года после делистинга у одного из пациентов развилась ГЦК, а у трех – асцит, что предопределило повторное включение в ЛО – релистинг [25].
У больных с HBV-инфекцией продемонстрирован высокий потенциал для рекомпенсации ЦП (примерно в трети случаев) после успешного ответа на противовирусную терапию нуклеозидами [26].
В нашем исследовании декомпенсированный ЦП в 20% случаев ассоциировался с прогрессированием АБП.
В исследовании A.D. Aravinthan и соавт. [13] рекомпенсация ЦП с последующим делистингом имела место у 77 пациентов – кандидатов на ТП, получавших комбинированную терапию (наложение TIPS, противовирусная терапия HCV- и HBV-инфекции, лечение АИГ азатиоприном). Рекомпенсация ЦП отмечалась у 61% больных АБП, 16% пациентов с HCV-ассоциированным ЦП, 5% больных с АБП/HCV-ассоциированным ЦП. У остальных пациентов рекомпенсация ЦП с последующим делистингом была связана с HBV-индуцированным ЦП – 4% случаев, АИГ – 5%, неалкогольным стеатогепатитом – 4%, ПСХ – 1%, криптогенным ЦП – 1%, саркоидозом – 3% случаев.
Мы установили, что на момент включения пациентов в ЛО показатели MELD и MELD-Na были значимо ниже в группе больных с наступившей рекомпенсацией ЦП по сравнению с группой пациентов с субкомпенсацией ЦП. Низкие показатели MELD при включении пациентов в ЛО увеличивали вероятность развития рекомпенсации, а высокие показатели MELD, напротив, служили негативными предикторами для больных с декомпенсированным HCV-циррозом, получавших противовирусную терапию, и декомпенсированным ЦП алкогольной этиологии [13, 23].
Проведенные нами исследования позволяют утверждать, что рекомпенсация ЦП обусловлена воздействием ряда факторов: эффективностью противовирусной терапии, абстиненцией больных АБП, терапией иммуносупрессантами аутоиммунных заболеваний печени, комплексной терапией ПЭ, назначением мочегонных средств и карведилола. К важным составляющим терапии следует отнести наложение TIPS, проведение азигопортального разобщения по оригинальной методике, эндоскопического лигирования вен пищевода. На фоне таких мероприятий значимо снижаются показатели MELD и MELD-Na, индекс по шкале Чайлда – Пью, уменьшаются уровни билирубина, щелочной фосфатазы, МНО, повышается содержание тромбоцитов и лейкоцитов. В проведенных исследованиях показано увеличение уровня альбумина и снижение концентрации билирубина на 12-й и 24-й неделях после достижения устойчивого вирусологического ответа, что коррелирует со снижением показателей по шкалам MELD и Чайлда – Пью. Так, в исследовании SOLAR лечение декомпенсированного HCV-ассоциированного ЦП комбинацией софосбувира и ледипасвира ± рибавирин в течение 12 и 24 недель способствовало улучшению показателей MELD у 60% пациентов к 12-й неделе после окончания терапии. У 20% пациентов наблюдалось ухудшение, несмотря на проводимую терапию [27, 28]. Аналогичное улучшение показателей MELD продемонстрировано в исследовании ALLY-1 с участием 53% пациентов с ЦП класса B по шкале Чайлда – Пью и 27% пациентов с ЦП класса C по шкале Чайлда – Пью. Пациенты получали комбинацию софосбувира, даклатасвира и рибавирина в течение 12 недель [29].
В европейском многоцентровом ретроспективном исследовании с участием 103 пациентов с декомпенсированным ЦП без гепатоцеллюлярной карциномы, включенных в ЛО ТП, назначали терапию с использованием различных режимов прямых противовирусных средств. Авторы указали на рекомпенсацию (инактивацию ЦП) с последующим делистингом в 35 и 20% случаев соответственно.
В исследовании L.S. Belli и соавт. независимыми предикторами клинического улучшения, приведшего к деактивации ЦП, стали увеличение индекса MELD и концентрации альбумина [23]. Значительное улучшение (инактивация ЦП) было достигнуто у пациентов с декомпенсированным ЦП с индексом MELD выше 20 пунктов. У 142 пациентов последующее наблюдение в течение 58 месяцев обусловило делистинг в 24% случаев по достижении градации A по шкале Чайлда – Пью и отсутствие клинической декомпенсации.
С помощью логистической регрессии нами установлено, что уровень лейкоцитов на момент включения больных в ЛО является независимым предиктором развития делистинга вследствие рекомпенсации у пациентов с декомпенсированными заболеваниями печени. Данная модель характеризуется высокой предсказательной способностью, чувствительностью и специфичностью, о чем свидетельствуют показатель AUC для этой независимой переменной (0,805; 95% ДИ 0,711–0,898; p < 0,001) и ROC-кривая.
Можно предположить, что снижение уровня лейкоцитов у больных ЦП обеих когорт в нашем исследовании связано с портальной гипертензией. Как известно, увеличение селезенки у больных ЦП обычно сопровождается развитием гиперспленизма – основной причины лейкопении и тромбоцитопении [30]. Тем не менее точные эффекторные механизмы спленомегалии и гиперспленизма остаются неясными. Предполагают, что наиболее вероятными причинами этих феноменов являются нарушение гемодинамики вследствие портальной гипертензии, повреждение ткани селезенки и высвобождение сигнальных молекул, индуцированных воспалением [31, 32].
Согласно нашим данным, рекомпенсация ЦП ассоциируется со значимым различием между концентрацией лейкоцитов в сравниваемых группах при включении пациентов в ЛО, что, вероятно, отражает меньшую выраженность гиперспленизма и портальной гипертензии. Данное предположение подтверждается расчетом ОШ: у больных с уровнем лейкоцитов ≥ 3,1 × 109/л на момент включения в ЛО вероятность развития рекомпенсации ЦП увеличивается в 1,745 раза (95% ДИ 1,391–2,188). Важный момент: содержание тромбоцитов и лейкоцитов у больных с рекомпенсацией ЦП значимо увеличивается после терапии.
Заключение
Настоящее исследование показало, что у больных с декомпенсированным ЦП возможна рекомпенсация ЦП (деактивация) с последующим делистингом. Вероятно, для этой категории пациентов существуют «критические точки возврата и невозврата». Обратимость повреждений печени представляется длительным процессом, а наступившая рекомпенсация ЦП требует последующего контроля за пациентами, поскольку не исключена вероятность обострения (декомпенсации) и, как следствие, повторного включения больных в ЛО ТП. Тем не менее рекомпенсация ЦП с последующим делистингом позволяет в условиях дефицита органа для ТП провести эту операцию пациентам, которые наиболее близки к «критической точке невозврата», для спасения их жизни.
При включении кандидатов на ТП в ЛО независимым предиктором развития рекомпенсации ЦП и последующего делистинга является уровень лейкоцитов крови ≥ 3,1 × 109/л.
Авторы заявляют об отсутствии конфликта интересов.
V.L. Korobka, MD, PhD, Ye.S. Pak, V.D. Pasechnikov, MD, PhD, Prof., M.Yu. Kostrykin, PhD
Rostov Regional Clinical Hospital
Rostov State Medical University
Stavropol State Medical University
Contact person: Viktor D. Pasechnikov, passetchnikov@mail.ru
The Purpose – to determine the factors (predictors) predicting of liver cirrhosis (LC) recompensation development, with the following delisting, at the time of patients inclusion in the waiting list for liver transplantation, and as well to assess the dynamics of laboratory parameters of liver function and indices on the scales MELD, Child – Pugh score in the course of conducting therapy.
Material and methods. Conducted the prospective research of ῾case – control᾿ type. The cohort ῾case᾿ included 24 adult patients with decompensated liver diseases of various etiologies included in the waiting list for liver transplantation and later dropped out of it due to LC recompensation. The cohort ῾control᾿ consisted of 71 patients with decompensated liver diseases, who were included in the waiting list in the same period of time and who developed subcompensation of the LC.
Results. The logistic regression model was used to determine the independent predictors of delisting due to LC recompensation. A significant predictor of LC recompensation became the parameter of blood leukocytes when included in the waiting list (p = 0.005). The predictive value of the detected predictor was confirmed by ROC-analysis (Receiver Operating Characteristic). The area under the ROC-curve (Area Under Curve) for the number of leukocytes in the blood was equal to 0.805 (95% confidence interval (CI) 0.711–0.898, p < 0.001). The odds ratio for the outcome of the recompensation, provided that the number of leukocytes when included in the waiting list ≥ 3,1 × 109/l, was equal to 1,745 (95% CI 1,391–2,188). The conducted therapy resulted in the significant increase in platelets and leukocytes in the blood, the decrease in alkaline phosphatase, bilirubin, international normalized ratio (INR), meld and Child – Pugh indices in patients with LC recompensation.
Conclusion. The study showed the possibility of LC recompensation after the termination of the activity of factors causing its decompensation. The independent predictor of the development of LC recompensation and subsequent delisting of patients appeared to be the number of blood leukocytes ≥ 3,1 ×109/l at the time of inclusion of patients in the waiting list for liver transplantation. Combination therapy caused the significant decrease in the indices on the MELD scale and Child – Pugh score, the increase in the number of platelets and leukocytes in the blood, a decrease in bilirubin, alkaline phosphatase, in INR in patients with LC recompensation.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.