Репродуктологические аспекты проблемы консервативного хирургического лечения эндометриоидных кист яичников
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. У 93 инфертильных пациенток с ЭКЯ и значениями антимюллерова гормона (АМГ) < 1,2 нг/мл анализировали зависимость степени снижения этого гормона от числа выполненных операций при рецидивах эндометриомы. С использованием стандартных методов исследования у этих же больных параллельно изучали распространенность факторов бесплодия, выделяемых в Международной классификации болезней 10-го пересмотра, и уточняли информированность женщин о влиянии хирургического лечения ЭКЯ на репродуктивный потенциал.
Результаты. У 71% женщин с ЭКЯ обнаруживались и другие формы эндометриоза, а наблюдаемая инфертильность, обусловившая необходимость назначения ЭКО, была связана в основном с подтверждаемыми мужским и трубным факторами. Среди оперированных по поводу ЭКЯ больных со сниженным уровнем АМГ большинство перенесли неоднократные резекции яичников из-за рецидивов эндометриом, возникавших в течение двух с половиной лет после их удаления. Степень снижения уровня АМГ имела прямую зависимость от числа выполненных операций. Во время хирургического лечения ЭКЯ только 7,5% больных получили соответствующую информацию об их частом рецидивировании и возможных последствиях для репродуктивной функции выполняемых (особенно многократных) резекций яичников.
Выводы. Частое рецидивирование ЭКЯ, вынуждающее проводить повторные резекции яичников, является очевидным фактором, который из-за редукции овариального резерва препятствует успешному использованию технологии ЭКО с собственными ооцитами в ситуациях, когда этот метод лечения бесплодия оказывается востребованным. При планировании удаления ЭКЯ у женщин репродуктивного возраста хирургам в обязательном порядке следует направлять пациенток к репродуктологам для консультирования по вопросам, связанным с реализацией репродуктивных планов как в ближайшей, так и в отдаленной перспективе.
Материал и методы. У 93 инфертильных пациенток с ЭКЯ и значениями антимюллерова гормона (АМГ) < 1,2 нг/мл анализировали зависимость степени снижения этого гормона от числа выполненных операций при рецидивах эндометриомы. С использованием стандартных методов исследования у этих же больных параллельно изучали распространенность факторов бесплодия, выделяемых в Международной классификации болезней 10-го пересмотра, и уточняли информированность женщин о влиянии хирургического лечения ЭКЯ на репродуктивный потенциал.
Результаты. У 71% женщин с ЭКЯ обнаруживались и другие формы эндометриоза, а наблюдаемая инфертильность, обусловившая необходимость назначения ЭКО, была связана в основном с подтверждаемыми мужским и трубным факторами. Среди оперированных по поводу ЭКЯ больных со сниженным уровнем АМГ большинство перенесли неоднократные резекции яичников из-за рецидивов эндометриом, возникавших в течение двух с половиной лет после их удаления. Степень снижения уровня АМГ имела прямую зависимость от числа выполненных операций. Во время хирургического лечения ЭКЯ только 7,5% больных получили соответствующую информацию об их частом рецидивировании и возможных последствиях для репродуктивной функции выполняемых (особенно многократных) резекций яичников.
Выводы. Частое рецидивирование ЭКЯ, вынуждающее проводить повторные резекции яичников, является очевидным фактором, который из-за редукции овариального резерва препятствует успешному использованию технологии ЭКО с собственными ооцитами в ситуациях, когда этот метод лечения бесплодия оказывается востребованным. При планировании удаления ЭКЯ у женщин репродуктивного возраста хирургам в обязательном порядке следует направлять пациенток к репродуктологам для консультирования по вопросам, связанным с реализацией репродуктивных планов как в ближайшей, так и в отдаленной перспективе.






По разным экспертным оценкам, частота всех форм генитального эндометриоза составляет примерно 10–15% от числа женщин репродуктивного возраста, тогда как среди инфертильных пациенток с эндометриозом примерно у 1/3 он проявляется в виде эндометриоидных кист яичников (ЭКЯ) [1, 2]. Обнаруженные ЭКЯ могут быть единственным проявлением заболевания или сочетаться с другими локализациями эндометриозного процесса, а наблюдаемая инфертильность нередко ассоциируется не только с собственно эндометриозом, но и с сопутствующими факторами бесплодия [3, 4].
Согласно принятым стандартам лечения гинекологических больных, при обнаружении кист яичников после исключения их функционального происхождения (по итогам двух-трехмесячного динамического наблюдения) в основном принято удалять патологическое образование (впервые выявленные кисты больших размеров), что связано также с онкологической настороженностью [5, 6]. Данное положение распространяется на тактику ведения пациенток с ЭКЯ, истинную (эндометриозную) природу которых можно окончательно подтвердить только с помощью гистоморфологического исследования удаленной кисты [7, 8]. Однако особенностью именно эндометриом является их упорное рецидивирование, что вынуждает выполнять повторные операции. Это каждый раз сопровождается хирургической травмой яичников и усугублением редукции овариального резерва из-за потери части функциональной яичниковой ткани при удалении кисты. Сокращение овариального резерва увеличивает риск бедного ответа, снижающего эффективность стандартной процедуры экстракорпорального оплодотворения (ЭКО) с собственными ооцитами. Очевидно, это обстоятельство следует учитывать и хирургам, и пациенткам, поскольку у некоторых из оперированных по поводу ЭКЯ женщин (как правило, достаточно молодого возраста) впоследствии может возникнуть потребность в использовании ЭКО. Причем такая потребность, возможно, будет обусловлена причинными механизмами бесплодия, не имеющими никакой связи с эндометриозом, например мужским фактором или абсолютным трубным бесплодием после удаления маточных труб при внематочной беременности.
Цель – уточнить сроки рецидивирования удаляемых эндометриом и зависимость состояния овариального резерва от числа выполненных резекций яичников, а также оценить информированность пациенток о влиянии хирургического лечения эндометриоидных кист на репродуктивную функцию и терапевтическую эффективность технологии ЭКО.
Материал и методы
В исследовании участвовали 93 инфертильные пациентки с эндометриозом яичников и признаками снижения овариального резерва, который оценивали по уровню антимюллерова гормона (АМГ). Обследование больных проводили в соответствии со стандартными рекомендациями, регламентирующими порядок и объем обследования больных бесплодием [9, 10]. У взятых под наблюдение женщин уточняли:
- особенности клинических проявлений эндометриоза – наличие только ЭКЯ или их сочетание с другими формами эндометриоза;
- вероятный причинный фактор бесплодия по критериям Международной классификации болезней 10-го пересмотра (МКБ-10), обусловивший необходимость назначения ЭКО;
- количество выполнявшихся резекций и продолжительность периодов между удалением эндометриомы и ее подтвержденным рецидивом;
- возраст больных накануне самой первой оперативной лапароскопии, назначенной для удаления ЭКЯ, и в момент обращения за помощью в лечении бесплодия с использованием ЭКО;
- зависимость степени снижения уровня АМГ от количества выполненных оперативных лапароскопий по поводу ЭКЯ;
- информированность пациенток в период выполнения оперативных вмешательств по поводу ЭКЯ о влиянии хирургической травмы на репродуктивную функцию и терапевтический потенциал технологии ЭКО.
АМГ определяли с помощью теста Access AMH на иммунохимическом анализаторе Access 2 производства компании Beckman Coulter Inc. исходя из требований инструкции к набору реагентов. Редукцию овариального резерва подтверждали при значениях АМГ < 1,2 нг/мл. При этом уровень АМГ в интервале 1,2–0,5 нг/мл расценивали как признак умеренной редукции овариального резерва, а при значениях АМГ < 0,5 нг/мл констатировали выраженную редукцию овариального резерва.
Полученные результаты обрабатывали методом вариационной статистики с использованием компьютерной программы Statistica 6.0. Переменные количественные показатели представляли в виде их среднего значения (М) ± одного стандартного отклонения (±SD). Различия частот анализируемого признака при парных сравнениях с группой А, выступавшей в качестве контроля, считали достоверными при уровне значимости р < 0,05.
Результаты
При оценке изученных параметров клинического статуса было установлено, что среди пациенток с ЭКЯ со сниженным овариальным резервом большинство женщин (71%) страдали и другими формами эндометриоза с поражением в основном брюшины, реже ретроцервикального пространства и в отдельных случаях колоректальной области (табл. 1).
Анализ распространенности факторов бесплодия (по критериям МКБ-10), обусловливающих необходимость использования вспомогательных репродуктивных технологий, показал, что обследованные больные нуждались в применении ЭКО в основном из-за наличия трубно-перитонеального фактора (59,1%) (табл. 2). Второе место среди причинных факторов бесплодия, диктовавших необходимость назначения ЭКО, занимал мужской фактор – 31,3%, третье – маточный фактор – 17,2%, четвертое – хроническая ановуляция – 9,4%. При этом у 34,4% больных отмечались те или иные сочетания перечисленных факторов. Лишь у 18,3% пациенток не удалось выявить очевидный причинный патогенетический фактор инфертильности по критериям МКБ-10, то есть их бесплодие было необъяснимым с точки зрения понимания его конкретного механизма.
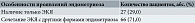
В общей когорте обследованных больных с ЭКЯ лишь у 4,3% женщин эндометриозное поражение яичников было выявлено впервые, тогда как остальные пациентки перенесли в прошлом удаление эндометриомы, причем у 46,1% было подтверждено наличие рецидивной ЭКЯ в период проведения нашего исследования (табл. 3).
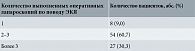
Среди 89 женщин, оперированных в прошлом по поводу ЭКЯ, у 60,7% резекция яичников выполнялась два-три раза, у 30,3% – более трех раз (табл. 4). Лишь 9% оперированных перенесли в прошлом только одну резекцию яичников, причем в момент нашего обследования у двух (25%) из восьми таких больных обнаруживались УЗ-признаки рецидивной эндометриомы.
По данным анамнеза удалось установить, что продолжительность периода между удалением эндометриомы и ее подтвержденным рецидивом у пациенток с повторным выявлением ЭКЯ после хирургического лечения варьировалась от полугода до 12 лет (табл. 5). Причем такие колебания периода между повторными подтверждениями наличия ЭКЯ наблюдались не только у разных больных, но и у одной и той же пациентки с несколькими (более одного) диагностированными рецидивами эндометриомы. В среднем рецидив эндометриомы чаще имел место в течение двух с половиной лет после ее удаления.
Ретроспективно установлено, что возраст наблюдавшихся больных перед самой первой оперативной лапароскопией, назначенной для удаления ЭКЯ, колебался в интервале 20–25 лет (в среднем – 22,4 ± 1,6 года) (табл. 6). При включении этих же пациенток в настоящее исследование их возраст варьировался от 28 до 42 лет (средний возраст – 34,2 ± 3,5 года). Соответственно продолжительность периода между самым первым удалением эндометриомы (у женщин с одним или несколькими последующими рецидивами) и включением в наше исследование, предусматривавшее использование ЭКО, колебалась от четырех до 18 лет (в среднем – 10 ± 4,2 года).
При изучении зависимости степени снижения уровня АМГ от количества проведенных вмешательств на яичниках, сопровождавшихся удалением ЭКЯ, было установлено, что частота пациенток с выраженным низким уровнем АМГ (0,5 нг/мл) нарастала при увеличении числа выполненных операций (табл. 7). Так, если среди больных с однократно проведенной резекцией ЭКЯ доля пациенток с выраженным снижением овариального резерва (низкими значениями АМГ) составляла 12,5%, то в случаях проведения двух-трех таких операций возрастала до 63%, а у пациенток, перенесших свыше трех операций, достигала 100%.
При уточнении информированности пациенток о негативном влиянии выполняемых по поводу ЭКЯ резекций яичников на овариальный резерв, редукция которого грозит выраженным снижением овариального резерва и, как следствие, эффективности ЭКО с собственными ооцитами, было установлено следующее (табл. 8).
Во-первых, лишь 7,5% оперированных женщин получили такую информацию перед удалением эндометриомы, тогда как остальные 92,5% не были предупреждены о возможных последствиях для состояния овариального резерва хирургического лечения ЭКЯ, что лишний раз подтверждает важность более внимательного отношения со стороны медицинского персонала к информированию пациенток репродуктивного возраста.
Во-вторых, в начале хирургического лечения ЭКЯ по причине молодого возраста (в среднем – 22 года) 15% больных не планировали беременность из-за нежелания иметь детей вообще (в дальнейшем их взгляды в этом вопросе кардинально изменились). Еще 79,6% женщин допускали возможность реализации репродуктивной функции, но лишь в отдаленной перспективе и только при благоприятных обстоятельствах. Из этого наблюдения следует, что и сами оперированные женщины часто не проявляли интереса к ознакомлению с возможными рисками хирургического лечения ЭКЯ, связанными именно с редукцией овариального резерва и ее последствиями. Это объясняется тем, что в период выполнявшихся оперативных лапароскопий беременность у этих пациенток не была приоритетной целью или даже рассматривалась как нежеланная в принципе.
Обсуждение
При уточнении наличия у инфертильных пациенток с ЭКЯ и сниженным овариальным резервом патогенетических форм бесплодия, описываемых в МКБ-10, было установлено, что несостоятельность репродуктивной функции, диктовавшая необходимость использования ЭКО, была обусловлена в основном трубным и мужским факторами. Это наблюдение согласуется с сообщениями других специалистов, также указывающих на частое выявление сопутствующих факторов, требующих назначения ЭКО у инфертильных женщин с эндометриозом [11, 12]. Причем ряд таких факторов (например, мужской фактор) в принципе не могли иметь никакой связи с эндометриозом. Собственно только эндометриоз (в виде ЭКЯ без сочетания с сопутствующими факторами инфертильности) ассоциировался с наблюдаемым бесплодием лишь у 1/5 больных. То есть, по нашим данным, только примерно у 20% инфертильных женщин с ЭКЯ не удавалось идентифицировать ту или иную из очевидных патогенетических форм бесплодия, приводимых в МКБ-10, что заставляет рассматривать имеющееся бесплодие у таких женщин как необъяснимое с точки зрения понимания его конкретных механизмов. Следует подчеркнуть, что вопрос об истинных механизмах бесплодия при любой из форм эндометриоза (не сочетающихся с сопутствующими факторами бесплодия, явно не связанными с эндометриозом) пока еще далек от окончательного разрешения, поскольку все существующие объяснения инфертильности при этом заболевании носят предположительный характер [13, 14]. К этому можно добавить, что большое число женщин с любыми из форм эндометриоза вообще не страдают бесплодием, что в еще большей степени осложняет объяснение причин увеличения процента инфертильных женщин среди пациенток с таким заболеванием.
В отношении эффективности консервативного хирургического лечения ЭКЯ следует указать, что удаление ЭКЯ во многих случаях лишь на время избавляет больных от имеющейся патологии, о чем свидетельствуют ее упорное рецидивирование, заставляющее выполнять многократные повторные эксцизии вновь образующихся эндометриом. Результатом неоднократных резекций функциональной яичниковой ткани, неизбежно сопровождающих удаление ЭКЯ, становится драматическое уменьшение овариального резерва, отображаемого уровнем АМГ. Между тем хорошо известно, что состояние овариального резерва является ключевым фактором, определяющим успешность использования ЭКО с собственными ооцитами [15]. Очевидно, пациентки с признаками выраженной (АМГ < 0,5 нг/мл) редукции овариального резерва имеют плохой прогноз эффективного использования ЭКО с собственными ооцитами из-за очень высокого (практически 100%-ного) риска бедного ответа. Причем у пациенток позднего репродуктивного возраста ситуация усугубляется, так как у них бедный ответ сочетается и со снижением качества выделяемых яйцеклеток и генерируемых из них эмбрионов, что в еще большей степени препятствует эффективности ЭКО с собственными ооцитами и требует использования донорского материала [16].
Подтвержденное в нашем исследовании неблагоприятное влияние хирургического лечения ЭКЯ на состояние овариального резерва указывает на необходимость учета последствий хирургической травмы яичников, создающей помехи для дальнейшего успешного использования ЭКО с собственными ооцитами. По этой причине при планировании удаления эндометриомы всех молодых пациенток полезно ориентировать на скорейшую реализацию репродуктивной функции после выполненной операции или на создание собственного банка крио-ооцитов/крио-эмбрионов в случаях, когда беременность не планируется в ближайшее время. Данный подход аргументирован высокой вероятностью рецидивирования ЭКЯ. При этом очевидно, что повторно выполняемые резекции эндометриом (при их рецидиве) дополнительно сокращают функциональную ткань яичников, а вместе с ней и овариальный резерв, что в еще большей степени увеличивает вероятность бедного ответа, снижающего эффективность стандартного ЭКО с собственными ооцитами.
Что касается больных позднего репродуктивного возраста, при наличии у них репродуктивных планов и обнаружении подлежащей удалению эндометриомы (впервые диагностированной или рецидивной) перед выполнением хирургического вмешательства на яичниках им следует еще более настоятельно рекомендовать создание собственного банка крио-ооцитов/крио-эмбрионов до проведения хирургического лечения. Подобная рекомендация вытекает из наших наблюдений, согласно которым у пациенток старшего репродуктивного возраста получение даже минимального количества эмбрионов надлежащего качества крайне затруднено не только из-за бедного ответа, ассоциируемого с хирургической травмой яичников при удалении ЭКЯ, но и из-за возрастного падения качества получаемых ооцитов и генерируемых из них бластоцист.
Аналогичные рекомендации по ведению пациенток с ЭКЯ дают и другие специалисты, сообщившие о негативном влиянии хирургического лечения эндометриоза на овариальный резерв и, как следствие, на возможность последующего успешного использования ЭКО с собственными ооцитами [17, 18].
Отдельно следует указать, что отмеченная нами крайне низкая информированность оперированных по поводу ЭКЯ инфертильных женщин о неблагоприятном влиянии выполняемых резекций яичников на овариальный резерв подчеркивает необходимость более тесного сотрудничества хирургов и репродуктологов. В идеале перед удалением эндометриомы пациентка должна быть проконсультирована именно репродуктологом, который может предложить оптимальный план действий, обеспечивающий максимальное сохранение репродуктивного потенциала и возможность реализации репродуктивной функции при самых разных обстоятельствах, как в ближайшее время, так и в отдаленной перспективе.
Заключение
При хирургическом лечении эндометриоза яичников в случаях заинтересованности пациенток в беременности целесообразно ориентировать их на скорейшую реализацию репродуктивной функции в послеоперационном периоде из-за высокой вероятности рецидивирования эндометриомы. Увеличение числа повторно выполняемых резекций ЭКЯ при их рецидивах усугубляет редукцию овариального резерва, что потенциально грозит бедным ответом, снижающим эффективность технологии ЭКО с собственными ооцитами, которая может быть востребована по разным причинам, причем в большинстве случаев не обязательно связанным только с эндометриозом.
При отсрочке реализации репродуктивных планов у женщин, направляемых на хирургическое лечение ЭКЯ, целесообразно создание запаса собственных крио-ооцитов/крио-эмбрионов, обеспечивающих возможность достижения беременности в будущем. Причем у пациенток старшего репродуктивного возраста такой запас должен быть подготовлен в обязательном порядке до выполнения резекции ЭКЯ.
При планировании удаления ЭКЯ у женщин репродуктивного возраста хирургам следует направлять пациенток к репродуктологам для консультирования по вопросам, связанным с реализацией репродуктивных планов, даже если пациентки (в силу слишком молодого возраста) в период выполняемой операции не заинтересованы в реализации репродуктивной функции.
K.V. Krasnopolskaya, PhD, Prof., Corr.-Mem. of RAS, I.Yu. Yershova, PhD, A.A. Samoylova
Moscow Regional Scientific Research Institute of Obstetrics and Gynecology
Contact person: Irina Yu. Yershova, i3236987@gmail.com
The aim is to clarify the timing of recurrence of endometriomas removed and the dependence of the ovarian reserve status on the number of ovarian resections performed, as well as to assess the awareness of patients about the impact of surgical treatment of endometrioid ovarian cysts (EOC) on reproductive function and therapeutic effectiveness of in vitro fertilization (IVF) technology.
Material and methods. In 93 infertile patients with EOC and values of anti-muller hormone (AMH) < 1.2 ng/ml, the dependence of the degree of reduction of this hormone on the number of operations performed with relapses of endometrioma was analyzed. Using standard research methods in the same patients, the prevalence of infertility factors identified in the International Classification of Diseases of the 10th revision was studied in parallel, and women's awareness of the impact of surgical treatment of EOC on reproductive potential was clarified.
Results. Other forms of endometriosis were found in 71% of women with EOC, and the observed infertility, which necessitated the appointment of IVF, was mainly associated with confirmed male and tubal factors. Among the patients operated on for EOC with a reduced level of AMH, the majority underwent repeated ovarian resections due to relapses of endometriomas that occurred within two and a half years after their removal. The degree of decrease in the level of AMH was directly dependent on the number of operations performed. During surgical treatment of EOC, only 7.5% of patients received relevant information about their frequent recurrence and possible consequences for the reproductive function of ovarian resection performed (especially multiple).
Conclusions. Frequent recurrence of EOC, which forces repeated resections of the ovaries, is an obvious factor that, due to the reduction of the ovarian reserve, prevents the successful use of IVF technology with its own oocytes in situations where this method of infertility treatment is in demand. When planning the removal of EOC in women of reproductive age, surgeons should necessarily refer patients to reproductologists for advice on issues related to the implementation of reproductive plans both in the near and long term.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.