Ревматоидный артрит и коморбидные состояния. Что нужно знать практикующему ревматологу? IV Евразийский конгресс ревматологов. Сателлитный симпозиум компании «Санофи»
- Аннотация
- Статья
- Ссылки
В рамках IV Евразийского конгресса ревматологов при поддержке компании «Санофи» 28 сентября 2018 г. состоялся симпозиум, посвященный проблемам лечения пациентов с коморбидными состояниями при ревматоидном артрите. Особое внимание докладчиков и участников симпозиума было уделено принципам ведения таких пациентов. Кроме того, были рассмотрены возможности применения ингибитора рецепторов интерлейкина 6 (ИЛ-6) – блокатора одного из ключевых звеньев патогенеза ревматоидного артрита. Сделан вывод, что применение ингибитора рецепторов ИЛ-6 сарилумаба может не только уменьшить клиническую выраженность заболевания и способствовать достижению ремиссии у больных ревматоидным артритом, но и корректировать коморбидные состояния.
В рамках IV Евразийского конгресса ревматологов при поддержке компании «Санофи» 28 сентября 2018 г. состоялся симпозиум, посвященный проблемам лечения пациентов с коморбидными состояниями при ревматоидном артрите. Особое внимание докладчиков и участников симпозиума было уделено принципам ведения таких пациентов. Кроме того, были рассмотрены возможности применения ингибитора рецепторов интерлейкина 6 (ИЛ-6) – блокатора одного из ключевых звеньев патогенеза ревматоидного артрита. Сделан вывод, что применение ингибитора рецепторов ИЛ-6 сарилумаба может не только уменьшить клиническую выраженность заболевания и способствовать достижению ремиссии у больных ревматоидным артритом, но и корректировать коморбидные состояния.




Интерлейкин 6 в патогенезе ревматоидного артрита и развитии коморбидных состояний
Президент, заведующий кафедрой терапии и ревматологии им. Э.Э. Эйхвальда ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова», д.м.н., профессор, академик Российской академии наук, заслуженный деятель науки РФ Вадим Иванович МАЗУРОВ отметил, что ревматоидный артрит – распространенное хроническое аутоиммунное заболевание, на фоне которого часто развиваются другие заболевания, также ассоциированные с нарушением иммунной системы и воспалительными процессами. В свою очередь коморбидные состояния негативно влияют на течение ревматоидного артрита, снижают эффективность терапии. Следует подчеркнуть, что у больных ревматоидным артритом часто отмечаются усталость, депрессия, которые утяжеляют течение основного заболевания и ухудшают качество жизни.
Установлено, что при ревматоидном артрите значительно повышен риск развития сердечно-сосудистых катастроф, в частности инфаркта миокарда. Риск развития инфаркта миокарда у больных ревматоидным артритом сопоставим с таковым у пациентов с сахарным диабетом1. Кроме того, у пациентов с ревматоидным артритом отмечается раннее развитие атеросклероза, тромбоза, неишемических сердечно-сосудистых заболеваний.
При ревматоидном артрите нередко поражаются органы дыхания. Интерстициальное поражение легких является одним из самых распространенных и клинически значимых респираторных осложнений. Оно сопряжено с развитием прогрессирующей дыхательной недостаточности и часто становится причиной летального исхода.
В настоящее время распространенность сахарного диабета 2 типа достигает размеров эпидемии. У пациентов с ревматоидным артритом дополнительные риски развития диабета связаны с длительным применением базисных противовоспалительных препаратов и, конечно, приемом глюкокортикостероидов.
Нарушение функции почек у пациентов с ревматоидным артритом является еще одной из часто встречаемых коморбидностей. Самым неблагоприятным в отношении течения и прогноза ревматоидного артрита признан вторичный амилоидоз. Последний ассоциируется с развитием быстро прогрессирующей почечной недостаточности и потребностью в гемодиализе. По разным данным, частота обнаружения амилоидоза у данной категории больных варьируется от 7 до 40%2.
Депрессивные состояния достаточно часто сопутствуют ревматоидному артриту3, что существенно снижает качество жизни пациентов и приверженность лечению.
Докладчик подчеркнул, что к развитию суставных проявлений ревматоидного артрита приводит дисбаланс цитокинов адаптивного и врожденного иммунитета. Основным звеном патогенеза является иммунологическая дисрегуляция, сопровождающаяся процессами аутоиммунизации и формированием различных классов антител, а также гиперпродукцией провоспалительных цитокинов, хемокинов, молекул адгезии, факторов роста, металлопротеиназ, принимающих участие в поражении тканей суставов и целого ряда внутренних органов.
Одной из причин суставных и системных проявлений ревматоидного артрита является гиперпродукция интерлейкина (ИЛ) 6 клетками синовиальной оболочки4. Данный интерлейкин признан одним из ключевых цитокинов воспалительного процесса. Острое и хроническое воспаление при ревматоидном артрите может сопровождаться системной реакцией, приводящей к повышению белков острой фазы. ИЛ-6 – главный индуктор их продукции печенью.
При ревматоидном артрите ИЛ-6 участвует в регуляции остеодеструкции и способен влиять на метаболизм костной ткани. ИЛ-6 является мощным индуктором экспрессии RANKL (receptor activation of NF-kВ ligand) фибробластами синовиальной оболочки и остеобластами5. При этом он может также активировать Th17-клетки, обеспечивая гиперпродукцию ИЛ-17, который также стимулирует экспрессию RANKL на остеобластах6. Обращает внимание тот факт, что ИЛ-6 сам по себе может индуцировать дифференцировку остеокластов, вне зависимости от RANKL. Участие ИЛ-6 также доказано в развитии остеопороза у пациентов с ревматоидным артритом7.
Не менее важную роль ИЛ-6 играет в развитии анемии у пациентов. Он индуцирует продукцию гепсидина, блокирующего захват железа из желудочно-кишечного тракта (ЖКТ), а также выход железа из макрофагов.
Кроме того, ИЛ-6 вносит свой вклад в дисрегуляцию гипоталамо-гипофизарно-надпочечниковой системы, что приводит к развитию депрессии и утомляемости.
Гетерогенность ревматоидного артрита, возможно, объясняется разными сигнальными путями фактора некроза опухоли (ФНО) альфа и ИЛ-6. Так, если ФНО-альфа осуществляет свое стимулирующее действие через ядерный фактор транскрипции NF-kB, то ИЛ-6 передает сигнал через путь, который связан с JAK (janus kinase – янус-киназа) и STAT (signal transducer and activator of transcription – сигнальный трансдуктор и активатор транскрипции), активирующих транскрипцию ключевых генов-мишеней8. Можно предположить, что различные сигнальные пути ФНО-альфа и ИЛ-6 в определенной степени могут объяснять их особые патогенетические механизмы в формировании иммуновоспалительного процесса при ревматоидном артрите9.
ИЛ-6 обладает способностью взаимодействовать как со своим мембранным рецептором, так и с растворимым. В результате связывания моноклональных антител с мембранными и растворимыми рецепторами ИЛ-6 блокируются и классический, и транссигнальный пути ИЛ-6.
Сарилумаб – полностью человеческое моноклональное антитело, которое селективно связывается с мембранным и растворимым рецепторами ИЛ-6. Взаимодействуя с рецептором ИЛ-6, сарилумаб блокирует связывание ИЛ-6 с его рецепторами и, таким образом, прерывает цитокин-опосредованный сигнальный каскад, участвующий в формировании и прогрессировании иммуновоспалительного процесса при ревматоидном артрите.
Роль ингибирования интерлейкина 6 в лечении мультиморбидных пациентов с ревматоидным артритом
Продолжил симпозиум д.м.н., профессор, заведующий лабораторией ранних артритов ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой» (НИИР им. В.А. Насоновой) Андрей Викторович ГОРДЕЕВ. Он отметил важную роль провоспалительного цитокина ИЛ-6 в патогенезе не только ревматоидного артрита, но и большого количества заболеваний, таких как сахарный диабет 2 типа, сердечно-сосудистая патология.
«Не вызывает сомнений тот факт, что ревматоидный артрит является фактором риска развития тяжелых сопутствующих хронических состояний», – подчеркнул выступающий. Доказано, что ревматоидный артрит – независимый фактор риска развития инфаркта миокарда и острого нарушения мозгового кровообращения10.
Возникает закономерный вопрос: что является первичным – коморбидность у пациента или ревматоидный артрит? По данным исследований, коморбидность в дебюте ревматоидного артрита наблюдается в 50% случаев. Второй пик дебюта ревматоидного артрита приходится на вторую половину жизни, поэтому частота встречаемости коморбидных состояний у пациентов значительно увеличивается.
Исходя из сказанного ранее можно сделать вывод, что при выборе тактики лечения больных ревматоидным артритом необходимо учитывать наличие сопутствующих заболеваний.
На сегодняшний день становится очевидным, что традиционные принципы лечения больных ревматоидным артритом с коморбидными заболеваниями требуют пересмотра. Подход к лечению таких больных ранее подразумевал только снижение активности патологии. Однако анализ данных исследований показывает, что достижение ремиссии ревматоидного артрита не приводит к улучшению общего состояния пациентов. Кроме того, частота развития сопутствующих заболеваний может нарастать в геометрической прогрессии. Поэтому ключевым моментом современной стратегии лечения ревматоидного артрита является принцип «лечим больного, а не болезнь», то есть с учетом мультиморбидного окружения. Проводимая терапия должна не только приводить к снижению активности ревматоидного артрита, но и способствовать достижению ремиссии сопутствующих заболеваний.
Далее профессор А.В. Гордеев сфокусировал свое выступление на эффектах ИЛ-6 в развитии различных заболеваний и возможностях ингибиторов ИЛ-6.
ИЛ-6 занимает одно из центральных мест в патогенезе ревматоидного артрита, а также оказывает негативное воздействие на углеводный и липидный обмен. Согласно данным исследований, гиперпродукция ИЛ-6 вызывает развитие системного воспаления, дислипидемии, инсулинорезистентности, дисфункции эндотелия.
Сегодня появились данные о патогенетической взаимосвязи между метаболическим синдромом и ревматоидным артритом. Ревматоидный артрит и метаболические нарушения являются индукторами одинаковых физиологических, морфологических и иммунологических изменений на различных уровнях. Так, результаты исследований подтвердили, что ожирение является не пассивным, а одним из основных факторов возникновения и прогрессирования аутоиммунных заболеваний11.
Воспалительные цитокины, вырабатываемые жировой тканью, оказывают влияние на резистентность к инсулину. Установлено, что ИЛ-6 – потенциальный медиатор формирования инсулинорезистентности у больных ревматоидным артритом. Инсулинорезистентность способствует снижению концентрации циркулирующего BNP (brain natriuretic peptide – мозговой натрийуретический пептид) – фактора риска развития хронической сердечной недостаточности и других сердечно-сосудистых заболеваний.
Статистический анализ данных показал, что у пациентов с ревматоидным артритом резистентность к инсулину связана с более высокими концентрациями NT-pro-BNP. Скорее всего, это может быть обусловлено увеличенной концентрацией ИЛ-6 у данной категории больных12.
Провоспалительный цитокин ИЛ-6, участвующий в патогенезе ревматоидного артрита, регулирует взаимодействие инсулин-чувствительных тканей, кишечных L-клеток и клеток островков Лангерганса поджелудочной железы, способствуя развитию инсулинорезистентности. Сочетание ревматоидного артрита и сахарного диабета является неблагоприятным фактором прогноза.
В ретроспективном анализе данных исследований MOBILITY и TARGET продемонстрировано, что применение препарата сарилумаб связано со снижением уровня гликированного гемоглобина (HbA1c) у пациентов с сахарным диабетом и у пациентов без него13. Ингибирование ИЛ-6 статистически более значимо снижало концентрацию HbA1c как у больных с диабетом, так и без него14.
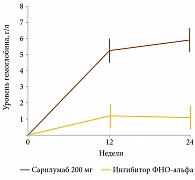
Результаты исследования MONARCH свидетельствуют, что блокатор рецепторов ИЛ-6 сарилумаб превосходит ингибитор ФНО-альфа в снижении биомаркеров костной декструкции и сердечно-сосудистого риска, если применяется в режиме монотерапии15.
Анемия хронических заболеваний как мультиморбидное состояние: роль ИЛ-6
По словам д.м.н., ведущего научного сотрудника лаборатории ранних артритов НИИР им. В.А. Насоновой Елены Андреевны ГАЛУШКО, вопросы анемии хронических заболеваний (анемии воспаления) изучаются медицинским сообществом в течение достаточно длительного времени. Впервые анемия воспаления была описана G. Cartwright в начале 1970-х гг.16 В 1980-е гг. N. Hansen охарактеризовал анемию хронического заболевания как «мешок нерешенных вопросов»17. Однако уже в 1993 г. G.D. Roodman было высказано предположение о связи анемии с активностью провоспалительных цитокинов18.
В нашей стране первопроходцами в области изучения анемии хронического заболевания являются В.И. Мазуров и А.М. Лила.
Анемия хронического заболевания возникает при любом заболевании длительностью более двух недель. Среди ее причин указывают хронические инфекции, воспаление, патологию почек, печени, эндокринную патологию и даже процессы физиологического старения. Она также развивается при опухолях и аутоиммунных заболеваниях.
Анемия воспаления ассоциируется с нарушением иммунной системы – дисбалансом про- и противовоспалительных цитокинов. В основе ее развития лежит нарушение обмена железа. Согласно современным представлениям, патогенез анемии воспаления многофакторный19.
Всасывание железа происходит через кишечник, в процессе пищеварения железо попадает в энтероциты, оттуда – в плазму крови. Железо в организме хранится в виде ферритина (депо) в гепатоцитах. На синтез гема ежедневно тратится 25–30 г железа, а всасывается с едой около 2 г/сут.
Следует различать сывороточное и тканевое железо. Сывороточное железо определяется в крови. Тканевое находится, в частности, в макрофагах и в виде ферритина в печени. Из макрофагов тканевое железо поступает на эритропоэз. Все эти процессы регулируются ключевым белком гепсидином. Гепсидин – богатый цистеином полипептид, который синтезируется главным образом гепатоцитами. Открытие гепсидина стало ключевым моментом в изучении анемии воспаления.
В НИИР им. В.А. Насоновой было проведено исследование, которое показало, что уровень гепсидина является независимым предиктором развития анемии воспаления у больных ревматоидным артритом20. Определение уровня гепсидина позволяет четко дифференцировать вид анемии при ревматоидном артрите – железодефицитная анемия (ЖДА) или анемия воспаления. При анемии воспаления уровень гепсидина повышается. У пациентов с аутоиммунными заболеваниями (ревматоидным артритом, болезнью Стилла, ювенильным ревматоидным артритом) повышается уровень гепсидина, который блокирует выход железа из депо печени и всасываемость железа кишечником21. Вследствие этого возникает функциональный дефицит железа, что отражается на результатах биохимического анализа крови. У больных с анемией воспаления выявляется сниженный уровень железа в сыворотке, который можно ошибочно трактовать как ЖДА. Однако помимо блокировки выхода из депо и всасывания железа у таких больных происходит перегрузка тканей железом с развитием токсических эффектов. В результате усиливается воспаление и развивается цитокиновый шторм.
В ряде исследований доказано, что ИЛ-6 является ключевым цитокином, активирующим повышение уровня гепсидина при воспалении. Через три часа после введения агента воспаления происходило увеличение значений ИЛ-6, через шесть часов определяли пик экспрессии гепсидина и снижение уровня железа в сыворотке22. Это было подтверждено в исследованиях c участием больных ранним ревматоидным артритом. Так, у лиц с анемией выявлено достоверное повышение уровня только ИЛ-6, но не других цитокинов. При этом отмечалась четкая корреляция между уровнем гемоглобина и ИЛ-6. Связь показателей гемоглобина с уровнем других цитокинов (ИЛ-1, ФНО-альфа) не выявлена23.
Таким образом, механизмы анемии воспаления разнонаправленные. С одной стороны, перегрузка железом тканей, с другой – дефицит железа в сыворотке. Дефицит железа в сыворотке приводит к функциональному дефициту железа в эритроидном отделе, хронической гипоксии, дефициту эритропоэтина, развитию и прогрессированию хронической болезни почек, аутоиммунному тиреоидиту, гипотиреозу и развитию сердечно-сосудистой патологии21.
Перегрузка тканей железом при анемии воспаления оказывает влияние на макрофаги и ведет к усилению иммунного ответа с гиперпродукцией ИЛ-6 и ФНО, цитокиновому шторму, снижению антимикробных функций, стимуляции роста микробов. Перегрузка железом повышает риск развития инфекционных осложнений, туберкулеза и других инфекций, а также способствует ускорению образования атеросклеротических бляшек. При перегрузке железом в гепатоцитах наблюдается ускоренное окисление холестерина (липопротеинов низкой плотности) с увеличением атерогенного потенциала, образование пенистых клеток и гиперферретинемия (вторичный эффект на холестерин) и поддержание порочного цикла атерогенеза21, 24.
Согласно данным регистра CORRONA, в который вошли результаты наблюдений за 10 397 больными в течение шести лет, при анемии чаще выявлялись ишемическая болезнь сердца, инфаркт миокарда, застойная сердечная недостаточность, инсульт, сахарный диабет и язвенное кровотечение25.
Анализ результатов исследований показывает, что анемия приводит к выраженному снижению работоспособности.
Установлено также, что уровень гемоглобина коррелирует с показателями качества жизни больных ревматоидным артритом. У пациентов с анемией, у которых на фоне лечения при одинаковой его эффективности было зарегистрировано повышение уровня гемоглобина более чем на 1 г/л, отмечалось достоверное улучшение показателей по опроснику оценки здоровья (Health Assessment Questionare – HAQ) по сравнению с теми, у кого уровень гемоглобина не менялся26.
Как отметила Е.А. Галушко, анемия является фактором неблагоприятного прогноза у пациентов с ревматоидным артритом. Установлено, что анемия увеличивает скорость рентгенологического прогрессирования ревматоидного артрита27.
В связи со сказанным проблема разработки способов коррекции анемии у пациентов с ревматоидным артритом крайне актуальна. Сравнение эффективности различных ГИБП в купировании анемии воспаления у 153 788 больных ревматоидным артритом в реальной клинической практике свидетельствует, что наиболее выраженное повышение уровня гемоглобина отмечалось на фоне терапии блокаторами рецепторов ИЛ-628.
Сарилумаб – полностью человеческое моноклональное антитело иммуноглобулина (Ig) G1, которое селективно связывается и с мембраносвязанным, и с растворимым рецептором ИЛ-6. Связываясь с рецептором ИЛ-6, сарилумаб блокирует его связывание с ИЛ-6 и тем самым прерывает цитокин-опосредованный сигнальный каскад, который наряду с другими факторами и механизмами приводит к развитию анемии воспаления29.
Кроме того, сарилумаб превосходит ингибиторы ФНО-альфа в степени повышения уровня гемоглобина в режиме монотерапии (рис. 1)30.
Подводя итог, Е.А. Галушко отметила, что многообразие причин и многофакторность патогенеза анемии воспаления обусловливают актуальность проведения дальнейших исследований в этой области.
Применение ингибиторов ИЛ-6 у коморбидных пациентов с ревматоидным артритом. Опыт реальной клинической практики
Продолжил тему профессор Евгений ФАЙСТ (отделение ревматологии и клинической иммунологии Университетской клиники Шарите, Берлин, Германия). Он отметил, что ревматоидный артрит является системным аутоиммунным заболеванием, в патогенезе которого ИЛ-6 играет значительную роль, особенно в дебюте заболевания.
В настоящее время ревматоидный артрит признан наиболее частым ревматическим заболеванием.
Патология ассоциируется с высоким риском нарушений работы внутренних органов и высокой смертностью вследствие сердечно-сосудистых нарушений, включая инфаркт. Поэтому лечение ревматоидного артрита необходимо начинать своевременно, используя окно возможностей – первые месяцы от дебюта заболевания.
Существуют разные способы воздействия на воспалительный процесс при ревматоидном артрите, в их числе – блокирование ИЛ-6. Согласно последним рекомендациям Немецкого общества ревматологов (Deutsche Gesellschaft für Rheumatologie – DGRh), при невозможности проведения комбинированной терапии метотрексатом наиболее обоснованной является монотерапия антагонистами рецепторов ИЛ-6 тоцилизумабом и сарилумабом. Эти препараты продемонстрировали большую эффективность при ревматоидном артрите, чем адалимумаб в режиме монотерапии.
В последние годы были проведены клинические исследования эффективности и безопасности препарата сарилумаб в терапии ревматоидного артрита. В частности, влияние сарилумаба на активность заболевания как в виде монотерапии, так в составе комбинированной терапии.
Далее докладчик представил несколько клинических случаев.
Клинический случай 1. Мужчина 65 лет с серопозитивным ревматоидным артритом. В марте 2014 г. принял участие в исследовании TARGET.
Исходные показатели крови от сентября 2013 г.: ревматоидный фактор (РФ) – 400 Ед/мл, антитела к циклическому цитруллинированному пептиду (АЦЦП) – 230 Ед/мл. Пациент получал лечение метотрексатом, метотрексатом в сочетании с лефлуномидом, этанерцептом, а также цертолизумабом. Число болезненных суставов (ЧБС) – 21/68, число припухших суставов (ЧПС) – 21/66 (14/28), оценка состояния по визуальной аналоговой шкале (ВАШ) – 77, индекс активности ревматоидного артрита (DAS 28) – 7,7.
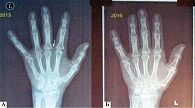
Через 12 недель терапии ЧБС – 17/68, ЧПС – 19/66, пациент был переведен в открытое исследование EXTEND. Больному назначены сарилумаб в дозе 200 мг подкожно один раз в две недели, метотрексат и преднизолон. После четырех недель терапии ЧБС – 2/68, ЧПС – 7/66, ВАШ – 14. После 24 недель терапии ЧБС – 2/68, ЧПС – 4/66, ВАШ – 13. Последнее контрольное обследование на 144-й неделе наблюдения свидетельствовало о значительном улучшении состояния больного: ЧБС – 0/68, ЧПС – 0/66, ВАШ – 23, РФ – 64 Ед/мл, АЦЦП – 72 Ед/мл. Динамика рентгенологического прогрессирования заболевания представлена на рис. 2.
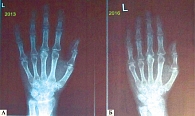
Клинический случай 2. Женщина 58 лет с серопозитивным ревматоидным артритом. В ноябре 2007 г. РФ IgM – 1600 Ед/мл, АЦЦП – 470 Ед/мл. Ранее получала лечение метотрексатом, лефлуномидом, комбинацией метотрексата и этанерцепта, метотрексата и абатацепта. Пациентка была включена в исследование TARGET в феврале 2014 г. Исходно ЧБС – 12/68, ЧПС – 10/66, ВАШ – 86, DAS 28 – 5,2. Назначены препарат сарилумаб в дозе 200 мг подкожно один раз в две недели, метотрексат. Через 12 недель терапии показатели значительно улучшились: ЧБС – 1/68, ЧПС – 2/66. После 144 недель терапии ЧБС – 0/68, ЧПС – 0/66, ВАШ – 8. Терапевтический эффект у больной был долгосрочным, через несколько месяцев достигнута стойкая ремиссия ревматоидного артрита (рис. 3).
Собрана доказательная база в отношении клинической эффективности сарилумаба при ревматоидном артрите в дозах 150 и 200 мг. Данные исследования MOBILITY подтверждают, что более высокая доза 200 мг обеспечивает клиническую и рентгенологическую эффективность терапии ревматоидного артрита31.
Следует учитывать возможные побочные эффекты терапии ингибиторами рецепторов ИЛ-6, к которым относятся инфекционные заболевания, повышение печеночных трансаминаз, нарушения липидного обмена, нейтропения и др. Для их предотвращения перед назначением и в ходе лечения сарилумабом необходимо проводить лабораторные исследования. Подсчет нейтрофилов и тромбоцитов, а также определение уровней аланинаминотрансферазы и аспартатаминотрансферазы должны осуществляться через четыре – восемь недель после начала лечения и затем каждые три месяца. Определять показатели липидного профиля также следует через четыре – восемь недель от начала лечения и затем каждые шесть месяцев. При обнаружении изменений в анализах дозу препарата можно снизить с 200 до 150 мг. Назначение сарилумаба следует избегать:
- в случае выявления у пациентов хронической или рецидивирующей инфекции;
- серьезных оппортунистических инфекций в анамнезе;
- других патологий, помимо ревматоидного артрита, ассоциированных с риском развития инфекционных заболеваний.
Кроме того, препарат не назначают пациентам с туберкулезом или живущим (пребывавшим) в эндемичных районах по туберкулезу или микозам.
Важным аспектом фармакотерапии является межлекарственное взаимодействие, в том числе на уровне изофермента цитохрома Р-450. Повышенная концентрация ИЛ-6 может снижать активность цитохрома. Поэтому при терапии ингибиторами ИЛ-6 необходимо осуществлять мониторинг эффективности (например, варфарина) или концентрации лекарственного препарата (теофиллина). Снижение эффективности также возможно при применении оральных контрацептивов и статинов.
Докладчик продолжил комментировать клинические случаи пациентов с ревматоидным артритом, включенных в новое многоцентровое открытое проспективное долгосрочное исследование эффективности и безопасности сарилумаба в реальной клинической практике (PROSARA).
Клинический случай 3. Женщина 32 лет с серопозитивным ревматоидным артритом. Исходные показатели в 2010 г.: РФ IgM – 80 Ед/мл, РФ IgA – 40 Ед/мл, АЦЦП – 30 Ед/мл. Предшествующее лечение: метотрексат перорально и подкожно, преднизолон. ЧБС – 23/28, ЧПС – 12/28, ВАШ – 100, DAS 28 – 7,9. Лечение было начато с комбинации метотрексата и цертолизумаба в мае 2017 г. Спустя шесть недель показатели воспалительного процесса улучшились: ЧБС – 2/28, ЧПС – 0/28, ВАШ – 20, DAS 28 – 2,7.
Однако через несколько месяцев было отмечено отсутствие ответа на лечение. ЧБС – 8/28, ЧПС – 3/28, ВАШ – 70, DAS 28 – 5,2. У больной наблюдались симптомы утренней скованности. Тошнота и рвота при лечении метотрексатом стали причиной снижения дозы препарата. На фоне приема нестероидных противовоспалительных препаратов ухудшились симптомы артериальной гипертензии. Дозу преднизолона увеличили до 10 мг/сут. Дальнейшее ухудшение симптомов ревматоидного артрита нарастало после отмены цертолизумаба. Было принято решение о назначении сарилумаба в дозе 200 мг подкожно один раз в две недели. Через четыре недели от начала монотерапии сарилумабом отмечена положительная динамика симптомов заболевания: ЧБС – 3/28, ЧПС – 2/28, ВАШ – 18, DAS 28 – 3,7, уровень С-реактивного белка (СРБ) – 6 мг/л. Дозу преднизолона снизили до 5 мг/сут. У больной развилась нейтропения легкой степени. Поскольку другие побочные эффекты отсутствовали и отмечалась положительная динамика, лечение было продолжено без коррекции дозы сарилумаба.
Клинический случай 4. Женщина 74 лет с ревматоидным артритом и сопутствующими заболеваниями (остеопороз, артериальная гипертензия, полинейропатия, трофические язвы). Исходные показатели от 1971 г.: РФ IgM – 135 Ед/мл, АЦЦП – отрицательный. Предшествующее лечение: сульфасалазин, метотрексат, адалимумаб, этанерцепт, секукинумаб, JAK-ингибиторы. В мае 2018 г. пациентке назначена терапия препаратами «лефлуномид + преднизолон» и эторикоксибом. На фоне терапии: ЧБС – 3/28, ЧПС – 5/28, ВАШ – 60, СРБ – 4 мг/л. В июле 2018 г. начата монотерапия сарилумабом. После восьми недель лечения наблюдалась высокая эффективность терапии: ЧБС – 0/28, ЧПС – 2/28, ВАШ – 21, СРБ – 4 мг/л. Данный клинический случай демонстрирует эффективность сарилумаба в лечении коморбидного пациента с ревматоидным артритом в режиме монотерапии.
В заключение профессор Е. Файст подчеркнул, что применение современного ингибитора рецепторов ИЛ-6 сарилумаба в лечении больных ревматоидным артритом позволяет подавить воспалительный процесс, снизить риск развития анемии, эрозий костной ткани, облегчить утомляемость и депрессию и, как следствие, повысить ожидаемую продолжительность жизни пациентов.
Заключение
На сегодняшний день перспективным направлением в лечении ревматических воспалительных заболеваний являются ГИБП, в частности ингибиторы рецепторов ИЛ-6. Результаты многочисленных исследований показали, что блокада рецепторов ИЛ-6 представляет собой эффективный метод лечения ревматоидного артрита. Их можно назначать пациентам с ревматоидным артритом и коморбидными заболеваниями.
Сарилумаб – полностью человеческое моноклональное антитело, которое связывает мембранный и растворимый рецепторы ИЛ-6. Своевременное назначение сарилумаба больным ревматоидным артритом может способствовать длительному контролю над воспалением и достижению устойчивой ремиссии заболевания. Сарилумаб имеет доказанный профиль безопасности и может применяться у пациентов с ревматоидным артритом после предшествующей неэффективной терапии сБПВП или ингибиторами ФНО-альфа.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.