Резистентность слизистой оболочки пищевода у больных ГЭРБ: диалог клинициста и морфолога
- Аннотация
- Статья
- Ссылки
- English
Обзор подготовлен с целью систематизации знаний об основных составляющих мукозального барьера пищевода, обеспечивающих резистентность слизистой оболочки в условиях ГЭРБ. Поиск литературы проводился в системах Embase, PubMed и Google Scholar по ключевым словам: гастроэзофагеальная рефлюксная болезнь, мукозальная защита, слизистая оболочка эпителия пищевода, белки плотных контактов, эпителиальная защита, эзофагопротекция. Акцент сделан на основных структурных и функциональных компонентах защиты слизистой оболочки пищевода.
Обзор подготовлен с целью систематизации знаний об основных составляющих мукозального барьера пищевода, обеспечивающих резистентность слизистой оболочки в условиях ГЭРБ. Поиск литературы проводился в системах Embase, PubMed и Google Scholar по ключевым словам: гастроэзофагеальная рефлюксная болезнь, мукозальная защита, слизистая оболочка эпителия пищевода, белки плотных контактов, эпителиальная защита, эзофагопротекция. Акцент сделан на основных структурных и функциональных компонентах защиты слизистой оболочки пищевода.
![Рис. 1. Этапы формирования пищевода Барретта и аденокарциномы пищевода (адаптировано из [20])](/upload/resize_cache/iblock/3d9/195_350_1/Matoshina1.jpg)
Рост заболеваемости гастроэзофагеальной рефлюксной болезнью (ГЭРБ), занимающей одну из лидирующих позиций по распространенности среди кислотозависимых заболеваний пищеварительного тракта, следует признать современной общемировой тенденцией [1]. Заболеваемость ГЭРБ среди всего взрослого населения составляет в Северной Америке 18,1–27,8%, в Южной Америке 23,0%, в Европе 8,8–25,9%. По данным эпидемиологических исследований, в России распространенность ГЭРБ во всей взрослой популяции оценивается от 11,3 до 23,6%, среди которых у 45–80% больных обнаруживают эзофагит, при этом распространенность факторов риска заболевания не отличается от общемировой [2–4].
Гастроэзофагеальная рефлюксная болезнь манифестирует пищеводными и внепищеводными симптомами. Важные морфологические изменения с развитием рефлюкс-эзофагита различной степени тяжести, формированием пищевода Барретта и ассоциированной с ним аденокарциномы проявляются на уровне мукозального барьера пищевода [1, 5]. Важное значение в диалоге клинициста и морфолога приобретает понимание молекулярно-клеточных механизмов обеспечения резистентности слизистой оболочки пищевода в условиях патологии при воздействии факторов риска ГЭРБ. На этой теоретической основе строится подбор схем индивидуализированной и персонифицированной терапии.
Настоящая публикация подготовлена с целью систематизации знаний об основных составляющих мукозального барьера пищевода, обеспечивающих резистентность слизистой оболочки в условиях ГЭРБ.
Механизмы резистентности слизистой оболочки при ГЭРБ
Гастроэзофагеальная рефлюксная болезнь – кислотозависимое заболевание, которое возникает и прогрессирует при первичном нарушении моторной функции верхних отделов пищеварительного тракта [1, 6]. Основными компонентами в патогенезе ГЭРБ признаны частота возникновения, а также продолжительность рефлюкса содержимого желудка, когда рефлюктат, включающий соляную кислоту, пепсин, а также дополнительно желчные кислоты и лизолецитин (в случае сопутствующего дуоденогастрального рефлюкса), забрасывается в вышележащие отделы пищеварительного тракта и оказывает повреждающее действие на слизистую оболочку пищевода [1, 7, 8].
Рассмотрим основные компоненты мукозального барьера, обеспечивающие резистентность слизистой оболочки пищевода в условиях ГЭРБ. Наиболее поверхностный, предэпителиальный уровень защиты образован слоем слизи, который нейтрализует поступившую кислоту и защищает плоскоклеточный эпителий пищевода от контакта с агрессивным рефлюктатом [9]. Его основными компонентами являются муцины, немуциновые протеины, бикарбонаты и небикарбонатные буферы, простагландин Е2, эпидермальный фактор роста, трансформирующий фактор роста альфа [7]. Предэпителиальный слой слизи отвечает за восстановление рН в просвете пищевода до нормальных показателей, что способствует защите пищевода от поступающего рефлюктата [1].
Основные защитные гликопротеины – муцины поступают в пищевод со слюной и секретируются собственными железами пищевода. Муцины присутствуют в секретируемой форме, образующей защитный слой над эпителием, и в мембранно-связанной форме, которая представляет собой часть гликокаликса и локализуется на поверхности клеток эпителия. Установлено, что агрессивные молекулы в составе рефлюктата, прежде всего соляная кислота, стимулируют секрецию муцинов MUC3 и MUC5AC. При этом повышение секреции муцинов ассоциировано с восстановлением протекторных свойств слизистой оболочки и, наоборот, существенно снижено в условиях прогрессирования эзофагита [9]. В связи с этим дополнительное повышение защитных характеристик предэпителиального барьера, например при помощи эзофагопротектора, может служить важным компонентом в терапии ГЭРБ.
К факторам предэпителиальной защиты также принято относить резидентную микробиоту, при том что ее популяция существенно меньше в сравнении с другими отделами пищеварительного тракта [10]. Данные о доминировании стрептококков и частом присутствии других таксонов, типичных для микробиоты ротоглотки, свидетельствуют о том, что микробиота пищевода в основном имеет оральное происхождение. В составе микрофлоры полости рта и глотки обнаруживается высокая распространенность стрептококков наряду с такими таксономическими единицами, как Veillonella, Fusobacterium, Gemella, Granulicatella и Rothia [11, 12]. В то же время не все бактерии, ассоциированные со слизистой оболочкой полости рта, могут колонизировать слизистую пищевода. Некоторые члены микробиоты пищевода отсутствуют или представлены в небольшом количестве в составе типичной микрофлоры полости рта. Таким образом, микрофлора пищевода существует как отдельная микробиологическая экосистема [10].
Следующей ступенью защиты выступает собственно слизистая оболочка пищевода, сформированная многослойным плоским неороговевающим эпителием. Он образован тремя слоями: поверхностным слоем клеток плоского эпителия, шиповатым слоем и слоем базальных клеток [13]. Базальный слой обычно представлен одним – тремя слоями клеток и состоит из незрелых клеток со сравнительно крупными ядрами и относительно небольшим объемом цитоплазмы. Эти клетки выполняют функцию источника обновления эпителиального пласта как единственные в пищеводном эпителии способные к делению с последующей миграцией дочерних клеток по направлению к его верхним слоям. Во время миграции ядра уменьшаются, после чего клетка попадает в слой поверхностно расположенных зрелых клеток [5].
В дополнение к компактному расположению клеток наличие слоя межклеточного гликокаликса также обеспечивает дополнительную защиту от проникновения компонентов агрессивного рефлюктата. Наиболее важный механизм формирования целостности эпителиального пласта включает особый молекулярный комплекс, который обеспечивает формирование клеточных контактов в поверхностном и шиповатом слоях. Подобная структура известна как апикальный соединительный комплекс. Он образует межклеточные контакты и регулирует диаметр межклеточного пространства, включая три основных компонента: белки плотных контактов, белки межклеточной адгезии и десмосомы [5, 9, 14].
В образовании межклеточных комплексов плотных контактов важную роль играют такие белки плотных контактов, как окклюдин (OCLN), зонулин и клаудины (преимущественно клаудин 1 (CLDN1), клаудин 2 (CLDN2), клаудин 4 (CLDN4)). Белки межклеточной адгезии представлены в основном Е-кадгерином и обеспечивают структурную целостность ткани. В многослойном плоском эпителии десмосомы не только изолируют клетки, но и выполняют белковый и ионный транспорт через межклеточные пространства. Десмосомы представлены десмосомными кадгеринами с межклеточными и внеклеточными доменами, которые регулируют скорость ионного обмена [9, 15].
Биопсийное исследование назначается нечасто при диагностике рефлюкс-эзофагита, но характерные гистологические признаки позволяют лучше понять суть изменений, происходящих в слизистой оболочке пищевода.
По данным исследования [16], гистологические изменения слизистой оболочки больных ГЭРБ связаны не только с повреждением ткани агрессивным рефлюктатом, но и с формированием в ней воспалительного инфильтрата. С одной стороны, повреждение, возникшее вследствие контакта слизистой оболочки с кислотой, стимулирует пролиферацию клеток базального слоя с увеличением числа его слоев (базальноклеточная гиперплазия). С другой стороны, воздействие кислоты и желчных солей стимулирует секрецию эпителиальными клетками провоспалительных цитокинов, в частности интерлейкинов 1, 6, 8, 10 и фактора некроза опухолей альфа, приводя к появлению Т-лимфоцитов и нейтрофилов в ткани. Провоспалительные цитокины, выделяемые эпителиоцитами, не только усиливают их повреждение, но и активируют мезенхимальные (в том числе фибробласты, миофибробласты, тучные клетки) и эндотелиальные клетки. При этом стимулируется выработка еще большего количества медиаторов воспаления с привлечением иммунных клеток, образуется замкнутый круг [5, 17].
Высвобождаемые иммунными клетками активные формы кислорода вступают в реакцию с окружающими белками и жирными кислотами мембран клеток, вызывая перекисное окисление липидов с развитием окислительного стресса. Повреждение апикальных соединительных комплексов и связанное с этим процессом снижение экспрессии белков плотных контактов и белков клеточной адгезии приводят к расширению межклеточных промежутков у пациентов с ГЭРБ. Этот дополнительный фактор снижения протективных свойств эпителиального барьера позволяет проникать агрессивным молекулам рефлюктата в более глубокие слои слизистой оболочки [5, 18]. Кроме того, в результате повреждения ДНК, РНК и липидов, вероятных специфических изменений генов и аберрантного метилирования промоторных участков генов изменяются функции ферментов и других белков, в том числе могут активироваться онкогенные белки и (или) ингибироваться белки-супрессоры опухоли [19]. Высокая пролиферативная активность эпителия сопровождается увеличением частоты ошибок репликации и способствует закреплению и распространению мутаций в клеточной популяции [5, 17].
Таким образом, совокупность воспалительных процессов, окислительного стресса и повышенной пролиферативной активности может создавать благоприятный фон для прогрессирования диспластических и неопластических изменений в слизистой оболочке, в том числе пищевода Барретта и аденокарциномы (рис. 1) [17, 20].
Согласно действующим клиническим рекомендациям, пациентам с ГЭРБ, рефрактерной к лечению ингибиторами протонной помпы (ИПП), необходимо проведение эзофагогастродуоденоскопии с биопсией и гистологическим исследованием биоптатов [1]. Для описания морфологических изменений биоптата, в том числе качественной оценки межклеточных расстояний, может быть использована световая микроскопия. Надежная верификация феномена расширенных межклеточных пространств возможна при использовании метода электронной микроскопии [5]. Применение иммуногистохимических методов позволяет оценить состояние белков межклеточных контактов [5].
Постэпителиальный уровень защиты обеспечивается кровоснабжением слизистой оболочки и механизмами поддержания кислотно-основного состояния ткани [7]. Ионные Н+-транспортеры располагаются базолатерально в клеточных мембранах эпителия пищевода и способны удалять избыток ионов водорода, повышая клеточный pH до нормальных значений [9]. Кровоток слизистой оболочки помимо обеспечения питательными веществами и кислородом доставляет бикарбонаты в ткань и удаляет побочные продукты метаболизма, в том числе ионы водорода, молочную кислоту и CO2. В ряде исследований показано компенсаторное увеличение кровоснабжения слизистой оболочки пищевода при воздействии на нее соляной кислоты [5, 21].
Современные принципы терапии ГЭРБ
Биопсийное исследование проводится в ограниченном числе случаев, в связи с чем правомерен вопрос о необходимости клиницисту данных о снижении резистентности слизистой оболочки при ГЭРБ. Если рассматривать в качестве целей терапии не только купирование симптомов, но и восстановление целостности слизистой оболочки, профилактику рецидивов заболевания, формирования пищевода Барретта и ассоциированной с ним аденокарциномы, требуется соблюдение минимально необходимого по длительности и основным компонентам курса лечения.
Назначение ИПП в качестве препаратов первой линии в лечении ГЭРБ не вызывает сомнений [1, 22, 23]. Эти препараты снижают агрессивность желудочного содержимого и уменьшают его объем, что способствует контролю симптомов заболевания, восстановлению резистентности слизистой оболочки пищевода и профилактике осложнений заболевания [23–25].
Вместе с тем монотерапия ИПП оказывается недостаточно эффективной у части пациентов, поэтому в схему терапии требуется включать дополнительные средства [26, 27]. Так, альгинаты необходимы для нейтрализации «кислотного кармана» при грыже пищеводного отверстия диафрагмы, а прокинетики – для восстановления моторики верхних отделов пищеварительного тракта [28–30].
К прорывам в лечении рефлюкс-эзофагита следует отнести появление нового класса средств терапии ГЭРБ – эзофагопротектора (Альфазокс). Препарат состоит из смеси низкомолекулярной гиалуроновой кислоты и низкомолекулярного хондроитина сульфата, которые растворены в биоадгезивном носителе (полоксамере 407) [1, 15, 31]. Эзофагопротектор обволакивает слизистую оболочку пищевода и ограничивает ее контакт с агрессивными молекулами рефлюктата [15, 31].
Помимо механической защиты компоненты Альфазокса – гиалуроновая кислота и хондроитина сульфат, являющиеся многофункциональными гликозаминогликанами, ускоряют репарацию и регенерацию эпителия слизистой оболочки пищевода, участвуя в процессах пролиферации, дифференциации и миграции клеток эпителия [31–33]. Гиалуроновая кислота также обладает ангиогенным действием и индуцирует экспрессию белков плотных контактов, повышая интенсивность восстановления молекулярно-клеточной структуры и барьерной функции эпителия пищевода, а хондроитина сульфат специфически связывается с биоактивными веществами, например пепсином, и ингибирует их активность [15, 32, 34].
Биоадгезивный носитель полоксамер 407 – гидрофильное поверхностно активное вещество с адгезивными свойствами доставляет действующие лекарственные вещества на поверхность слизистой оболочки пищевода и обеспечивает их пролонгированное высвобождение [35].
Клиническая эффективность Альфазокса при эрозивной и неэрозивной формах ГЭРБ была установлена в ряде клинических проспективных плацебоконтролируемых исследований [36, 37]. В 2017 г. были опубликованы результаты мультицентрового двойного слепого плацебоконтролируемого исследования, подтвердившие более высокую эффективность применения терапии ИПП в сочетании с эзофагопротектором, чем монотерапии ИПП, у пациентов с неэрозивной формой ГЭРБ [38].
Клинический опыт
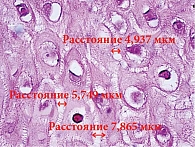
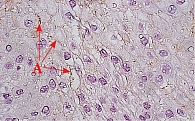
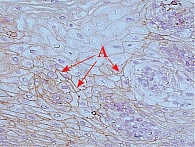
В ходе нашего клинического исследования получен опыт эффективной терапии ГЭРБ с применением комбинации ИПП и Альфазокса. В исследовании приняли участие 60 пациентов с эрозивным эзофагитом степеней C, D по Лос-Анджелесской классификации. Пациентов рандомно распределили по двум группам: основная группа принимала пантопразол и Альфазокс в течение четырех недель, а группа сравнения – только пантопразол в течение того же времени. Анализ морфологии слизистой оболочки пищевода (рис. 2) и уровня экспрессии клаудина 1 (рис. 3) подтвердил отсутствие различий в основной и контрольной группах до начала лечения.
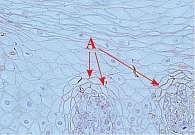
На контрольном визите, согласно предварительным данным исследования, у получавших Альфазокс пациентов выявлено более быстрое купирование клинических симптомов по сравнению с группой сравнения. Кроме того, в основной группе значимо более часто определялась фиксация положительной динамики с наступлением ремиссии по данным эндоскопии и наступала гистологическая ремиссия с увеличением индекса метки клаудина 1 (рис. 4 и 5).
Таким образом, эзофагопротектор Альфазокс как компонент комплексной терапии позволяет достичь клинической (купирование симптомов у большинства пациентов в первую неделю терапии), эндоскопической и гистологической ремиссии заболевания (на 50% чаще к окончанию четвертой недели терапии) у большинства пациентов с ГЭРБ, способствуя более быстрому и полному восстановлению мукозального барьера пищевода.
Накопленный опыт применения комбинированной терапии ИПП с включением эзофагопротектора позволит в будущем применять индивидуальный подход к пациенту и повысить эффективность лечения. Будет реализовываться принцип превенции, способствующий снижению рисков формирования пищевода Барретта и ассоциированной с ним аденокарциномы [31].
Заключение
Гастроэзофагеальная рефлюксная болезнь – распространенное, хорошо изученное заболевание. В литературе подробно описаны причины возникновения и патогенез патологических рефлюксов кислого и слабощелочного характера с учетом морфологических особенностей строения слизистой оболочки пищевода.
Вместе с тем установлено, что широко применяемая при ГЭРБ терапия ИПП в ряде случаев оказывается недостаточно эффективной. Морфологические изменения слизистой оболочки пищевода, приводящие к нарушению ее барьерной функции, служат одной из частых причин рефрактерности к терапии ИПП. Повысить эффективность терапии возможно с применением эзофагопротектора.
Информация о финансовой поддержке.
Грант Президента РФ для государственной поддержки ведущих научных школ (НШ-2558.2020.7) (соглашение № 075-15-2020-036 от 17 марта 2020 г.) «Разработка технологии здоровьесбережения коморбидного больного гастроэнтерологического профиля на основе контроля приверженности».
I.V. Matoshina, M.M. Fedorin, M.A. Livzan, PhD, Prof., S.I. Mozgovoy, PhD
Omsk State Medical University
Contact person: Maksim M. Fedorin, mail.maxim.f@gmail.com
Gastroesophageal reflux disease (GERD) is the most common of all acid-related diseases, it is recognized as the leading cause of esophageal adenocarcinoma. The natural factor of protection against aggressive refluxate components is the integrity of the esophageal mucosa, which performs a barrier function with the participation of a number of mechanical, chemical and immunological mechanisms. Their damage under the regular influence of acidic or mixed reflux causes the development of the pathological process.
The review was prepared to systematize knowledge of the main components of mucosal barrier of the esophagus providing resistance of mucosa under conditions of GERD. The literature was searched in Embase, PubMed, and Google Scholar using the keywords: gastroesophageal reflux disease, mucosal protection, esophageal mucosa epithelium, dense contact proteins, epithelial protection, esophagoprotection. The main structural and functional components of esophageal mucosal protection were emphasized.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.