Способы профилактики избыточного рубцевания фильтрационной подушки при проведении антиглаукомных операций с имплантацией дренажа клапанного типа Ahmed
- Аннотация
- Статья
- Ссылки
- English

Повышение эффективности лечения глаукомы остается одним из приоритетных направлений офтальмологической науки в связи с большой медико-социальной значимостью данного заболевания, высоким уровнем распространенности и тяжестью исходов, нередко ведущих к слепоте и инвалидности [1–3]. По данным проведенного Y.C. Tham и соавт. метаанализа, общее количество больных глаукомой во всем мире в 2020 г. составляет 76,0 млн человек, а к 2040 г. это число увеличится до 111,8 млн. Таким образом, число больных глаукомой в период с 2013 по 2040 г. возрастет на 74% [2].
Значительная роль в росте показателей инвалидизации принадлежит рефрактерной глаукоме (РГ), компенсация внутриглазного давления (ВГД) при которой является наиболее трудной задачей. Для рефрактерной глаукомы характерна тяжесть течения, как правило, резистентность к традиционным методам терапевтического и хирургического лечения, сравнительно быстрый переход в терминальную стадию, выраженный болевой синдром на фоне высокого ВГД, что значительно снижает качество жизни пациентов и в ряде случаев приводит к потере глаза как органа [1, 3].
При большом разнообразии подходов к лечению глаукомы (медикаментозный, лазерный, хирургический) только хирургический считается наиболее эффективным способом нормализации уровня ВГД и сохранения зрительных функций [1, 3]. В настоящее время одним из ведущих направлений хирургического лечения глаукомы признается дренажная хирургия, особенно после того, как мультицентровое рандомизированное клиническое исследование TVT (Tube versus Trabeculectomy) показало более высокую вероятность успеха и более низкую частоту повторных операций при хирургии трубчатого шунтирования по сравнению с трабекулэктомией с митомицином С (ММС) через пять лет наблюдения [4, 5]. Имплантат клапана Ahmed (New World Medical, США) представляет собой разработанный в 1993 г. дренаж клапанного типа [6], который показал свою безопасность и эффективность в снижении внутриглазного давления в ходе большого количества выполненных на протяжении двух десятилетий исследований [6–16]. Согласно исследованию AVB (Ahmed versus Barveldt Study) [14], в группе с имплантированным дренажем Barveldt 350 отмечался более высокий уровень хирургического успеха, чем в группе Ahmed-FP7 через год наблюдения, но в первой группе потребовалось большее количество повторных вмешательств, и спустя пять лет наблюдения отмечался более высокий риск связанных с гипотонией осложнений, угрожающих зрению [15]. Тем не менее исследование ABC (Ahmed Baerveldt Comparison Study) [16] продемонстрировало схожие показатели хирургического успеха между дренажами Baerveldt и Ahmed, однако имплантация клапана Ahmed ассоциировалась с меньшим количеством отказов вследствие осложнений спустя пять лет наблюдения. Метаанализ, сравнивающий клапанную дренажную систему (КДС) с имплантатом Baerveldt, показал меньшую частоту нежелательных явлений при имплантации дренажа клапанного типа Ahmed [17].
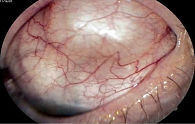
Следует отметить, что за последние десятилетия проведено множество клинических исследований, а также метаанализов, сравнивающих эффективность различных типов трубчатых дренажных устройств. Несколько авторов провели обзоры и не нашли доказательств превосходства одного типа трубчатого дренажа над другим в хирургическом лечении глаукомы [18–20], поэтому в этом обзоре рассматриваются данные литературы относительно способов повышения эффективности имплантации КДС посредством борьбы с избыточным рубцеванием, которое является наиболее частой причиной повышения ВГД и неуспеха вмешательства в послеоперационном периоде. Соединительнотканное капсулирование импланта вследствие локального воспалительного процесса из-за чрезмерного фиброза вокруг пластины КДС в процессе заживления послеоперационной раны, которое может возникать как в раннем, так и в позднем послеоперационном периоде [21–25], способно повысить сопротивление оттоку жидкости и привести к снижению эффективности операции. Избыточное рубцевание приводит к образованию инкапсулированного пузыря (рис. 1) и кисты фильтрационной зоны (рис. 2), которые выглядят как высокий ограниченный пузырь вокруг тела клапана. Одним из проявлений этого процесса является умеренное повышение ВГД (свыше 21 мм рт. ст.) на сроке от одного до трех месяцев после операции, то есть возникновение так называемой гипертензивной фазы (ГФ), свидетельствующее о завершении процесса образования резервуара, ограниченного фиброзной капсулой, не имеющей характера стойкой гипертензии. Снижение частоты и выраженности ГФ ассоциируется с более высокими показателями успеха операции и более благоприятной долгосрочной перспективой в отношении контроля ВГД. По данным литературы, частота ГФ с повторным повышением ВГД через 3–6 недель после имплантации КДС составляет от 30 до 82% [26–28].
На сегодняшний день нет единого мнения относительно лечения фиброзной инкапсуляции пластины клапана после имплантации КДС. При неуспехе имплантации КДС вследствие фиброзной инкапсуляции пластины авторами предложен ряд дополнительных вмешательств: выполнение нидлинга с 5-фторурацилом [29], хирургическое иссечение инкапсулированного пузыря [30], реимплантация КДС, ревизия клапана либо имплантация дополнительной КДС [13, 23]. Кроме того, ряд авторов отметили эффективность такой процедуры, как транспальпебральный пальцевой массаж глазного яблока [31, 32]. В частности, M. Smith и соавт. было проведено исследование, в ходе которого было выявлено положительное влияние данной процедуры на течение гипертензивной фазы после имплантации Ahmed с достижением 20%-ного снижения уровня ВГД у 50% пациентов [31]. На основании результатов более раннего исследования I. McIlraith и соавт. заявили о том, что массаж глазного яблока является безопасным и эффективным методом коррекции повышенного ВГД после имплантации КДС, который приводил к немедленному его снижению на 40% [32]. При этом среднее время до начала массажа составило 29 дней (диапазон – 8–141 день), а средняя общая продолжительность массажа – 127 дней (диапазон – 18–273 дня) [32].
Однако важным представляется применение дополнительных пособий для профилактики избыточного рубцевания в ходе самой операции имплантации КДС. Оказывая влияние на процессы воспаления и регенерации, можно значительно повысить прежде всего гипотензивный эффект хирургического лечения глаукомы. Следует отметить, что важным преимуществом КДС является то, что фильтрационная подушка при таком вмешательстве располагается дистальнее лимба, содержащего большое количество сосудов, а также стволовых клеток, что уменьшает риск сосудистых нарушений и вероятность рубцевания путей оттока. Кроме того, имплантация дренажа позволяет сформировать дополнительные пути оттока ВГЖ с минимальным повреждением лимбальной области, что улучшает долгосрочные результаты операции. Таким образом, выбор операции эксплантодренирования с имплантацией дренажа клапанного типа сам по себе направлен на профилактику избыточного рубцевания, частота которого при имплантации КДС значительно ниже, чем при трабекулэктомии, даже с применением антиметаболитов [33–35]. Что касается опыта применения антиметаболитов при имплантации КДС, несколько авторов не выявили повышения эффективности операции при адьювантном применении митомицина С (MMC) ни в краткосрочной, ни в среднесрочной перспективе наблюдения: было отмечено, что интраоперационное применение ММС во время имплантации КДС не предотвращает и не ингибирует образование рубцовой ткани вокруг пластины [36–37].
Недавно был описан новый метод предотвращения образования инкапсулированного пузыря у пациентов с рефрактерной глаукомой после имплантации КДС. Согласно этой новой методике, клапанную пластину заворачивают в тонкий слой хлопковой ткани, пропитанной MMC (0,25–0,33 мг/мл), а затем накладывают на область имплантации с последующим удалением ткани через две–пять минут и обильным промыванием операционного поля сбалансированным солевым раствором (BSS). Эффективность и инкапсуляция фильтрующего пузыря в соответствии с этой новой методикой составили соответственно 89,5 и 2,6%, в то время как в группе с традиционным методом они составили 70,7 и 19,5% соответственно [38]. J.A. Alvarado и соавт. оценили отдаленные результаты имплантации клапана Ahmed у пациентов с глаукомой при дополнительном интраоперационном применении MMC и послеоперационном введении 5-фторурацила (5-ФУ) и отметили высокие показатели успеха операции в течение шести лет наблюдения со снижением потребности в гипотензивной терапии на два препарата [39]. Однако повторные вмешательства в послеоперационном периоде неудобны и рискованны для пациентов из-за возможности вторичной инфекции в результате микроперфорации фильтрующего пузырька после введения иглы. Оптимальным представляется создание систем доставки лекарственных средств, которые могут быть установлены интраоперационно для доставки антиметаболитов на этапе заживления ран после имплантации дренажных устройств. Так, E. Schoenberg и соавт. [40] провели исследование двух интегрированных в КДС систем доставки лекарственных средств, а именно системы из небиоразлагаемого полимера (2-гидроксиэтилметакрилата) с MMC и биоразлагаемой системы из полимолочной и со-гликолевой кислот с 5-ФУ. Авторы сообщили о безопасной концентрации и характере высвобождения антиметаболита, уменьшении толщины фильтрующего пузыря и фиброзной капсулы.
В проведенном R.A. Mahdy (2011) рандомизированном исследовании по сравнению эффективности адьюватного применения бевацизумаба (интраоперационные инъекции вокруг пластины клапана) и ММС (однократная интраоперационная аппликация) в ходе имплантации КДС были получены значительно более высокие показатели общего успеха операции (80% для бевацизумаба и 90% для ММС) по сравнению с контрольной группой (60%). Однако автором подчеркивается, что применение бевацизумаба более безопасно и не сопровождается риском развития влияющих на зрительные функции осложнений [41]. Следует обратить внимание на тот факт, что если анализ целесообразности, эффективности и безопасности применения антиметаболитов в ходе имплантации КДС, по данным литературы, содержит элементы неоднозначности ввиду возможных связанных с применением антиметаболитов осложнений, то отношение к применению ингибиторов ангиогенеза единогласно положительное с повышением показателей хирургического успеха, продемонстрированным в ходе достаточно большого количества исследований [42–49]. При этом ингибиторы ангиогенеза вводятся как интравитреально [42–49] до и/или после имплантации, так и в переднюю камеру [50] и в зону оперативного вмешательства [41]. Согласно результатам ряда исследований, применение ингибиторов ангиогенеза при неоваскулярной глаукоме значительно улучшает долгосрочный эффект операции и прогноз по зрительным функциям [35, 42, 46] и ассоциировано с меньшей частотой таких осложнений, как гифема, гемофтальм, обнажение и окклюзия трубки и фиброзная инкапсуляция пластины [35], и в целом с более высоким процентом хирургического успеха [43, 49]. Систематические сравнительные обзоры адьювантного применения ингибиторов ангиогенеза после имплантации КДС показывают, что операция имплантации с интравитреальным введением ингибитора ангиогенеза (ИВВИА) ассоциирована с сопоставимым гипотензивным эффектом без ИВВИА, но с меньшей частотой таких осложнений, как гифема, гемофтальм и гипотония [43]. В долгосрочном периоде 18 месяцев отмечено достоверно меньшее количество применяемых препаратов при комбинированном лечении имплантацией КДС, панретинальной лазеркоагуляцией и ИВВИА [42]. Снижение риска возникновения гифемы является важным, потому как было показано, что она является фактором риска избыточного рубцевания [51], приводящим к неэффективности вмешательства.
Одним из наиболее популярных методов профилактики избыточного послеоперационного рубцевания признается применение кортикостероидов. Ввиду того что ключом к успешной имплантации КДС является контроль воспаления и предотвращение чрезмерного фиброза капсулы вокруг замыкательной пластины, в литературе широко обсуждается положительное влияние местных кортикостероидов на повышение показателя успеха операции и снижение риска осложнений в послеоперационном периоде. Применение сильнодействующих противовоспалительных препаратов, включая кортикостероиды (отдельно или в сочетании с нестероидными противовоспалительными препаратами) моделирует послеоперационное заживление ран, предотвращая сопротивление оттоку и снижая риск хирургических неудач [52]. Кортикостероиды подавляют воспаление вследствие снижения синтеза простагландинов из-за ингибирования фосфолипазы, препятствуя рекрутированию моноцитов и снижая аффинность связывания нейтрофилов в капиллярные эндотелиальные клетки [53, 54]. Кроме того, кортикостероиды ограничивают пролиферацию фибробластов, блокируя клеточный цикл в фазе G1 и предотвращая стимуляцию цитокинов [55]. Вместе эти функции уменьшают фиброз в процессе заживления раны, что способствует развитию более проницаемой капсулы вокруг концевой пластины и лучшему долгосрочному контролю ВГД [56]. В частности, в десятилетнем проспективном рандомизированном исследовании, сравнивающем пациентов, получавших 1%-ный преднизолона ацетат после трабекулэктомии, с пациентами, не получавшими противовоспалительные препараты [57], было показано, что применение преднизолона ацетата с постепенным снижением дозы через несколько недель после операции привело к лучшему контролю ВГД вследствие снижения формирования послеоперационного рубца наряду с лучшей стабилизацией структурных и функциональных показателей зрительного нерва. Местное применение кортикостероида после имплантации КДС позволило достичь более низкого ВГД через шесть месяцев с меньшим количеством антиглаукомных препаратов через год после операции, в связи с чем применение этих препаратов после имплантации КДС может быть полезным вследствие как улучшения клинических результатов, так и повышения приверженности лечению [58]. В исследовании S.H.Teixeira и соавт. сравнивали эффективность имплантации КДС в отсутствие и с применением триамцинолона ацетата в послеоперационном периоде: в результате отмечено достоверно более низкое среднее ВГД через месяц после операции при его применении [59].
С целью предотвращения образования инкапсулированных фильтрационных подушек, частота которых, по данным разных авторов, варьирует от 5 до 30% [60], рекомендовано оборачивание пластины клапана различными материалами. Так, С.А. Жаворонковым и соавт. предложена модификация техники имплантации КДС с использованием двух лоскутов мембраны из политетрафторэтилена, которыми с двух сторон покрывается пластина клапана. В ходе анализа послеоперационных результатов авторами были отмечены более высокие зрительные функции и более выраженный гипотензивный эффект у прооперированных по данной методике пациентов [61]. Рядом авторов проанализирована эффективность покрытия пластины клапана материалом Ologen (Aeon Astron Corporation, Тайвань) [62, 63], который представляет собой биоразлагаемую коллагеновую пористую матрицу, разработанную с целью замены MMC для трабекулэктомии [64]. Помещенный под конъюнктиву, он не только действует как резервуар, но также помогает механически отделить конъюнктиву от пластины клапана и предотвратить образование спаек между ними [64]. Этот метод направляет заживление раны на регенерацию тканей, а не на образование рубцов посредством влияния на процессы миграции фибробластов [64]. Однако проведенное M. Sastre-Ibáñez и соавт. исследование показало, что использование Ologen при имплантации КДС не обеспечивало лучшего контроля ВГД, меньшей потребности в антиглаукомных препаратах или более высоких показателей успеха, чем при обычной операции спустя год наблюдения [62]. В недавно опубликованном E.R. Suzuki и соавт. исследовании по изучению влияния коллагенового матрикса Ologen на результаты имплантации КДС было выявлено одинаковое снижение ВГД и количества принимаемых препаратов по сравнению с группой контроля в течение шестимесячного периода наблюдения с одинаковой частотой осложнений [63].
Известно применение в офтальмохирургии биоматериала «Аллоплант», обладающего свойствами стимулировать регенеративные процессы с возможностью коррекции фиброзных и дегенеративно-дистрофических процессов в тканях [65]. Аллоплант представляет собой изготавливаемый из трупного материала, свободный от гликозаминогликанов ацеллюлярный тканевой матрикс, на котором происходит рост клеток собственных тканей. Основным эффектом действия материалов серии Аллоплант является стимуляция регенерации тканей и дифференцировки клеточных элементов и, как следствие этого, снижение интенсивности образования рубцовой ткани [65]. Его низкие антигенные свойства, способность полностью резорбироваться не вызывают усиления воспалительной реакции в зоне повреждения. А.Ю. Расческовым для исключения контакта тела клапана с тканями глаза было предложено оборачивание пластины клапана «Аллотрансплантатом для пластики конъюнктивы (тотальным) № 000236», ФГБУ ВЦГПХ МЗ России (г. Уфа) под маркой АЛЛОПЛАНТ® (рис. 3) [66]. В ходе проведенных исследований было выявлено, что имплантация КДС с применением аллопланта позволяет повысить эффективность хирургического лечения глаукомы, что достигается благодаря увеличению количества путей оттока и одновременному снижению риска склеро-склерального и склеро-конъюнктивального рубцевания. Оборачивание клапана является важным элементом, позволяющим ограничить соприкосновение и прямой контакт силикона пластины с тканями глаза, и уменьшает вероятность образования плотной фиброзной капсулы вокруг пластины клапана вследствие образования лишь тонкой ограничительной мембраны между тканями организма и силиконовой пластиной клапана. Таким образом создаются условия для более легкой резорбции жидкости и уменьшения размеров формирующегося вокруг клапана пузыря. Оборачивание пластины клапана аллоплантом позволяет достичь более стабильного гипотензивного эффекта и уменьшения вероятности ограничения подвижности глазного яблока, способствует снижению необходимости в повторных вмешательствах. В результате проведенного исследования по оценке эффективности имплантации КДС с применением аллопланта была выявлена более низкая частота возникновения и выраженность гипертензивной фазы [67].
■■■
Проведенный анализ литературных данных позволяет сформулировать следующие основные положения. Несмотря на значительные успехи, достигнутые в ранней диагностике, медикаментозном и хирургическом лечении, глаукома остается одной из основных причин инвалидности по зрению, при этом компенсация внутриглазного давления представляется наиболее трудной задачей при рефрактерной глаукоме. До настоящего времени нет единого алгоритма выбора оптимальных методов снижения ВГД при рефрактерной глаукоме, позволяющих гарантированно добиться долгосрочного гипотензивного эффекта и стабилизации глаукомного процесса, однако имплантация клапанного трубчатого дренажа является наиболее эффективным видом вмешательства для снижения ВГД у пациентов с глаукомой, рефрактерной к медикаментозному, лазерному лечению или фистулизирующей хирургии, и, по данным литературы, обладает преимуществами перед другими методами лечения. С момента появления клапанной дренажной системы ее имплантация становится все более популярным видом вмешательства, а показания к ней расширяются. Наличие большого числа способов повышения эффективности антиглаукомной операции по имплантации дренажа клапанного типа Ahmed свидетельствует об отсутствии удовлетворения хирургов результатами операций по традиционной методике и стремлении добиться более пролонгированного гипотензивного эффекта со снижением частоты и выраженности осложнений. Результаты исследований эффективности и безопасности имплантации КДС отличаются широким диапазоном данных хирургического успеха и частоты осложнений, что указывает на огромное значение техники имплантации данного устройства. Наиболее эффективными способами профилактики избыточного рубцевания, по результатам опубликованных исследований, является применение ингибиторов ангиогенеза и кортикостероидов, массаж глазного яблока. Необходимо проведение последующих исследований для разработки дальнейших превентивных мер в целях повышения эффективности оперативного вмешательства и снижения риска возможных осложнений с достижением более пролонгированного гипотензивного эффекта, направленного на сохранение зрительных функций.
Авторы заявляют об отсутствии конфликта интересов.
A.Yu. Rascheskov, PhD, I.A. Loskoutov, PhD, A.V. Korneeva, PhD, A.F. Yafyasova, S.S. Strakhova
LLC ‘Eye surgery Rascheskov’
Moscow Regional Research and Clinical Institute
Branch Office of ‘Hadassah Medical Ltd’, Moscow
Contact person: Alexander Yu. Rascheskov, raskovclinic@mail.ru
Despite the significant progress made in early diagnosis and surgical treatment, glaucoma remains one of the main causes of visual blindness worldwide, while intraocular pressure compensation seems to be the most difficult task in refractory glaucoma. Implantation of Ahmed glaucoma valve (AGV) is the most effective type of intervention to reduce IOP in glaucoma patients and, according to the literature data, has advantages over other methods of treatment. However, encapsulated bleb formation may be observed following AGV implantation. This literature review contains available data analysis concerning the use of various pharmacological agents and features of the AGV implantation technique as methods of excessive scarring preventing to increase the effectiveness of surgical intervention in order to achieve more prolonged hypotensive effect aimed to preserve visual functions.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.