Школа по терапии инсульта. Межрегиональная научно-практическая конференция неврологов Санкт-Петербурга и Северо-Западного округа РФ «XIX Северная школа». Сателлитный симпозиум ЗАО «Фирма Евросервис»
- Аннотация
- Статья
- Ссылки
В рамках мероприятия, организованного при поддержке ЗАО «Фирма Евросервис», прозвучали доклады, посвященные современным методам лечения инсульта.
В рамках мероприятия, организованного при поддержке ЗАО «Фирма Евросервис», прозвучали доклады, посвященные современным методам лечения инсульта.




Терапия ишемического инсульта болюсным тромболитическим препаратом с фиксированной дозировкой. Рандомизированное клиническое исследование ФРИДА
Доклад главного невролога Комитета по здравоохранению Ленинградской области, заведующей неврологическим отделением для больных с острым нарушением мозгового кровообращения ГБУЗ «Ленинградская областная клиническая больница», к.м.н. Натальи Владимировны ЖУКОВСКОЙ был посвящен анализу результатов рандомизированного клинического исследования ФРИДА, в котором изучали свойства тромболитиков.
В исследовании приняли участие 336 пациентов и 137 врачей из 18 российских городов. Длительность наблюдения составила два года (с марта 2017 по март 2019 г.). Дизайн исследования предусматривал рандомизацию пациентов методом «конвертов» (блочная рандомизация). Принцип блочной рандомизации соответствовал принципу проведения исследования ECASS 2008 г. Было скринировано всего 385 пациентов, из них на две равнозначные группы Актилизе и Фортелизина рандомизировано 336 больных. Все они завершили исследование. Исследователи не имели доступа к рандомизационной последовательности и выбирали «конверт» исходя из последовательности включения пациента в исследование от наименьшего.
Первоочередным критерием включения пациентов в исследование служил верифицированный диагноз ишемического инсульта с давностью развития симптоматики не более 4,5 часа до начала тромболитической терапии. В исследовании участвовали мужчины и женщины в возрасте 18 лет и старше. Во втором варианте протокола указывалось, что к включению в исследование пациентов старше 80 лет необходимо подходить с осторожностью. Это соответствовало клиническим рекомендациям по тромболитической терапии ишемического инсульта 2017 г. Обязательным требованием было наличие подписанного датированного информированного согласия пациента на участие в исследовании, а также на использование надежных методов контрацепции во время исследования и в течение трех недель после его завершения.
Первичная конечная точка эффективности – хорошее функциональное восстановление на 90-й день после развития острого нарушения мозгового кровообращения (оценка по шкале Рэнкина 0–1 балл). Вторичная комбинированная конечная точка эффективности на 90-й день, кроме оценки по шкале Рэнкина 0–1 балл, включала индекс по Шкале инсульта Национального института здоровья (National Institutes of Health Stroke Scale, NIHSS) 0–1 балл и индекс Бартел 95 баллов и выше. Дополнительным критерием эффективности служил балл NIHSS через 24 часа и 90 дней от развития симптоматики.
Критерии оценки безопасности: смертность от всех причин на 90-й день, все случаи геморрагической трансформации. Отдельно фиксировались случаи симптомной геморрагической трансформации и количество серьезных нежелательных явлений и всех нежелательных явлений по органам и системам.
Сравниваемые препараты Актилизе и Фортелизин характеризуются тромболитическим действием и являются активаторами плазминогена, но имеют существенные различия. Актилизе (алтеплаза) – рекомбинантный человеческий тканевый активатор плазминогена (recombinant tissue plasminogen activator, rt-PA). Фортелизин – рекомбинантный белок, содержащий аминокислотную последовательность неиммуногенной стафилокиназы, состоит из 138 аминокислот. Молекула Актилизе более крупная, в ее состав входит свыше 500 аминокислот. Оба препарата реализуют тромболитическое действие через активацию плазминогена, превращая его в плазмин. Однако Актилизе взаимодействует как с альфа-, так и с гамма-плазминогеном, Фортелизин реализует свое действие только через гамма-плазминоген.
Способы введения и дозы исследуемых препаратов также различны. В ходе исследования препарат Фортелизин вводили внутривенно струйно, в виде однократного болюса в дозе 10 мг (два флакона), независимо от массы тела пациента. Что касается Актилизе, его доза зависит от массы тела, максимальная доза не должна превышать 90 мг. Введение 10% дозы Актилизе осуществляли струйно в течение одной минуты, затем 90% дозы – внутривенно инфузионно в течение 60 минут с помощью шприцевого дозатора/инфузомата.
Пациенты обеих групп по демографическим, антропометрическим, временным характеристикам от начала развития симптоматики до проведения тромболитической терапии и первичным неврологическим характеристикам были сравнимы и фактически идентичны. Незначительные отличия касались локализации ишемического очага. Так, в группе Фортелизина было больше пациентов с инсультом в бассейне правой средней мозговой артерии, а в группе Актилизе – пациентов с ишемическим инсультом в левой средней мозговой артерии и вертебробазилярном бассейне.
У пациентов с инсультом часто имеют место сопутствующие заболевания. В исследовании ФРИДА анализировали характеристики пациентов с инсультом по наличию сопутствующей патологии. В группе Фортелизина преобладали пациенты с ишемической болезнью сердца, мерцательной аритмией, в группе Актилизе – пациенты с сахарным диабетом. Кроме того, небольшие отличия отмечались в отношении подтипов ишемического инсульта: в группе Фортелизина превалировал кардиоэмболический инсульт, в группе Актилизе – атеротромботический.
Ведущим критерием оценки эффективности терапии, в соответствии с рекомендациями Европейской организации по борьбе с инсультом (European Stroke Organization, ESO) 2021 г., считается функциональный результат терапии, в том числе смерть по модифицированной шкале Рэнкина (mRS). В исследовании ФРИДА для определения эффективности препаратов приоритетной считалась оценка по шкале Рэнкина.
Анализ функциональных результатов исследования продемонстрировал, что в группе Фортелизина отличный функциональный исход (по шкале Рэнкина 0–1 балл) отмечался у 50% пациентов. В группе Актилизе аналогичный показатель составил чуть более 40%.
Фортелизин показал высокую эффективность. Через три месяца хорошая функциональная активность наблюдалась у 68,5% пациентов.
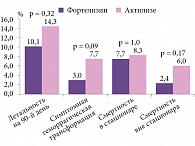
Кроме того, в группе Фортелизина на 90-й день от развития инсульта зафиксирована более низкая летальность по сравнению с группой Актилизе – 10,1 против 14,3% соответственно. При этом на фоне лечения Фортелизином зарегистрирована не только низкая летальность, но и низкий риск развития симптомной геморрагической трансформации (3%) (рис. 1).
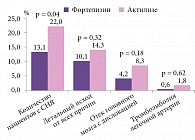
Исследователи проанализировали частоту серьезных нежелательных явлений на фоне тромболитической терапии. В группе Фортелизина таковые имели место в 13,1% случаев, в группе Актилизе – в 22%. Отмечалась существенная разница по количеству пациентов с отеком головного мозга и тромбоэмболией легочной артерии: в группе Фортелизина данные осложнения развивались почти в два реже (рис. 2).
Показатели эффективности Фортелизина в исследовании ФРИДА превысили данные ряда других рандомизированных исследований тромболитической терапии ишемического инсульта. Так, в группе Фортелизина достигнута не только первичная конечная точка. Высокие показатели эффективности наблюдались по всем оцениваемым градациям.
В рамках наблюдения анализировали эффективность и безопасность исследуемых препаратов в зависимости от локализации инсульта. Установлено, что у пациентов обеих групп с локализацией ишемического инсульта в бассейне правой средней мозговой артерии результаты терапии фактически сравнимы. У пациентов с поражением бассейна левой средней мозговой артерии эффективность Актилизе была чуть ниже по сравнению с Фортелизином – 37,5 против 51,3% соответственно. Отличный функциональный исход к 90-му дню лечения Фортелизином зафиксирован у 57,1% больных с локализацией инсульта в вертебробазилярном бассейне. В группе Актилизе только 35,3% пациентов достигли функционального восстановления к 90-му дню терапии (рис. 3).
Фортелизин продемонстрировал эффективность при всех подтипах ишемического инсульта по классификации TOAST (Trial of Org in Acute Stroke Treatment) со значимым преобладанием при лакунарном инсульте. К 90-му дню терапии отмечалось уменьшение частоты летальности на фоне применения Фортелизина у пациентов с атеротромботическим инсультом и инсультом неопределенной (множественной) этиологии. Летальные исходы среди пациентов с кардиоэмболическим инсультом в группах Фортелизина и Актилизе зарегистрированы в 15 и 22,2% случаев соответственно (рис. 4).
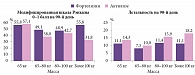
В целом Фортелизин в фиксированной дозе 10 мг продемонстрировал равнозначную эффективность у пациентов с разной массой тела, тогда как в группе препарата Актилизе, доза которого зависит от массы тела, такой равномерности в эффективности не наблюдалось (рис. 5).
Таким образом, в исследовании подтверждена гипотеза «не меньшей эффективности» (non-inferiority) Фортелизина по сравнению с препаратом Актилизе. Фортелизин признан безопасным по количеству смертельных исходов от всех причин и симптомной геморрагической трансформации к 90-му дню после острого нарушения мозгового кровообращения. В условиях клинической практики очевидно преимущество Фортелизина в силу отсутствия требований взвешивания, подключения инфузомата. Препарат вводится однократным болюсом в течение 10 секунд в дозе 10 мг независимо от массы тела пациента.
На основании данных исследования ФРИДА в инструкцию по применению препарата Фортелизин внесены дополнения. Теперь показанием к его назначению является не только острый инфаркт миокарда (в первые шесть часов), но и ишемический инсульт в первые 4,5 часа после возникновения симптомов заболевания.
В заключение Н.В. Жуковская подчеркнула, что новый отечественный фибринселективный тромболитический препарат Фортелизин зарекомендовал себя как эффективное и безопасное лекарственное средство. Безусловно, уникальные свойства препарата Фортелизин открывают большие перспективы для его применения в неврологической практике. Необходимо проведение дальнейших масштабных исследований возможностей препарата у больных с острым нарушением мозгового кровообращения.
Современная тромболитическая терапия – этапы развития методов реперфузии
Одним из методов специфического лечения инсульта является реперфузионная терапия, направленная на улучшение кровоснабжения области ишемического повреждения вещества головного мозга. В начале своего выступления анестезиолог, реаниматолог, заведующая отделением нейрореанимации ГБУЗ «Городская больница № 26» (Санкт-Петербург) Ольга Сергеевна КОКОЕВА рассказала об этапах развития методов реперфузии.
В 1933 г. W.S. Tillet впервые обнаружил фибринолитическую активность стрептококков. В ходе дальнейших исследований из культуры гемолитических стрептококков был получен фермент с фибринолитическими свойствами – стрептокиназа.
Первый опыт применения реперфузионной терапии при инфаркте миокарда и ишемическом инсульте относится к 1950–60-м гг. В 1961 г. по инициативе профессора Д.Г. Шефера были сформированы специализированные неврологические бригады скорой медицинской помощи для лечения больных с инсультом. С 1970-х гг. реперфузионную терапию начали проводить в домашних условиях.
Долгие годы возможности тромболитической терапии как метода лечения ишемического инсульта были ограниченны из-за отсутствия четкой клинической дифференциальной диагностики между ишемическим повреждением головного мозга и внутримозговым кровоизлиянием, являющимся противопоказанием к проведению тромболитической терапии. С появлением в 1974 г. первого компьютерного томографа открылись новые возможности для получения дополнительной информации о состоянии пациента. Это позволило усовершенствовать методы диагностики и лечения.
В 1976 г. профессор Е.И. Чазов впервые применил реперфузионную терапию при инфаркте миокарда, что ознаменовало начало нового этапа в лечении данного заболевания.
В 1983 г. был открыт рекомбинантный тканевый активатор плазминогена (rt-PA).
Активное изучение возможностей тромболитической терапии продолжалось в 1990-е гг. В 1992 г. признали необходимость обязательного проведения компьютерной томографии (КТ) головного мозга до начала реперфузионной терапии. В 1996 г. после появления результатов исследования NINDS Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило назначение реперфузионной терапии при ишемическом инсульте. NINDS было первым рандомизированным плацебоконтролируемым исследованием, результаты которого подтвердили эффективность и безопасность системной тромболитической терапии с использованием rt-PA в первые три часа от момента развития инсульта.
В Европе реперфузионная терапия была одобрена в 2002 г. после проведения рандомизированных плацебоконтролируемых исследований ECASS-1 и ECASS-2, в которых оценивали безопасность и эффективность применения rt-PA в разных дозах в течение шести часов от начала развития ишемического инсульта.
В России реперфузионная терапия при ишемическом инсульте была разрешена в 2005 г. В 2009 г. после завершения исследования ECASS-3 окно для реперфузионной терапии расширилось до 4,5 часа после инсульта. По данным исследования ECASS-3, применение rt-PA до 4,5 часа от начала заболевания увеличивает количество благоприятных функциональных исходов по сравнению с плацебо. На основании результатов исследования ECASS-3 были пересмотрены европейские и американские рекомендации по лечению ишемического инсульта, в частности увеличена продолжительность терапевтического окна до 4,5 часа. В Российской Федерации соответствующие изменения в инструкцию к препарату алтеплаза были внесены в 2011 г., после чего выполнение системной тромболитической терапии стало возможно в первые 4,5 часа после развития заболевания.
Следующим этапом развития методов реперфузии при ишемическом инсульте стало открытие в 2015 г. возможностей механической тромбэкстракции с использованием стент-ретриверов.
В настоящее время выделяют два наиболее эффективных метода реперфузии вещества головного мозга в первые часы заболевания, направленные на восстановление кровотока в пораженном сосуде, – химический и механический. Химическая реперфузионная терапия включает внутривенный тромболизис в виде болюсно-инфузионных и болюсных препаратов, механическая – тромбоэмболэктомию, тромбоаспирацию и тромбэкстракцию.
В феврале 2021 г. были опубликованы клинические рекомендации ESO с обновлениями, основанными на результатах последних исследований. По данным метаанализа, тромболизис существенно увеличивает шансы на отличный результат (отсутствие симптомов или инвалидизирующих симптомов с оценкой по mRS 0–1) через три месяца. При этом более раннее лечение (до трех часов) имеет значительное преимущество.
Показания для применения реперфузионной терапии расширяются. По мнению экспертов ESO, для пациентов с ишемическим инсультом длительностью 4,5–9 часов (при известном времени начала) и несоответствием ядра/перфузии, по данным КТ или магнитно-резонансной томографии (МРТ), которым механическая тромбэктомия не показана или не планируется, рекомендован внутривенный тромболизис. Реперфузионная терапия назначается при улучшении неврологической симптоматики, если сохраняется инвалидизирующий дефицит. Кроме того, эксперты не рекомендуют откладывать начало реперфузионной терапии в ожидании дальнейшего улучшения и эффекта тромболитической терапии перед проведением внутрисосудистой тромбэкстракции.
В рекомендациях ESO отражены показания для терапии пациентов с неизвестным временем начала инсульта. Пациентам с острым ишемическим инсультом после пробуждения ото сна при несоответствии данных МРТ в режиме DWI и FLAIR (выявление очага на МРТ в режиме DWI и его отсутствие в режиме FLAIR), которым механическая тромбэктомия не показана или не планируется, рекомендовано проведение внутривенного тромболизиса.
В обновленных европейских рекомендациях по лечению инсульта представлены рекомендации по уменьшению противопоказаний для тромболитической терапии. Так, пациентам старше 80 лет с острым ишемическим инсультом продолжительностью менее 4,5 часа разрешено проведение внутривенного тромболизиса. При этом внутривенный тромболизис также показан пациентам с острым ишемическим инсультом продолжительностью менее 4,5 часа с известной предынсультной гипертензией.
Кроме того, расширились показания к назначению антикоагулянтов. По мнению экспертов, пациентам с острым ишемическим инсультом продолжительностью менее 4,5 часа, которые использовали новые оральные антикоагулянты в течение последних 48 часов до начала инсульта и у которых активность анти-Ха менее 0,5 Ед/мл или тромбиновое время менее 60 секунд, следует назначать внутривенный тромболизис. В этом случае необходимо выполнить ряд обязательных требований, касающихся:
- сбора информации о факте получения антикоагулянтной терапии, конкретном получаемом препарате, времени приема последней дозы. При наличии у пациента выраженного неврологического дефицита в виде тотальной афазии на вопросы врача должен ответить родственник больного;
- срочного определения релевантных параметров системы гемостаза, отражающих наличие антикоагулянтного эффекта соответствующего препарата;
- оценки функции почек на фоне применения антикоагулянтов. Рекомендуемый метод оценки функции почек – клиренс креатинина по Кокрофту – Голту;
- выполнения внутривенного тромболизиса на фоне нормальной функции почек при наличии убедительных данных о том, что последняя доза препарата принята более 48 часов назад.
Расширяются показания к назначению тромболитической терапии в сторону уменьшения дефицита по NIHSS с 0 до 5 баллов. Пациентам с острым легким инвалидизирующим ишемическим инсультом продолжительностью менее 4,5 часа рекомендован внутривенный тромболизис. Необходимо помнить, что любой сохраняющийся неврологический дефицит впоследствии помешает пациенту выполнять основные повседневные или профессиональные обязанности1.
В отдельных случаях целесообразно рассмотреть возможность проведения внутривенного тромболизиса у пациентов с острым ишемическим инсультом продолжительностью менее 4,5 часа и тяжестью по NIHSS более 25 баллов.
Внутривенный тромболизис можно проводить пациентам с острым ишемическим инсультом продолжительностью менее 4,5 часа, у которых в момент начала инсульта наблюдались судороги, при условии, что исключена имитация инсульта или значительная травма головы. Тромболитическую терапию назначают, если есть основания предполагать, что судороги и неврологический дефицит связаны именно с острой ишемией.
Особого внимания заслуживает вопрос применения тромболитической терапии у коморбидных больных. В современных обновленных рекомендациях по лечению инсульта сказано, что внутривенный тромболизис можно проводить пациентам с острым ишемическим инсультом продолжительностью менее 4,5 часа с мультиморбидностью, слабостью или предынсультной инвалидностью. Однако применение тромболитической терапии у коморбидных пациентов имеет свои особенности и ограничения. Прежде всего они касаются пациентов с опухолями в полости черепа. При наличии опухолей, происходящих из клеток головного мозга, тромболитическая терапия противопоказана. В то же время опухоль, происходящая из клеток окружающих тканей, не является противопоказанием к назначению тромболитической терапии. Следует отметить, что проведение внутрисосудистой тромбэкстракции (ВСТЭ) возможно при любых опухолях в полости черепа.
Реперфузионная терапия разрешена при любом типе сахарного диабета и его осложнениях. При этом уровень гликемии должен находиться в пределах от 2,8 до 22,2 ммоль/л.
При сочетании инфаркта миокарда и ишемического инсульта тромболитическая терапия проводится в дозах, соответствующих протоколу ишемического инсульта, с последующим чрескожным коронарным вмешательством. Необходимо помнить, что тромболитическая терапия противопоказана при недавнем (три месяца) инфаркте миокарда.
Пациенты группы гемодиализа также имеют возможность получить тромболитическую терапию при нормальном активированном частичном тромбопластиновом времени. Выполнение ВСТЭ этим пациентам не противопоказано.
Как известно, особую группу пациентов в неврологической практике составляют беременные. В научных публикациях описано около 30 случаев применения методов тромболитической терапии у беременных. Частота осложнений была сопоставима с таковой у небеременных, неблагоприятного влияния на плод не отмечалось. Тем не менее, согласно российскому протоколу лечения инсульта, беременность – строгое противопоказание к назначению тромболитической терапии2.
При наличии показаний и отсутствии противопоказаний вводить тромболитик следует сразу после получения результатов КТ. Определение лабораторных показателей не должно препятствовать выполнению КТ-ангиографии (КТ-АГ) и/или старту тромболитической терапии, если нет клинических оснований подозревать противопоказания, исключаемые с помощью лабораторных тестов.
Конечно, в реальной клинической практике выполнение тромболитической терапии при проведении КТ сопряжено с некоторыми сложностями. В частности, в ряде кабинетов отсутствуют условия для разведения препарата, весы для взвешивания больного. Но современная анестезиология/реаниматология позволяет решить эти вопросы в считаные секунды.
КТ-АГ выполняется сразу после болюса тромболитика и одновременно с введением дозы препарата, если схема введения тромболитика предполагает последующую инфузию. КТ-АГ проводится по стандартной методике с учетом того, что должна быть визуализирована анатомия сосудов от дуги аорты до места тромбоза мозговой артерии.
Последнее десятилетие активно ведется поиск новых эффективных тромболитиков. С развитием тромбэктомии все более актуальной становится разработка болюсных тромболитических препаратов. Подтверждение тому – увеличение количества исследований и поиск дозировки тенектеплазы. Тенектеплаза имеет фармакологические преимущества перед алтеплазой: высокая фибринспецифичность, однократная болюсная инъекция.
В соответствии с рекомендациями ESO, пациентам с острым ишемическим инсультом продолжительностью менее 4,5 часа и окклюзией крупных сосудов, которые являются кандидатами на механическую тромбэктомию и которым перед тромбэктомией показан внутривенный тромболизис, рекомендовано проведение внутривенного тромболизиса с помощью тенектеплазы 0,25 мг/кг.
Накопленные данные показывают, что недостатком активации фибрином rt-PA является фронтоподобный лизис, при котором большая часть rt-PA связывается с первыми микрометрами фибринового сгустка. Как следствие, затрудняется проникновение rt-PA внутрь сгустка, утрачивается возможность лизиса всего сгустка. Такой неравномерный лизис может вызывать реокклюзию.
Отечественными учеными создан препарат генномодифицированной неиммуногенной стафилокиназы Фортелизин. Его молекула меньше молекулы алтеплазы в четыре раза и активируется гамма-плазминогеном и плазмином, что позволяет Фортелизину проникать глубоко в тромб. Благодаря этому свойству увеличивается скорость тромболизиса, а также снижается риск реокклюзии частичками тромба3.
Стафилокиназа относится к третьему поколению фибринолитических препаратов и характеризуется высокой фибринселективностью, болюсной дозировкой, быстрой реперфузией и высокой эффективностью и безопасностью (рис. 6). Она обладает уникальной фибринспецифичностью. Комплекс «стафилокиназа – плазминоген» работает только в присутствии фибрина. В отсутствие тромбоза комплекс быстро нейтрализуется альфа-2-антиплазмином и в таком виде продолжает циркулировать в кровотоке, сохраняя возможность активизации в присутствии фибрина.
Данные последних исследований подтверждают высокую фибринселективность Фортелизина по сравнению с другими тромболитическими препаратами, такими как стрептокиназа, Актилизе, Пуролаза, Метализе. Незначительное снижение фибриногена крови на фоне применения Фортелизина обусловлено его уникальным механизмом фибринолитического действия (рис. 7).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


