Синдром анемии в практике педиатра: дифференциальная диагностика и терапия
- Аннотация
- Статья
- Ссылки





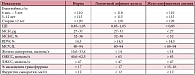
Основные механизмы развития анемий были выделены еще в 1930-е годы профессором М.П. Кончаловским: кровопотеря, усиленное кроверазрушение и нарушение кровообразования [2]. Данный патогенетический принцип лежит и в основе современной классификации анемических состояний, предложенной как отечественными, так и зарубежными авторами (табл. 1) [3–5]. Данная классификация действительно важна для определения тактики ведения пациентов, однако в практической работе дифференциальный диагноз анемии обычно начинается с анализа гемограммы. Большинство современных анализаторов в настоящее время позволяют врачу получить данные не только об уровне гемоглобина и количестве эритроцитов, но и оценить дополнительные параметры, характеризующие состояние «красной крови» (табл. 2).
В зависимости от цветового показателя, который обычно коррелирует с уровнем MCH, анемии могут быть разделены на гипо-, нормо- и гиперхромные (табл. 3). Средний объем эритроцитов свидетельствует о размерах красных клеток и позволяет разделить анемии на микро-, нормо- и макроцитарные (табл. 4) [3]. Еще одним информативным показателем для дифференциальной диагностики анемических состояний является уровень ретикулоцитов. В норме в периферической крови содержится 0,5–1% предшественников эритроцитов. Для арегенераторных состояний (апластическая анемия) характерно полное отсутствие ретикулоцитов в мазке крови. При гипорегенераторных анемиях (железодефицитная, В12-дефицитная, сидеробластная анемии) доля ретикулоцитов обычно составляет менее 0,5%, хотя может оставаться и в пределах нормы. Норморегенераторный характер анемии (ретикулоциты 0,5–2%) свидетельствует о нормальной способности костного мозга к усилению эритропоэза, что характерно для острых постгеморрагических анемий. К гиперрегенераторным анемиям относят практически все гемолитические анемии, при которых количество ретикулоцитов в периферической крови обычно превышает 2–5%. Еще более точным показателем эритропоэза является ретикулоцитарный индекс (РИ), который вычисляется по формуле:
- РИ = число ретикулоцитов (%) × гематокрит больного (%) / гематокрит в норме (%).
- В норме ретикулоцитарный индекс равен 1. При острой постгеморрагической анемии данный показатель повышается обычно в 2–3 раза, а при гемолизе – в 5–6 раз выше нормы.
Таким образом, определив характер анемии при первичном анализе гемограммы пациента, можно с довольно с высокой вероятностью определить возможную причину снижения гемоглобина и четко спланировать дальнейшие диагностические мероприятия с целью установления этиологии анемического состояния. Приводим несколько собственных наблюдений.
Клинический пример № 1 Мальчик Ф., 2 года 9 месяцев, находился в грудном инфекционном отделении Тушинской ДГБ с диагнозом: острая респираторная вирусная инфекция, острый левосторонний средний катаральный отит. Из анамнеза известно, что ребенок от первой беременности у женщины 27 лет, протекавшей с инфекцией мочевыводящих путей в третьем триместре, в связи с чем пациентка получала Канефрон. Роды срочные, физиологические. Вес ребенка при рождении 3890 г, длина тела – 56 см. Оценка по шкале Апгар 8/8 баллов. На грудном вскармливании до 1 года 9 месяцев. Прикорм введен с 4 месяцев (овощное пюре домашнего приготовления, каши инстантные). Острыми респираторными заболеваниями до 2 лет ребенок болел 3–4 раза в год в легкой форме. За 2 месяца до госпитализации пациент отдыхал с родителями в Турции. После возвращения в Москву у ребенка отмечалось 4 эпизода острой респираторной инфекции, рецидивирующее течение отита. Очередной эпизод повышения температуры стал поводом для госпитализации в стационар. Данные осмотра ребенка при поступлении в отделение: состояние средней тяжести, температура тела 38 ºС.
Отмечаются симптомы интоксикации в виде вялости, быстрой утомляемости, снижения аппетита. Кожные покровы и видимые слизистые бледные, чистые от сыпи. Периферические лимфоузлы пальпируются в основных группах, мелкие, подвижные, безболезненные. Дыхание в легких везикулярное, проводится симметрично во все отделы. Тоны сердца удовлетворительной звучности, ритмичные, нежный систолический шум на верхушке сердца. Печень пальпируется по краю реберной дуги. Физиологические отправления в норме. Показатели гемограммы: Hb 71г/л, эритроциты 2,43 × 1012, ЦП 0,88, МСV 75 fL, MCH 30 pg, RDW 14%, ретикулоциты 0,4%, тромбоциты 135 тыс., лейкоциты 2,1 тыс., п/я 6%, с/я 9%, лимфоциты 81%, эозинофилы 1%, моноциты 3%, СОЭ 35 мм/ч. Результаты клинического анализа крови позволили диагностировать наличие у ребенка нормохромной нормоцитарной гипорегенераторной анемии средней степени тяжести, сопровождающейся лейкопенией, нейтропенией, тромбоцитопенией, что указывает на вероятное вовлечение в патологический процесс костного мозга. Данная гемограмма с учетом возраста ребенка, указаний на предшествовавшую заболеванию повышенную инсоляцию, рецидивирующее течение инфекционных заболеваний требует обязательного исключения гематоонкологического заболевания (дебюта острого лейкоза). В отделении ребенку были проведены дополнительные исследования:
- в биохимическом анализе крови железо сыворотки, ферритин, общая железосвязывающая способность сыворотки крови и содержание фолиевой кислоты находились в пределах возрастной нормы;
- при ультразвуковом исследовании брюшной полости выявлена умеренная гепатоспленомегалия, увеличение лимфоузлов в воротах печени до 6 мм в диаметре;
- результаты обследования на ВИЧ, гепатиты В и С, цитомегаловирус, герпес 1, 2 типа, вирус Эпштейна –Барр – отрицательные;
- была проведена стернальная пункция, на основании анализа результатов которой у ребенка был диагностирован острый лимфобластный лейкоз, а выявленная анемия была проявлением основного заболевания.
Клинический пример № 2 Мальчик М., 1 год 5 месяцев, находился в грудном инфекционном отделении Тушинской ДГБ с диагнозом: острое респираторное заболевание, острая правосторонняя пневмония микоплазменной этиологии. Госпитализирован в отделение на 10-е сутки от начала заболевания с жалобами на повышение температуры до 38–38,5 ºС, непродуктивный кашель, вялость. В дебюте заболевания отмечались явления острого ринита, повышение температуры до фебрильных цифр, появление и усиление сухого кашля. Амбулаторно получал азитромицин (3 дня), ко-амоксиклав (5 дней) без стойкого положительного эффекта, что послужило поводом к госпитализации. Данные осмотра при поступлении в отделение: состояние ребенка средней тяжести, температура 38 ºС. Отмечаются симптомы интоксикации: вялость, плаксивость, негативная реакция на осмотр, отказ от еды. Кожные покровы бледные, чистые. Слизистые ротоглотки умеренно гиперемированы. В легких жесткое дыхание, незначительно ослаблено в нижних отделах справа. Сердечная деятельность удовлетворительная. Живот мягкий, безболезненный, печень по краю реберной дуги, селезенка не пальпируется. Стул ежедневный, дизурии нет.
Показатели гемограммы в первые сутки госпитализации: Hb 100 г/л, эритроциты 3,0 × 1012, ЦП 1,0, МСV 72 fL, MCH 29 pg, RDW 13,5%, ретикулоциты 2%, тромбоциты 209 тыс., лейкоциты 11,5 тыс., с/я 65%, лимфоциты 26%, моноциты 9%, СОЭ 51 мм/ч. На вторые сутки госпитализации у ребенка отмечалось ухудшение состояния в виде нарастания вялости, усиления бледности и появления желтушности кожных покровов. Моча приобрела темную окраску. В контрольном анализе крови: Hb 65 г/л, эритроциты 2,3 × 1012, ЦП 0,85, МСV 75 fL, MCH 30 pg, ретикулоциты 2,5%, тромбоциты 230 тыс., лейкоциты 15,7 тыс., с/я 65%, лимфоциты 28%, моноциты 7%. На основании анализа клинического исследования крови у ребенка была диагностирована нормохромная нормоцитарная гиперрегенераторная анемия тяжелой степени, что в сочетании с клиническими данными (появление иктеричности кожных покровов, потемнение мочи) позволило установить ее гемолитический характер. По результатам дополнительно проведенных исследований было выявлено:
-
в биохимическом анализе крови: повышение уровня аспаратаминотрансферазы (АСТ) 114 ел/л, общего билирубина80 мкмоль/л, прямого билирубина 16 мкмоль/л, лактатдегидрогеназы (ЛДГ) 3049 ед/л;
- на рентгенограмме органов грудной клетки выявлена легкая инфильтрация в нижних отделах справа без четких контуров, усиление легочного рисунка;
- серологическое обследование на инфекции выявило наличие в диагностическом титре антител класса IgM к Mycoplasma pneumoniae.
Ребенку были назначены кларитромицин из расчета 15 мг/кг/сут, муколитики, гормональная терапия (преднизолон из расчета 1 мг/кг/сут). В связи с резким снижением уровня гемоглобина проведено переливание эритроцитарной массы. На фоне проводимой терапии состояние ребенка стабилизировалось, пневмония разрешилась, бледность кожных покровов уменьшилась, иктеричность исчезла. В контрольном клиническом анализе крови: Hb 103 г/л, эритроциты 3,9 × 1012, ЦП 0,79, МСV 72 fL, MCH 27 pg, ретикулоциты 4%, тромбоциты 337 тыс., лейкоциты 22,9 тыс., с/я 35%, лимфоциты 58%, моноциты 7%, СОЭ 3 мм/ч. В данном анализе, наряду с повышением уровня гемоглобина, отмечается рост количества ретикулоцитов, лейкоцитов, тромбоцитов, что свидетельствует об активной гемопоэтической функции костного мозга и подтверждает гиперрегенераторный характер анемии. После купирования пневмонии ребенок был переведен в гематологическое отделение Измайловской ДГКБ для дообследования и уточнения характера гемолитической анемии.
Клинический пример № 3 Мальчик В., 1 год, госпитализирован в грудное инфекционное отделение Тушинской ДГБ с клиникой острой респираторной вирусной инфекции, жалобами на повышение температуры до 39 ºС, насморк. Из анамнеза известно, что мальчик от женщины 30 лет, от первой беременности, протекавшей физиологически. У матери с 2004 года диагностирована железодефицитная анемия (снижение гемоглобина до 90 г/л), в связи с которой она нерегулярно получала короткие курсы препаратов железа с нестойким положительным эффектом. Роды срочные, физиологические. Вес ребенка при рождении – 3400 г, рост – 52 см, оценка по шкале Апгар – 8/9 баллов. С рождения мальчик находился исключительно на грудном вскармливании, прикорм введен с 6 месяцев с использованием продуктов только домашнего приготовления. До 1 года ребенок не болел. Профилактические прививки не проведены в связи с отказом родителей. Аллергоанамнез не отягощен. Настоящее заболевание началось остро за 2 дня до поступления в стационар с повышения температуры до фебрильных значений, появления насморка. Стойкое повышение температуры, несмотря на проводимое симптоматическое лечение и прием жаропонижающих препаратов, послужило поводом для госпитализации в стационар. Данные осмотра при поступлении: состояние ребенка средней тяжести, симптомы интоксикации выражены умеренно. Кожные покровы бледные, чистые. Выражены катаральные явления. В легких хрипы не выслушиваются. Тоны сердца звучные, нежный систолический шум на верхушке. Печень и селезенка не увеличены. Физиологические отправления в норме.
Показатели гемограммы: Hb 83 г/л, эритроциты 3,4 × 1012, ЦП 0,73, МСV 50 fL, MCH 24 pg, MCHC 30,25%, RDW 16,5%, ретикулоциты 0,2%, тромбоциты 380 тыс, лейкоциты 9,9 тыс, с/я 46%, лимфоциты 48%, моноциты 6%, СОЭ 11 мм/ч. Результаты проведенного анализа свидетельствуют о наличии у ребенка гипохромной микроцитарной гипорегенераторной анемии, что в сочетании с данными анамнеза позволяет предполагать ее железодефицитный характер. В биохимическом анализе крови отмечается снижение уровня сывороточного железа 3,3 мкмоль/л, ферритина 40 нг/мл, повышение ОЖСС 65 мкмоль/л. Анализ мочи, исследование кала на скрытую кровь, ультразвуковое исследование брюшной полости патологии не выявили. Таким образом, у мальчика была диагностирована железодефицитная анемия средней степени тяжести. После купирования симптомов ОРВИ ребенок был выписан домой с рекомендацией приема препаратов железа. Терапия анемических состояний не должна заключаться лишь в попытках нормализации уровня гемоглобина. Как видно из представленных клинических примеров, в первом и втором случаях дети нуждались в специализированном гематологическом обследовании и лечении. Несвоевременная постановка диагноза и назначение препаратов железа этим пациентам могли бы привести к прогрессированию основного заболевания и ухудшению прогноза для ребенка. Тем не менее следует отметить, что гематоонкологические заболевания и гемолитические анемии в практике педиатра встречаются не очень часто, а в большинстве случаев врачу приходится сталкиваться именно с железодефицитными анемиями.
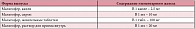
По данным ВОЗ, железодефицитные состояния занимают первое место среди 38 наиболее распространенных заболеваний человека и охватывают более 3 млрд людей на Земле. В России, по различным данным, железодефицитная анемия регистрируется у 6–40% детского населения [6, 7]. Среди основных причин дефицита железа у детей выделяют недостаточное поступление микроэлемента с пищей (алиментарный дефицит железа), повышенную потребность организма в железе в связи с быстрыми темпами роста ребенка, чрезмерной прибавкой в весе, сниженную абсорбцию микроэлемента, а также потери железа (носовые, маточные, желудочно-кишечные, почечные кровотечения) [7, 8] (табл. 5). Значимость каждой из перечисленных причин железодефицитной анемии меняется в зависимости от возрастного периода. Известно, что первоначальные запасы железа у ребенка создаются благодаря его антенатальному поступлению через плаценту от матери. Наиболее интенсивно этот процесс протекает, начиная с 28–32-й недели гестации. При неосложненном течении беременности плод получает от матери около 300 мг железа [9]. Патологическое течение беременности, сопровождающееся нарушениями маточно-плацентарного кровотока и плацентарной недостаточностью, приводит к уменьшению поступления железа в организм плода [10]. Пренатальная потеря железа наблюдается при трансплацентарной трансфузии или инфузии крови плода в систему кровообращения близнеца. Перинатальные потери железа отмечаются при отслойке плаценты, высоком поднятии новорожденного над операционной раной при извлечении его путем операции кесарева сечения [10].
В раннем возрасте основными причинами сидеропении являются повышенная потребность активно растущего организма в железе, сочетающаяся с истощением антенатальных запасов микроэлемента и недостаточным его поступлением с продуктами питания. Как известно, к моменту удвоения массы тела ребенка (5–6 месяцев) антенатальные запасы железа в его организме истощаются. С этого периода организм ребенка становится абсолютно зависимым от количества элемента, поступающего с пищей. Однако следует отметить, что рацион питания детей раннего возраста не всегда способен удовлетворить потребности ребенка в данном микроэлементе, особенно в условиях домашнего приготовления продуктов прикорма. В 5–12 лет увеличивается значимость потерь железа. Это происходит в случае глистной инвазии (анкилостома, некатор, власоглав), лямблиоза, эрозивного или язвенного процесса в желудке и двенадцатиперстной кишке, при геморрое, трещинах прямой кишки, кровянистой диарее, гастроинтестинальной форме пищевой аллергии, сосудистых аномалиях желудочно-кишечного тракта, частых носовых кровотечениях, травмах, хирургических вмешательствах, обильных менструациях [7, 11].
Своевременное выявление и коррекция сидеропенических состояний у детей раннего возраста имеет важное значение в связи с тем, что дефицит железа в первые годы жизни способен оказать негативное влияние на процессы постнатального формирования центральной нервной системы и может иметь отдаленные последствия для развития ребенка [12, 13]. Имеются данные, что при дефиците железа дети первых лет жизни имеют более низкие индексы психомоторного развития в соответствии со шкалой Бейли, чем их здоровые сверстники [14]. Дефицит железа приводит к снижению памяти, способностей к обучению, концентрации внимания, задержке речевого развития и снижению физической активности [15]. Следует отметить, что изменения со стороны центральной нервной системы могут развиваться уже на стадии латентного дефицита железа и сохраняться в течение длительного времени даже при проведении адекватной терапии. Наиболее убедительные исследования, подтвердившие существование отсроченных неблагоприятных эффектов дефицита железа в раннем возрасте, были выполнены B. Lozoff и соавт. [16, 17]. Результаты впервые были опубликованы в 1987 году и представляли данные наблюдений за группой детей с железодефицитной анемией из Коста-Рики (Центральная Америка) [16].
Для оценки развития детей применяли шкалу Бейли, при этом определенные индексы фиксировались до начала исследования, через неделю и через 3 месяца после назначения препаратов железа. У детей с ЖДА исходно сумма баллов по шкале Бейли была ниже по сравнению с контрольной группой, даже с учетом других факторов, способных влиять на психомоторное развитие. Спустя 3 месяца ни у одного ребенка, у которого анемия была излечена, не было получено низкой оценки при тестировании. Однако у тех детей, у которых до лечения определялся выраженный дефицит железа, сохранившийся на фоне терапии, несмотря на восстановление уровня гемоглобина, индексы развития в соответствии со шкалой Бейли остались сниженными, что могло свидетельствовать об отдаленных последствиях дефицита микроэлемента. При дальнейшем катамнестическом наблюдении за данной группой детей в течение 10 лет продемонстрировано, что тяжелая хроническая недостаточность железа в раннем возрасте проявляется в виде задержки развития и изменения поведенческих реакций даже спустя продолжительное время после лечения препаратами железа. Дети с тяжелым дефицитом железа в первые годы жизни имели определенные трудности при учебе в школе и нуждались в дополнительной помощи для повышения успеваемости [17].
В таблице 6 представлены лабораторные критерии дефицита железа [7]. Целью терапии железодефицитных состояний является устранение дефицита железа и восстановление его запасов в организме. Добиться этого можно только при устранении причины, лежащей в основе ЖДА, и одновременном возмещении дефицита железа в организме. Планирование рациона питания ребенка и обогащение его продуктами, содержащими хорошо усваиваемое гемовое железо, является неотъемлемой частью комплексной терапии сидеропенических состояний. Однако следует иметь в виду, что полноценная и сбалансированная по основным ингредиентам диета позволяет лишь обеспечить физиологическую потребность организма в железе, но не устранить его дефицит. Следовательно, выявление железодефицитного состояния у ребенка является показанием к назначению медикаментозной терапии препаратами железа. Выбору препарата для коррекции сидеропении придается особое значение, поскольку длительность лечения может составлять от нескольких недель до нескольких месяцев. При этом важна не только эффективность, но и отсутствие побочных эффектов и осложнений, приверженность к проводимой терапии, особенно в педиатрической практике. В настоящее время препараты железа разделяют на две группы:
- ионные железосодержащие препараты (солевые соединения железа);
- неионные соединения, к которым относятся препараты, представленные гидроксидполимальтозным комплексом трехвалентного железа.
К основным требованиям, предъявляемым к препаратам железа для приема внутрь, следует отнести следующие [7]:
- достаточная биодоступность;
- высокая безопасность;
- хорошие органолептические характеристики;
- различные лекарственные формы, удобные для пациентов всех возрастов;
- комплаентность.
