Сравнение эффективности ингибиторов дипептидилпептидазы 4 в достижении целевого уровня гликированного гемоглобина: систематический обзор и сетевой метаанализ
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведен систематический обзор и сетевой метаанализ рандомизированных клинических исследований (РКИ). В обзор включены сравнительные исследования эффективности ингибиторов ДПП-4 (глиптинов) и плацебо, а также комбинации ингибиторов ДПП-4 с метформином и метформина в виде монотерапии у пациентов с СД 2 типа. Конечной точкой эффективности выбран процент достигших целевого уровня HbA1с. Размер эффекта представлен в виде логарифмической шкалы отношения шансов (ОШ). Рассматриваемые препараты ранжированы исходя из значений площади под кумулятивной кривой распределения (surface under the cumulative ranking curve, SUCRA).
Результаты. Статистическому анализу подверглись данные 38 РКИ ситаглиптина, вилдаглиптина, саксаглиптина, линаглиптина, алоглиптина, гозоглиптина, эвоглиптина. Установлено статистически значимое преимущество алоглиптина в виде монотерапии (ОШ по сравнению с плацебо – 5,77), а также в виде комбинации с метформином как в общей популяции (ОШ по сравнению с метформином – 7,45), так и в популяции наивных и не наивных пациентов с СД 2 типа (ОШ по сравнению с метформином – 2,84 и 12,61 соответственно). При расчете SUCRA наиболее высокий рейтинг среди ингибиторов ДПП-4 также получен для алоглиптина во всех подгруппах.
Заключение. Алоглиптин превосходит другие ингибиторы ДПП-4 в виде монотерапии, а также в виде комбинированной терапии с метформином в отношении достижения целевого HbA1c как в общей популяции, так и в популяции наивных и не наивных больных СД 2 типа.
Материал и методы. Проведен систематический обзор и сетевой метаанализ рандомизированных клинических исследований (РКИ). В обзор включены сравнительные исследования эффективности ингибиторов ДПП-4 (глиптинов) и плацебо, а также комбинации ингибиторов ДПП-4 с метформином и метформина в виде монотерапии у пациентов с СД 2 типа. Конечной точкой эффективности выбран процент достигших целевого уровня HbA1с. Размер эффекта представлен в виде логарифмической шкалы отношения шансов (ОШ). Рассматриваемые препараты ранжированы исходя из значений площади под кумулятивной кривой распределения (surface under the cumulative ranking curve, SUCRA).
Результаты. Статистическому анализу подверглись данные 38 РКИ ситаглиптина, вилдаглиптина, саксаглиптина, линаглиптина, алоглиптина, гозоглиптина, эвоглиптина. Установлено статистически значимое преимущество алоглиптина в виде монотерапии (ОШ по сравнению с плацебо – 5,77), а также в виде комбинации с метформином как в общей популяции (ОШ по сравнению с метформином – 7,45), так и в популяции наивных и не наивных пациентов с СД 2 типа (ОШ по сравнению с метформином – 2,84 и 12,61 соответственно). При расчете SUCRA наиболее высокий рейтинг среди ингибиторов ДПП-4 также получен для алоглиптина во всех подгруппах.
Заключение. Алоглиптин превосходит другие ингибиторы ДПП-4 в виде монотерапии, а также в виде комбинированной терапии с метформином в отношении достижения целевого HbA1c как в общей популяции, так и в популяции наивных и не наивных больных СД 2 типа.

Введение
Темпы распространения сахарного диабета (СД) 2 типа вызывают обеспокоенность медицинского сообщества. По состоянию на 2024 г., в Российской Федерации количество лиц с установленным диагнозом СД 2 типа превысило 4,8 млн, что составляет более 3200 больных на 100 тыс. населения [1]. Наибольшее число случаев приходилось на возрастную группу от 65 до 69 лет [2].
Известно, что при СД 2 типа развивается комплекс осложнений, обусловленных поражением микро- и макрососудов [3]. В настоящее время доказана связь нарушения углеводного обмена с развитием ожирения, артериальной гипертензии, дислипидемии [4]. Длительное течение СД 2 типа ассоциировано с повышенным риском развития ишемической болезни сердца. Так, при длительности СД 2 типа до пяти лет ишемическая болезнь сердца отмечалась у 5,80% больных, более 15 лет – у 29,45% [5]. Согласно данным экспертов Американской кардиологической ассоциации, к наиболее частым сердечно-сосудистым осложнениям диабета относятся сердечная недостаточность, нефатальный острый инфаркт миокарда и ишемический инсульт [6].
Исходя из сказанного выше, лечение СД 2 типа должно быть максимально эффективным. Для оценки эффективности применяются разные показатели, в первую очередь уровень гликированного гемоглобина (НbA1c). Согласно современным рекомендациям, для большинства пациентов целевым считается уровень НbA1c менее 7%, достигаемый без выраженной гипогликемии, что позволяет снизить риск развития и прогрессирования микрососудистых осложнений [7]. Однако данные реальной клинической практики свидетельствуют о том, что только у 50% пациентов удается достичь уровня НbA1c менее 7% [2]. Поэтому сохраняет актуальность проблема подбора режима сахароснижающей терапии, способствующего раннему достижению гликемического контроля и длительному удержанию HbA1c в целевых значениях, а также обеспечивающего высокую степень безопасности в отношении гипогликемии.
Ингибиторы дипептидилпептидазы 4 (ДПП-4), или глиптины, оказывают инкретиннаправленное воздействие. Их сахароснижающий потенциал связан с избирательным ингибированием ДПП-4, расщепляющей глюкагоноподобный пептид 1 и глюкозозависимый инсулинотропный полипептид [8]. Для этой группы препаратов характерно сбалансированное снижение глюкозы в крови и протективное влияние на β-клетки поджелудочной железы [9]. Ингибиторы ДПП-4 обладают благоприятным профилем безопасности. Так, они отличаются низким риском развития гипогликемии и нейтральным влиянием на массу тела. Препараты данной группы могут назначаться при снижении функции почек [10].
Эффективность ингибиторов ДПП-4 не зависит от возраста больных. Их применение довольно хорошо изучено у лиц пожилого возраста [10].
В современных клинических рекомендациях и алгоритмах ведения пациентов с СД 2 типа указывается на целесообразность применения ингибиторов ДПП-4 при невозможности приема метформина и в комбинации с метформином как в качестве стартовой терапии, так и в качестве терапии второй линии. При этом назначение комбинации метформина и ингибитора ДПП-4 на старте лечения имеет преимущества в отношении сохранения инсулинсекреторной функции поджелудочной железы [9, 11].
На данный момент времени группа ингибиторов ДПП-4 представлена ситаглиптином, вилдаглиптином, саксаглиптином, линаглиптином, алоглиптином, гозоглиптином и эвоглиптином. Несмотря на то что данные препараты обладают сопоставимыми профилями эффективности и безопасности, между ними имеются некоторые различия, в том числе в достижении компенсации углеводного обмена.
Поскольку прямых сравнений ингибиторов ДПП-4 между собой практически не проводилось, целью нашего исследования стала оценка эффективности компенсации углеводного обмена с использованием ингибиторов ДПП-4 в виде моно- или комбинированной терапии с метформином у пациентов с СД 2 типа.
Материал и методы
Проведен систематический обзор рандомизированных клинических исследований (РКИ) и синтез его результатов на основе сетевого метаанализа.
Систематический обзор соответствовал требованиям Кокрейновского руководства по систематическим обзорам вмешательств для рандомизированных исследований [12].
Стратегия поиска в формате PICO включала следующие ключевые параметры:
- популяция: пациенты с СД 2 типа;
- вмешательство: ингибитор ДПП-4 в виде монотерапии, комбинация ингибитора ДПП-4 и метформина;
- контроль: плацебо, метформин;
- параметры результата: доля пациентов, достигших целевого уровня HbA1c (< 7%) к концу исследования.
Поиск публикаций осуществлялся за период до 15 июня 2023 г. в базах данных PubMed с использованием фильтров «randomized clinical trial», «humans» и поисковых слов «diabetes», «alogliptin», «vildagliptin», «sitagliptin», «linagliptin», «saxagliptin», «gosogliptin», «placebo», «metformin» и Google Scholar с использованием поисковых слов в разных комбинациях «diabetes», «alogliptin», «vildagliptin», «sitagliptin», «linagliptin», «saxagliptin», «gosogliptin», «placebo», «диабет», «исследование», «алоглиптин», «вилдаглиптин», «ситаглиптин», «линаглиптин», «саксаглиптин», «гозоглиптин», «плацебо», «метформин».
Изучены названия и полные тексты записей электронного поиска, после чего были исключены записи, не соответствующие критериям анализа.
Отдельно собиралась информация о наивных и не наивных пациентах. Первые не получали медикаментозную терапию СД до начала участия в исследовании.
Методологическое качество найденных публикаций анализировали с помощью Кокрановского инструмента оценки риска систематической ошибки для рандомизированных исследований (версия 2) [13]. Визуализация данных проведена с помощью приложения ROBVIS [14]. Для каждого отобранного исследования риск систематической ошибки по каждому домену в отдельности и доменам в совокупности был оценен как низкий, высокий или как некоторые проблемы.
При проведении сетевого анализа допускалась транзитивность. Допущение транзитивности означает, что группы, имеющиеся в одних рандомизированных клинических исследованиях, используемых для построения сети доказательств, и отсутствующие в других, могли бы в них быть, а их отсутствие является случайным.
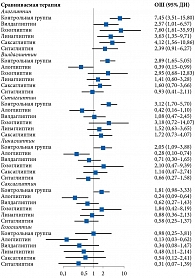
Степень гетерогенности оценивалась визуально при построении графиков forest plots. Проводилась также количественная оценка с расчетом индекса I2 и Кокрановской Q-статистики. Для значений I2 применена следующая интерпретация неоднородности: 0–25% – нет гетерогенности, 25–50% – гетерогенность низкая, 50–75% – умеренная, более 75% – высокая [12].
Статистический анализ выполнен с помощью языка программирования R 4.2.2 с использованием специализированного пакета netmeta. Применялась модель случайных эффектов, обеспечивающая по сравнению с моделью фиксированных эффектов более консервативную оценку разнородных результатов исследований.
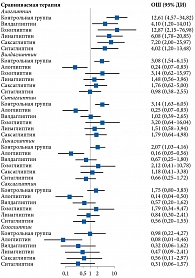
В настоящем анализе график доверительных интервалов forest plots для оценки размера эффекта в исследованиях представлен на логарифмической шкале отношения шансов (ОШ). Нейтральное значение для сравнения видов лечения признано равным единице. Расположение 95%-ного доверительного интервала (ДИ) слева или справа от нейтрального значения, не включая последний, на уровне 0,05 указывало на статистическую значимость в пользу первого или второго препарата соответственно.
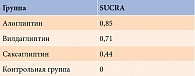
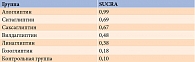
Для определения эффективности препаратов рассчитывалась площадь под кумулятивной ранжирующей кривой (surface under the cumulative ranking curve, SUCRA). Увеличение SUCRA свидетельствовало о возрастании вероятности у препарата стать лучшим в классе, то есть оказаться эффективнее других.
Результаты
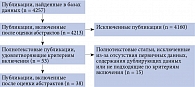
При первоначальном поиске найдено 4257 публикаций. На основании названия и описания исследований для изучения полного текста отобраны 53. После полнотекстового просмотра 38 публикаций, удовлетворяющих критериям включения, рассмотрены на предмет включения в обзор, остальные исключены в связи с отсутствием необходимых данных для проведения статистического анализа (рис. 1). Суммарно анализ включал результаты 38 РКИ с количеством участников 13 431.
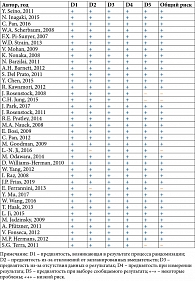
Исследования были опубликованы на русском и английском языках в период с 2006 по 2019 г. Основные характеристики исследований представлены в табл. 1 [15–52].
При оценке риска большинство включенных исследований были расценены как имеющие низкий риск систематической ошибки, несколько исследований – как имеющие некоторые проблемы (в основном из-за отсутствия описания запланированных конечных точек и ссылки на протокол исследования). Результаты оценки риска систематической ошибки представлены на рис. 2 [15–52].
Доля пациентов с целевым уровнем HbA1c после монотерапии глиптинами
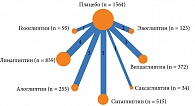
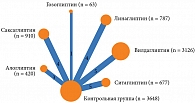
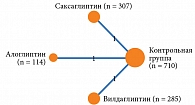
В анализ вошли результаты 17 исследований, содержащих сведения об эффективности алоглиптина, ситаглиптина, гозоглиптина, саксаглиптина, вилдаглиптина, линаглиптина и эвоглиптина по сравнению с эффективностью плацебо. Сетевая структура анализа представлена на рис. 3.
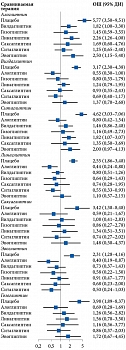
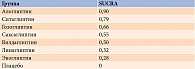
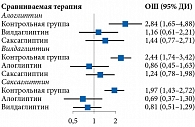
При проведении сетевого анализа с использованием модели случайных эффектов для алоглиптина получен самый высокий показатель в отношении доли пациентов с целевым уровнем НbA1c после лечения (ОШ по сравнению с плацебо – 5,77 (95% ДИ 3,50–9,51) (р = 0) (рис. 4). При расчете SUCRA наиболее высокий рейтинг также был у алоглиптина – 0,90 (табл. 2). Гетерогенность данных отсутствует (I2 – 0%), публикационное смещение не выявлено.
Доля пациентов с целевым уровнем НbA1c после лечения комбинацией глиптинов и метформина
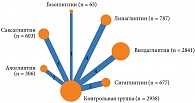
Для анализа отобраны 22 исследования, в которых содержались сведения об эффективности комбинации метформина и алоглиптина, ситаглиптина, гозоглиптина, саксаглиптина, вилдаглиптина, линаглиптина по сравнению с эффективностью метформина (контрольная группа). Сетевая структура анализа представлена на рис. 5.
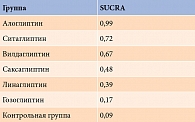
При проведении сетевого анализа с использованием модели случайных эффектов на фоне применения комбинации алоглиптина с метформином доля пациентов, достигших целевого уровня НbA1c после лечения, оказалась наиболее высокой (ОШ по сравнению с метформином – 7,45 (95% ДИ 3,51–15,80) (р = 0) (рис. 6). После расчета SUCRA наиболее высокий рейтинг также получен для данной комбинации – 0,99 (табл. 3). Гетерогенность данных расценена как высокая и значимая (I2 – 86%), выявлено возможное публикационное смещение.
Доля достигших целевого уровня НbA1c после лечения комбинацией глиптинов и метформина в популяции наивных пациентов
Проанализированы три исследования, в которых были сведения об эффективности комбинации метформина и алоглиптина, саксаглиптина, вилдаглиптина по сравнению с эффективностью метформина (контрольная группа) у наивных пациентов. Сетевая структура представлена на рис. 7.
Согласно результатам сетевого анализа с использованием модели случайных эффектов, для комбинации алоглиптина с метформином получено самое высокое значение доли пациентов с целевым уровнем НbA1c после лечения (ОШ по сравнению с метформином – 2,84 (95% ДИ 1,65–4,88) (р < 0,05) (рис. 8). При расчете SUCRA наиболее высокий рейтинг также продемонстрировала данная комбинация – 0,85 (табл. 4). Оценка гетерогенности не проводилась из-за недостаточного количества исследований.
Доля достигших целевого уровня HbA1с после лечения комбинацией глиптинов и метформина в популяции не наивных пациентов
В анализ включены 19 исследований, содержащих сведения об эффективности комбинации метформина и алоглиптина, саксаглиптина, вилдаглиптина, гозоглиптина, линаглиптина и монотерапии метформином у не наивных пациентов. Сетевая структура представлена на рис. 9.
Согласно сетевому анализу с использованием модели случайных эффектов, комбинация алоглиптина с метформином обладала самым высоким показателем в отношении достигших целевого уровня НbA1c после лечения (ОШ по сравнению с метформином – 12,61 (95% ДИ 4,57–34,82) (р = 0) (рис. 10).
Согласно результатам расчета SUCRA, наиболее высокий рейтинг также имел место у комбинации алоглиптина и метформина – 0,99 (табл. 5). Гетерогенность данных оценена как высокая и статистически значимая (I2 – 86%), выявлено возможное публикационное смещение.
Обсуждение
На момент сбора данных для проведения сетевого анализа нами не было найдено ни одной публикации по сетевому анализу эффективности ингибиторов ДПП-4 в отношении достижения целевого уровня HbA1с у наивных и не наивных пациентов.
Целью данного систематического обзора стала оценка эффективности ингибиторов ДПП-4 в виде моно- и комбинированной терапии с метформином в достижении целевого уровня HbA1с, в том числе в подгруппах наивных и не наивных пациентов. Наивными считались пациенты, не получавшие сахароснижающей терапии до начала приема ингибиторов ДПП-4.
Установлено, что алоглиптин в виде монотерапии превосходил другие ингибиторы ДПП-4 в отношении частоты случаев снижения HbA1с до рекомендованного уровня. Аналогичные результаты получены при сравнении комбинаций разных ингибиторов ДПП-4 с метформином. В частности, отмечено преимущество комбинации метформина с алоглиптином. При анализе по подгруппам наивных и не наивных пациентов наибольшая частота достижения целевого уровня HbA1с также зафиксирована у комбинации алоглиптина и метформина.
Результаты метаанализа, проведенного D. Wu и соавт. в 2013 г., свидетельствуют о преимуществе начала терапии с комбинации ингибиторов ДПП-4 с метформином по сравнению с монотерапией метформином в отношении снижения уровня HbA1с [53]. Однако в данной работе не оценивалась эффективность каждого ингибитора ДПП-4 в отдельности.
Сетевой анализ эффективности сахароснижающих препаратов, проведенный E.S. Mearns и соавт. в 2015 г., продемонстрировал преимущество монотерапии алоглиптином над монотерапией саксаглиптином, но меньшую эффективность по сравнению с монотерапией ситаглиптином и вилдаглиптином [54]. Необходимо отметить, что в данной работе оценивалась только величина снижения HbA1с. Согласно нашим данным, алоглиптин превосходил ситаглиптин и вилдаглиптин в достижении целевых значений HbA1с.
Полученные нами данные аналогичны результатам метаанализа по сравнению эффективности ингибиторов ДПП-4 и плацебо в достижении целевого уровня HbA1с, проведенного K. Esposito и соавт. в 2011 г. [55]. Ученые отметили преимущество алоглиптина над вилдаглиптином, ситаглиптином и саксаглиптином. Другие глиптины в анализ не включались. Необходимо подчеркнуть, что исследования ограничивались 2010 г.
Метаанализ Р. Craddy и соавт. 2014 г. [56] включал те же конечные точки, что и наше исследование. Оценка результатов РКИ позволила выявить, что ОШ достижения целевого уровня HbA1с выше на фоне монотерапии алоглиптином и комбинации алоглиптина с метформином по сравнению с монотерапией линаглиптином, саксаглиптином, ситаглиптином и вилдаглиптином и их комбинацией с метформином. Однако исследователи использовали данные сравнения с разными контрольными сахароснижающими препаратами.
Заключение
Анализ результатов РКИ, включенных в систематический обзор, показал преимущество использования алоглиптина в виде монотерапии, а также в виде комбинации с метформином в отношении достижения целевого HbA1c как в общей популяции, так и в популяции наивных и не наивных пациентов с СД 2 типа.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
N.A. Petunina, Corresponding member of the RASci., MD, PhD, Prof., E.A. Elmurzayeva, M.V. Khachaturov
N.V. Sklifosovsky Institute of Clinical Medicine of I.M. Sechenov First Moscow State Medical University
Contact person: Nina A. Petunina, napetunina@mail.ru
Aims – to compare the efficacy of dipeptidyl peptidase 4 (DPP-4) inhibitors in achieving the target for glycated hemoglobin (HbA1c) level in patients with type 2 diabetes by monotherapy or by combination with metformin.
Material and methods. This is a systematic review and network meta-analysis of randomized clinical trials (RCTs). Studies on the effectiveness of DPP-4 inhibitors (gliptins) compared with placebo and the combination of DPP-4 inhibitors with metformin compared with metformin were included. The endpoint was the percentage of patients (%) who achieved target HbA1c level. The size effect was represented by the logarithmic scale of the odds ratio (OR). The gliptins were ranked based on the values of surface under the cumulative ranking curve (SUCRA).
Results. The 38 RCTs of sitagliptin, vildagliptin, saxagliptin, linagliptin, alogliptin, gozogliptin, evogliptin were analyzed. The results showed a statistically significant benefit of alogliptin in monotherapy (OR compared with placebo – 5.77), in combination with metformin, both in the general population (OR compared with metformin – 7.45), and in naive and non-naive patients (OR – 2.84 and 12.61 compared to metformin, respectively). According to the SUCRA, alogliptin had the highest rating among DPP-4 inhibitors for in all subgroups.
Conclusion. Thus, the systematic review showed the superiority of alogliptin over other DPP-4 inhibitors in monotherapy, as well as in combination with metformin, both in the general population and in naive and previously treated subgroups of patients with type 2 diabetes.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.