Синдром персистирующих диарей у детей
- Аннотация
- Статья
- Ссылки









Персистирующие диареи представляют собой гетерогенную группу заболеваний. Среди причин развития этих состояний можно выделить как инфекционные (табл. 1) [4], так и неинфекционные (табл. 2) [4]. Этиология персистирующих и хронических диарей существенно различается в разных регионах мира. Так, в развивающихся странах преобладает инфекционная патология, доля же других причин персистирующих диарей незначительна. Это может быть связано еще и с тем, что в развивающихся странах возможности диагностики редких заболеваний ограничены.
Инфекционные энтериты являются самыми частыми вариантами длительной диареи у детей во всех регионах, однако спектр возбудителей в разных странах варьирует. Наиболее часто персистирующую диарею у детей вызывают энтероадгезивные штаммы кишечной палочки. Меньшее значение имеют другие патогены: Shigella, Salmonella, энтеротоксигенные штаммы E. coli, Campylobacter. Среди паразитарных причин персистирующих диарей следует особо отметить лямблии и криптоспоридии.
В индустриально развитых странах в отличие от развивающихся достаточно частыми причинами инфекционных персистирующих диарей у детей являются вирусы, особенно ротавирусы и норовирусы (табл. 3) [5]. Ротавирусы часто вызывают тяжелые и длительные диареи. Цитомегаловирусы также могут быть причиной персистирующей диареи, но чаще у иммунокомпрометированных лиц.
Неинфекционные причины персистирующих диарей включают комплекс состояний, традиционно объединяемых термином «синдром мальабсорбции». Сегодня известна большая группа заболеваний, связанных с изменениями всасывания аминокислот, моносахаридов, микроэлементов и электролитов, липидных компонентов, желчных кислот.
По основным патофизиологическим механизмам все персистирующие диареи делятся на секреторные и осмотические, хотя встречаются и смешанные формы (рис. 1) [4]. Секреторные диареи обычно клинически проявляются обильным водянистым стулом, который сохраняется даже при значительном уменьшении и полном исключении энтерального питания. При осмотической диарее клинические проявления зависят от характера и объема поступающей пищи, обычно водянистый стул не столь обильный, как при секреторной диарее.
Секреторные диареи характеризуются повышенной потерей жидкости и электролитов со стулом из-за нарушенной абсорбции NaCl энтероцитами кишечных ворсин и повышенной секреции хлоридов в просвет кишки секреторными клетками крипт. Существуют несколько механизмов развития секреторной диареи (табл. 4). Повышенная секреция хлоридов развивается в ответ на воздействие холерного или холероподобного токсина, приводящего к повышению внутриклеточной цАМФ. Другие энтеротоксины могут также вызывать увеличение секреции через цГМФ- или кальцийзависимые механизмы.
Осмотическая диарея обычно обусловлена наличием в просвете кишечника неабсорбированных нутриентов, что связано с какой-либо патологией пищеварительной системы. По осмотическому градиенту жидкость начинает поступать в просвет кишечника, растворяя этот нутриент, что приводит к развитию диареи (основное клиническое проявление).
Осмотическая диарея может быть связана как с нарушением полостного или пристеночного пищеварения, так и с нарушениями процессов абсорбции нутриентов. Процессы пристеночного и мембранного гидролиза пищевых субстанций и всасывания зависят от ряда факторов – активности ферментных и транспортных систем, состояния слизистых наложений, состава микрофлоры, структуры компонентов слизистой оболочки и др. Функциональная активность энтероцита зависит от топографии его на ворсинке, состояния и характеристики структурных компонентов пристеночного слоя слизи, скорости обновления и миграции, степени дифференцировки и созревания клеток, состояния микроворсинок (гликокаликса). Повреждение структурных компонентов тонкой кишки, уменьшение площади всасывания сопровождаются формированием синдрома мальабсорбции. Именно поэтому при синдроме короткой тонкой кишки (врожденном или пострезекционном), атрофии ворсин, возникающей при целиакии, воздействии некоторых медикаментозных средств и радиации, дефиците дисахаридаз формируются очень тяжелые изменения многих видов обмена, страдает физическое, а иногда и нервно-психическое развитие ребенка.
Учитывая широкий спектр этиологических причин персистирующих диарей у детей, диагностические исследования должны быть систематизированы и базироваться на четком алгоритме (табл. 5) [4]. Поскольку наиболее частой причиной диарей у детей являются инфекционные возбудители, крайне важно учитывать эпидемиологические данные и результаты микробиологических исследований. Необходимо анализировать семейный анамнез, так как ряд заболеваний, проявляющихся персистирующей диареей, носят генетическую природу. Следует учитывать особенности клинической картины, состояние нутритивного статуса и его динамику, наличие внекишечных проявлений (изменения кожи и ее придатков, наличие астмы, артрита, диабета и т.д.), а также связь клинических проявлений с приемом определенных продуктов питания (табл. 6, 7). Для дифференциального диагноза также важен возраст манифестации заболевания. В период новорожденности манифестируют такие заболевания, как врожденный дефицит лактазы, вторичная лактазная недостаточность, врожденная глюкозо-галактозная мальабсорбция, врожденная хлоридная диарея, врожденная натриевая диарея, врожденный дефицит трипсиногена, первичная гипомагнеземия, врожденный дефицит энтерокиназы, первичный иммунный дефицит, энтеропатический акродерматит, непереносимость белка коровьего молока, сои, болезнь Менкеса. В возрасте от 1 месяца до 2 лет манифестируют следующие заболевания: дефицит сахаразы, изомальтазы, вторичная дисахаридазная недостаточность, врожденный дефицит липазы, недостаточность поджелудочной железы с гематологическими изменениями (синдром Швахмана – Даймонда), целиакия, интестинальная лимфангиоэктазия, атрезия желчных путей, неонатальный гепатит, мальабсорбция аминокислот, врожденная мальабсорбция фолиевой кислоты, мальабсорбция витамина В12, энтеропатический акродерматит, паразитарные инфекции, пищевая аллергия, иммунный дефицит. В возрасте от 2 лет до пубертатного периода проявляются: вторичная дисахаридазная недостаточность, целиакия, болезнь Уиппла, паразитарные инфекции, вариабельный иммунный дефицит, абеталипопротеинемия.
При оценке лабораторных исследований следует обращать особое внимание на показатели периферической гемограммы, так как наличие анемии (и ее вид), тромбоцитопении, лейкопении может значительно облегчить дифференциальный диагностический поиск. При исследовании кала необходимо оценить его осмолярность, содержание основных электролитов (табл. 8), концентрацию углеводов, альфа-1-антитрипсина, кальпротеина, лейкоцитов и эритроцитов, а также содержание ряда пищеварительных ферментов. В некоторых случаях может потребоваться проведение более сложных и специфических диагностических исследований, которые представлены в алгоритме (табл. 5).
В России наряду с инфекционными энтеритами наиболее частой формой персистирующей диареи у детей является непереносимость дисахаридов (лактозы, реже других углеводов). Наиболее часто дисахаридазная недостаточность встречается при патологии тонкой кишки и связана со снижением активности ферментов, вырабатываемых энтероцитом. Непереносимость дисахаридов (лактозы, мальтозы, сахарозы) обусловлена снижением активности гидролаз (лактазы, сахаразы, изомальтазы) в слизистой оболочке тонкой кишки. Нарушение пристеночного гидролиза сахаров и всасывания метаболитов может носить первичный характер (наследственный, врожденный) или вторичный (на фоне различных заболеваний).
Патогенез лактазной недостаточности. При дефиците лактазы нерасщепленные углеводы накапливаются в просвете тонкой кишки. Создается повышенное осмотическое давление, которое приводит к избыточному поступлению воды в просвет кишечника. Лактоза утилизируется микрофлорой, образуется большое количество органических кислот и углекислого газа, что еще больше усиливает поступление воды в просвет кишки, снижается pH кала (меньше 5,5), формируется водянистый пенистый стул с кислым запахом брожения. Лактоза выделяется в нерасщепленном виде, как с фекалиями, так и с мочой (лактозурия). Развитие синдрома мальабсорбции обусловлено осмотическим эффектом и бактериальным воздействием. Образование избытка ионов водорода приводит к повышению их концентрации в выдыхаемом воздухе. Не у всех пациентов со сниженной активностью этого фермента наблюдаются признаки интолерантности. Вступают в действие компенсаторные механизмы: повышение активности мембранных, лизосомальных и митохондриальных ферментов в толстой кишке. Известную роль в обезвреживании токсических продуктов, образующихся в кишечнике, играет печень.
Большое значение ферментопатия имеет в раннем детстве, так как лактоза содержится в молоке, которое является основным питанием ребенка. В настоящее время показано, что способность расщеплять молочный сахар связана с активностью фермента лактаза-флоризингидролазы (E.C. 3.2.1.108), более известного как лактаза или бета-D-галактозидгидролаза. Это крупный гликопротеин с двумя активными центрами: Glu1273, катализирующим гидролиз бета-гликозидов, в том числе флоризина, гликозидов флавоноидов и пиридоксин-5'-бета-D-гликозида, и Glu1749, катализирующим гидролиз бета-галактозидов, в том числе лактозы. Лактаза-флоризингидролаза кодируется единственным геном (LCT), локализованным во 2-й хромосоме. Существуют несколько аллелей: LCT – аутосомно-рецессивная аллель, которая в гомозиготном состоянии вызывает снижение лактазной активности у взрослых; LCT*P – аутосомно-доминантная аллель, которая как в гомозиготном, так и гетерозиготном состоянии определяет персистенцию лактазной активности на протяжении всей жизни. Основными генотипами, определяющими активность лактазы, являются: гомозиготы по гену персистирования активности LCT*P (доминантный признак); гомозиготы по гену отсутствия персистирования (рецессивный признак); гетерозиготы – лица с этим генотипом имеют вариабельный уровень лактазной активности, обусловленный генетическим полиморфизмом, у них чаще развивается вторичная лактазная недостаточность.
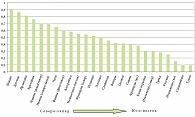
Переносимость лактозы в первую очередь определяется наличием гена персистирования активности (LCT*P), частота встречаемости которого у людей в разных популяциях варьирует в больших пределах. В европейской популяции (рис. 2) наиболее высокая частота гена LCT*P отмечается у жителей Северной Европы (Швеция, Дания, Ирландия). Частота дефицита лактазы у русских наблюдается у 16% популяции. Распространенность непереносимости лактозы в Латвии составляет 24%, в Литве – 37%, в Марий Эл – 81%, Карелии – 11,5%. Принимая во внимание высокую активность миграционных процессов в мире, необходимо учитывать происхождение пациентов и их близких родственников из того или иного региона мира. Наиболее часто дефицит лактазы и низкая частота гена персистирования (LCT*P) отмечаются в странах Ближнего Востока, Юго-Восточной Азии и Африки, хотя даже в этих регионах отмечается неоднородность популяции по гену LCT*P. Народы, исторически ведущие кочевой образ жизни и занимающиеся животноводством, имеют существенно более высокую частоту гена персистирования лактазной активности и отличаются хорошей переносимостью молока.
Процесс синтеза и активации лактазы достаточно сложный и состоит из нескольких этапов, нарушение на любом из них может привести к развитию патологии. Ген LCT состоит из 17 экзонов, кодирует мРНК, копирующую 6274 нуклеотида (Genbank X07994), и препропротеин, включающий 1927 аминокислотных остатков. Этот препропротеин состоит из сигнального пептида (19 аминокислотных остатков), большой прочасти (849 аминокислотных остатков), зрелого белка, содержащего два каталитических центра, и С-терминального сегмента, состоящего из мембраносвязывающего и короткого цитоплазматического доменов. Ген LCT имеет четырехкратную гомологичность, то есть проэнзим состоит из четырех доменов с совершенно идентичным аминокислотным строением. Два гомологичных домена (домен I и домен II) образуют прочасть, которая не обладает каталитической активностью, но играет важную роль в транспортировке энзима к поверхности клеточной мембраны. Два других гомологичных домена (домен III и домен IV) составляют неактивный предшественник лактазы, имеющий два каталитических центра: Glu1273 в домене III, катализирующий гидролиз бета-гликозидов, и Glu1749 в домене IV, катализирующий гидролиз бета-галактозидов. Высвободившийся в результате протеолиза проэнзима предшественник лактазы в процессе транспортировки в цитоплазме подвергается серии О- и N-гликозилирования, вследствие чего образуется активный энзим – лактаза.
Этот фермент находится на апикальной поверхности щеточной каемки энтероцита, фиксирован на его клеточной мембране С-терминальным концом и обращен в просвет кишки. Высокую активность фермента обеспечивают зрелые энтероциты на вершине ворсин. Эта топография объясняет наиболее частое возникновение при повреждении слизистой оболочки тонкой кишки лактазной недостаточности по сравнению с дефицитом других ферментов.
Активность лактазы проявляется с 12–14 недель гестационного возраста, достигая максимальных величин к 39–40-й неделе. В постнатальном периоде у носителей рецессивного генотипа отмечаются снижение активности фермента в возрасте 6–11 месяцев и дальнейшее уменьшение к 1,5–5 годам жизни. Вторичная лактазная недостаточность может наблюдаться при многих заболеваниях у детей, приводящих к субатрофии или атрофии слизистой оболочки тонкой кишки.
Клиническая картина лактазной недостаточности может проявляться уже с первых дней жизни: учащенный стул водянистого характера, пенистый, с кислым запахом, который появляется через 30–90 минут после кормления, рвота, срыгивания. Характерны абдоминальные колики, которые могут появляться даже в период кормления. У детей формируются осмотическая диарея, водно-электролитные изменения в крови. Эпителий тощей кишки недостаточно устойчив к водно-электролитным колебаниям, поэтому возникает проницаемость для макромолекул. В этих случаях отмечается выделение лактозы с мочой. Тип лактазной недостаточности с лактозурией также может наблюдаться у детей раннего возраста.
Лактазная недостаточность сочетается с проявлениями дисбиоза кишечника, что оказывает влияние на клиническую симптоматику, длительность клинических проявлений. Значительное количество нерасщепленной лактозы в просвете тонкой кишки при повышенном числе бактерий приводит к образованию большого количества органических кислот, что вызывает выраженный ацидоз внутренней среды кишки и усиление моторики. У недоношенных детей использование лактозы может сопровождаться развитием метаболического ацидоза.
Диагностика. Диагноз лактазной недостаточности устанавливается на основании следующих критериев: генеалогических данных, плоской гликемической кривой у пациента (то есть прирост гликемии менее 1,1 ммоль/л) после нагрузки лактозой в дозе 2 г/кг массы, данных копрологии (увеличение крахмала, клетчатки, йодофильной бродильной микрофлоры, снижение pH кала менее 5,5), определения углеводов в кале с помощью полосок Testape, пробы Бенедикта (в норме показатель не должен превышать 0,25% у детей до 12 месяцев и быть отрицательным после 1 года). «Золотым стандартом» диагностики дисахаридазной недостаточности является изучение активности дисахаридаз в биоптатах слизистой оболочки тонкой кишки или в смывах, получаемых при эндоскопических исследованиях. Этот метод позволяет точно идентифицировать дефектный энзим и выявить степень снижения его активности.
Лечение. Главным видом лечения больных с синдромом мальабсорбции являются диетическая коррекция и лечебное питание, основными принципами которого являются: определение и элиминация причинно-значимых нутриентов с обязательной их адекватной заменой; индивидуальный подход к составлению элиминационного рациона. Составление меню для больных детей с синдромом мальабсорбции требует от медицинского персонала достаточно высокой квалификации и знаний из различных областей как теоретической, так и практической медицины [7]. Необходимо учитывать: 1) наличие дефицитных синдромов, требующих максимально быстрой коррекции; 2) степень гипотрофии и обусловленную ею нарушенную толерантность к пищевым нагрузкам; 3) функциональное состояние печени, поджелудочной железы, почек, лимитирующее увеличение нагрузок белком и жиром; 4) высокую чувствительность кишечника больных детей к осмотической нагрузке; 5) возраст ребенка; 6) аппетит и индивидуальное отношение к предлагаемым продуктам и блюдам. Другими важными компонентами выхаживания больных детей с синдромом мальабсорбции являются уход и профилактика вторичных инфекционных осложнений. Необходимо обеспечить хорошую комплаентность проводимой терапии. Для этого к уходу и кормлению необходимо привлекать мать больного ребенка, так как именно от ее навыков и мотивированности зависит эффективность проводимой терапии в амбулаторных условиях.
Диетотерапия при лактазной недостаточности заключается в уменьшении потребления продуктов, содержащих лактозу. Используется назначение ферментных препаратов, расщепляющих лактозу, пищевых волокон (особенно пектин), повышающих активность лактазы, введение препаратов для нормализации кальциевого обмена, проводится восстановление биоценоза кишечника. Снижение количества потребляемого молока легко осуществить для детей старшего возраста и взрослых. Допускается использование кисломолочных продуктов со сниженным количеством лактозы (йогуртов, простокваши), творога, масла, твердых сыров, а также безлактозных продуктов на основе коровьего молока. Следует учитывать возможное снижение уровня кальция на безмолочной диете, которое необходимо компенсировать медикаментозными препаратами.
Сложнее подобрать питание для детей раннего возраста, особенно на первом году жизни.
При естественном вскармливании уменьшение количества грудного молока в диете является нежелательным, у пациента с выраженными симптомами лактазной недостаточности необходимо использовать препараты лактазы (Лактаза Бэби), которые смешиваются с грудным молоком, не влияя на другие его ингредиенты. Лучше внести фермент в первую порцию молока, предварительно сцеженного, и оставить на несколько минут для ферментации. Молоко с ферментом дается из ложки или поильника, далее ребенок докармливается из груди. Препарат необходимо давать каждое кормление. Лишь при выраженной тяжести заболевания и низкой эффективности применяемых препаратов лактазы может рассматриваться вопрос о частичном уменьшении объема материнского молока и замене его безлактозной смесью.
Хорошо себя зарекомендовал при лечении лактазной недостаточности препарат Лактаза Бэби – ферментный препарат, дополнительный источник фермента лактазы с целью улучшения усвоения молочных продуктов, производитель – NEC (США). Применяется при лактазной недостаточности у детей от 0 до 7 лет для улучшения усвоения молочных продуктов при их плохой переносимости, для предотвращения таких симптомов дефицита лактазы, как метеоризм, кишечные спазмы, диарея, пенистый стул с кислым запахом, недостаточная прибавка в весе; при лактазной недостаточности у детей первого года жизни; при функциональной незрелости ферментативных систем. Одна капсула Лактаза Бэби содержит 700 единиц (7 мг) фермента лактазы (источником лактазы являются плесневые грибы Aspergillus niger и Aspergillus orizae; после специальной очистки получают стандартизованный фермент лактазу).
В исследовании проф. А.И. Чубаровой (РГМУ, Москва) на фоне приема Лактазы Бэби отмечалось исчезновение клинических проявлений лактазной недостаточности (исчезновение водянистой фракции в стуле, исчезновение метеоризма, болевого синдрома) у детей в среднем к 4,5 ± 2 суткам от начала терапии. Метеоризм и вздутие живота проходили к 4 ± 2 суткам терапии. На фоне лечения дети стали усваивать достоверно больший объем питания: 165 мл/кг/сут по сравнению с 139 мл/кг/сут (р < 0,0001) и переваривать достоверно большее количество лактозы: 11,1 г/кг/сут по сравнению с 9,1 г/кг/сут (р < 0,0001). Экскреция углеводов с калом достоверно снизилась с 0,8 до 0,55% в среднем (р = 0,02). Дети выписывались с рекомендациями сохранить естественное или смешанное вскармливание в сочетании с использованием лактазы.
В другом исследовании проф. А.И. Чубаровой показано, что препараты лактазы эффективно снижают уровень водорода в выдыхаемом воздухе даже при однократном приеме.
При естественном вскармливании важно помнить, что количество лактозы в грудном молоке не зависит от диеты матери, и излишне строгая диета может негативно сказаться на количестве и качестве молока и эмоциональном состоянии матери. Следует ограничить употребление ребенком продуктов с большим содержанием цельного коровьего белка для профилактики аллергии к белку коровьего молока и формирования вторичной лактазной недостаточности.
При искусственном вскармливании недоношенных новорожденных детей, у которых отмечается транзиторная лактазная недостаточность, целесообразно использовать специализированные преформулы, где содержание лактозы несколько уменьшено. При появлении признаков гиполактазии у новорожденных детей с нормальным сроком гестации нецелесообразно сразу же переводить ребенка на строго безлактозный рацион, так как наличие в питании даже небольших доз лактозы важно для нормального развития ребенка. Лактоза является главным и легко усваиваемым источником энергии, она способствует поддержанию адекватного транспорта в кишечнике таких важных микроэлементов, как кальций, магний и марганец. Полное исключение лактозы неблагоприятно сказывается на биоценозе кишечника, так как лактоза является субстратом для молочно-кислых бактерий. Лактоза также является бифидогенным фактором. Неусвоенная лактоза ферментируется в толстой кишке, снижая рН ее содержимого и препятствуя тем самым росту гнилостной микрофлоры. Кроме того, лактоза является источником галактозы, которая необходима для синтеза галактоцереброзидов в центральной нервной системе и сетчатке глаза. Лишь при выраженном дефиците лактозы дети переводятся на полное вскармливание низко- или безлактозными смесями.
Достаточно часто лактазная недостаточность у детей раннего возраста сочетается с непереносимостью белков коровьего молока.
В этом случае смесями выбора у детей являются формулы на основе полного гидролизата молочного белка.
Нарушения микроэкологии кишечника при синдроме персистирующих диарей у детей необходимо корректировать с помощью пробиотиков. Для детей раннего возраста важна как форма выпуска, так и соответствующий возрасту набор штаммов микроорганизмов. Препарат Примадофилус Детский не содержит лактозу и может быть рекомендован при лактазной недостаточности. Важно также, что состав микроорганизмов подобран в соответствии с возрастными особенностями микрофлоры и предназначен специально для применения у детей с первых дней жизни. Основу препарата Примадофилус Детский составляют Bifidobacterium infantis, Bifidobacterium longum, Lactobacillus rhamnosus и Lactobacillus acidophilus. Рекомендуется давать препарат детям по 0,5–1 чайной ложке порошка 1 раз в день, растворив в 10 мл воды или любой другой жидкости. После курса лечения поддерживается стабильный высокий уровень бифидо- и лактобактерий, при этом не происходит транслокации патогенных и условно-патогенных штаммов.
На фоне приема препарата Примадофилус Детский у детей раннего возраста отмечаются:
- улучшение полостного пищеварения, что отражается в уменьшении выделения компонентов жиров (фосфолипидов, свободных жирных кислот и др.) и углеводов с калом;
- повышение активности собственных ферментов;
- уменьшение примеси слизи в стуле, уплотнение его консистенции;
- сокращение количества кишечных колик и срыгиваний;
- положительная динамика массы тела всех обследованных детей.
Помимо диетотерапии при необходимости могут применяться и медикаментозные методы коррекции. При выраженном диарейном синдроме можно использовать антидиарейные препараты, которые назначают коротким курсом в сочетании с элиминационной диетой. При тяжелом течении заболевания, которое сопровождается электролитными и обменными нарушениями, необходимо проводить их коррекцию. С этой целью используются изотонические растворы глюкозы, хлорида натрия, хлорида калия. Часто у детей с лактазной недостаточностью отмечаются признаки реактивного панкреатита – значительные нарушения экзокринной функции и полостного пищеварения. В этих случаях показано назначение препаратов панкреатина.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.