Современные подходы к антитромботическому лечению больных с острой окклюзией коронарной артерии
- Аннотация
- Статья
- Ссылки

Однако при достаточно быстром исчезновении окклюзии сосуда признаки ИМ могут и не появиться. Соответственно, вне зависимости от того, каким окажется окончательный диагноз, основные усилия должны быть направлены на скорейшее восстановление коронарного кровотока. Поэтому развившееся состояние на ранних этапах оказания медицинской помощи обозначают как острый коронарный синдром со стойкими подъемами сегмента ST на ЭКГ (ОКСПST). Под этим понимают недавнее возникновение клинических симптомов, предположительно связанных с острой ишемией миокарда, в сочетании с достаточно выраженными смещениями сегмента ST вверх от изоэлектрической линии как минимум в двух смежных отведениях ЭКГ, которые сохраняются более 20 минут (1-3).
Основной причиной прекращения кровотока по коронарной артерии является тромб, образующийся на месте поврежденной атеросклеротической бляшки. Вместе с тем существуют и бессимптомные окклюзии коронарных артерий. Очевидно, что диагноз в этих случаях можно поставить только при коронарной ангиографии и говорить о неотложном лечении подобных больных не приходится. Кроме того, прекращение коронарного кровотока не всегда приводит к появлению подъемов сегмента ST на ЭКГ или они достаточно быстро исчезают. Определить показания к реперфузионному лечению у таких больных без срочной коронарной ангиографии невозможно. Наконец, острая окклюзия коронарной артерии может быть связана не только с прогрессированием коронарного атеросклероза (обострением коронарной болезни сердца), но и с расслоением аорты, возникновением эмболии и рядом других достаточно редких причин. На практике указанные случаи диагностировать сложно, особенно в ранние сроки заболевания, когда надо быстро принимать решение о целесообразности и способе реперфузионного лечения. Обследование больных с подозрением на нетипичную причину окклюзии коронарной артерии стоит начать с ультразвукового исследования аорты и коронарной ангиографии, а тромболитическая терапия во многих подобных случаях может оказаться неэффективной или противопоказанной.
Многолетнее изучение эффективности и безопасности устранения тромботической окклюзии коронарной артерии с помощью введения фибринолитиков показало, что чем раньше начинается реперфузионное лечение, тем выше его эффективность. Так, по совокупным данным 22-х рандомизированных контролируемых клинических исследований, включавших в совокупности 50246 человек, введение стрептокиназы или эквивалентных ей по эффективности режимов тромболитической терапии в первый час после возникновения заболевания за 35 суток позволяло предотвратить 65 случаев смерти на каждую 1000 леченных больных (4). При начале лечения через ³1-2 часа эта цифра составила 37, через ³2-3 часа – 26, через ³3-6 часов – 29, а через ³6-12 часов – 18. При надлежащем отборе больных польза тромболитической терапии намного превосходила опасность геморрагических осложнений: по совокупным данным на каждую 1000 леченных больных возникало 4 дополнительных инсульта (из них: 2 смертельных, 1 инвалидизирующий и 1 неинвалидизирующий) и примерно 7 серьезных внечерепных кровотечений, в т.ч. угрожающие жизни и требующие переливания крови (5). Поэтому настоятельно рекомендуется предпринять все усилия, чтобы уменьшить время от появления симптомов окклюзии коронарной артерии до начала реперфузионного лечения. И хотя положительное влияние на смертность несомненно при начале лечения в первые 12 часов заболевания (и даже позднее, если сохраняются проявления окклюзии сосуда или развился кардиогенный шок), в идеале предложено стремиться к тому, чтобы общее время ишемии миокарда не превышало 2-х часов. Очевидно, что один из способов достичь этой цели – догоспитальное введение фибринолитика. Так, в рандомизированных контролируемых исследованиях, включавших в совокупности более 6500 больных в сроки не позднее 6 часов от начала заболевания, догоспитальная тромболитическая терапия давала возможность начать лечение в среднем на 60 минут раньше, чем начало введения фибринолитика в стационаре. Этот выигрыш во времени позволил дополнительно предотвратить примерно 16 смертей на каждую 1000 больных за время лечения в стационаре и 21 – в ближайший месяц (6-8). Такая закономерность подтверждается и в более широкой клинической практике (9). Поэтому в настоящее время догоспитальному тромболизису отдается предпочтение, причем введение фибринолитика рекомендуются начать как можно быстрее, в пределах 30 минут после приезда бригады неотложной медицинской помощи или прибытия больного в стационар, если догоспитальное введение фибринолитика невозможно (2, 3). Альтернативный подход к восстановлению проходимости коронарной артерии – чрескожное коронарное вмешательство (ЧКВ – прямая коронарная ангиопластика и стентирование) – считается предпочтительным, если время от первого контакта с медицинским персоналом до раздувания баллона в коронарной артерии не превысит 90 минут или имеются противопоказания к тромболитической терапии.
Эффективность медикаментозной терапии больных с острой окклюзией коронарной артерии можно повысить за счет совершенствования антитромботического лечения. Так, хорошо документирована польза применения более современных фибринолитиков. В крупном контролируемом исследовании GUSTO-1 использование 1,5-часовой инфузии алтеплазы в пределах 6 часов от начала заболевания в сравнении со стрептокиназой позволяло предотвратить еще 10 смертельных исходов на каждую 1000 леченных больных ценой дополнительного возникновения примерно 2-х геморрагических инсультов. При этом уменьшилась и частота серьезных осложнений (сердечной недостаточности, стойкой артериальной гипотензии, кардиогенного шока, атриовентрикулярных блокад высокой степени, асистолии, серьезных аритмий) (10, 11). Аналогичного преимущества можно ожидать от тенектеплазы (12).
Кроме того, установлено, что добавление к фибринолитику (стрептокиназе) ацетилсалициловой кислоты позволяет почти в два раза увеличить положительное влияние лечения на смертность и при этом серьезно не повышает частоту кровотечений (13,14). Ацетилсалициловая кислота обладает положительным воздействием на смертность и при отсутствии реперфузионного лечения. Она также необходима при ЧКВ, а потому является стандартным компонентом лечения всех больных ОКСПST, у которых нет противопоказаний (1-3). В последние годы стало очевидно, что дополнительную пользу приносит добавление к ацетилсалициловой кислоте второго антиагреганта (клопидогрела). В рандомизированном двойном слепом плацебо-контролируемом исследовании COMMIT/CCS-2, включавшем 45852 больных без ограничения возраста, применение клопидогрел до 4-й недели заболевания или более ранней выписки (в среднем 2 недели) позволяло дополнительно предотвратить 9 неблагоприятных исходов (смерть, рецидив ИМ, инсульт) на каждую 1000 леченных больных (15). Этот эффект был достигнут за счет достоверного уменьшения общей смертности (6 на каждую 1000 леченых больных) и рецидивов ИМ (3 на каждую 1000 леченных больных). Такое кратковременное использование клопидогрела оказалось достаточно безопасным – частота серьезных кровотечений не увеличилась. При этом пользу от добавления к ацетилсалициловой кислоте клопидогрела получали как больные, которым вводился фибринолитик, так и оставшиеся без реперфузионного лечения. По данным не столь крупного двойного слепого плацебо-контролируемого исследования CLARITY-TIMI 28 (3491 человека), добавление клопидогрела к ацетилсалициловой кислоте у больных не старше 75 лет, получавших тромболитическую терапию, позволяет предотвратить реокклюзию коронарной артерии, кровоснабжающей зону ИМ, а также уменьшить частоту сохраняющегося тромбоза сосуда в ближайшую неделю после начала лечения (16). Этому воздействию соответствует меньшая частота ишемических осложнений. Кроме того, если в ближайшие дни после тромболитической терапии возникает необходимость в ЧКВ, применение клопидогрела, начатое в ранние сроки заболевания, способствует снижению риска тромботических осложнений не только до вмешательства, но и в ближайший месяц после него (17). Достаточно крупных клинических исследований добавления клопидогрела к ацетилсалициловой кислоте в случаях, когда для восстановления проходимости коронарных артерий используется не тромболитическая терапия, а ЧКВ (первичные ангиопластика и стентирование), не проводилось. Однако с учетом опыта, накопленного при выполнении этих процедур при других формах коронарной болезни сердца, рекомендуется, как можно раньше принять внутрь увеличенную дозу клопидогрела – 300 и даже 600 мг (3, 18). Таким образом, клопидогрел представляется желаемым дополнением к ацетилсалициловой кислоте в ранние сроки ОКСБПST вне зависимости от способа реперфузионного лечения за исключением случаев, когда в ближайшие дни может быть выполнена операция коронарного шунтирования (2, 3). Такой подход дает возможность немного уменьшить вероятность неблагоприятного исхода и в случаях, когда наиболее эффективное (реперфузионное) лечение заболевания по каким-то причинам не проводилось. При этом безопасность начала применения препарата в увеличенной дозе (однократно внутрь 300 мг) продемонстрирована только у больных не старше 75 лет, которым проводилась тромболитическая терапия. Соответственно, у лиц старше 75 лет, которым в ближайшее время не планируется выполнить ЧКВ, предлагают начинать лечение со стандартной дозы, рекомендуемой для длительного использования (75 мг). Максимальная изученная длительность применения клопидогрела в сочетании с ацетилсалициловой кислотой после тромболитической терапии или при отсутствии реперфузионного лечения составляет 4 недели. Продление лечения двумя антиагрегантами оправдано как минимум после ЧКВ (в особенности после стентирования). Максимальная изученная продолжительность применения клопидогрела в этой ситуации не превышает 1 года (2, 3, 18).
До недавнего времени стандартным дополнением к сочетанию фибрин-специфичных фибринолитиков (алтеплазы, тенектеплазы) с ацетилсалициловой кислотой считалась 24-48-часовая внутривенная инфузия нефракционированного гепарина (НФГ) в дозе, обеспечивающей удлинение активированного частичного тромбопластинового времени в 1,5-2 раза выше верхней границы нормы для конкретной лаборатории. Аналогичный подход возможен и при применении стрептокиназы, однако однозначные свидетельства пользы (и заметного вреда) гепарина в этой ситуации отсутствуют (1, 19-23). Вместе с тем исследования последних лет показали, что продление введения антикоагулянтов прямого действия вплоть до 1 недели способно принести пользу как больным, получавшим тромболитическую терапию, так и оставшимся без реперфузионного лечения.
Первоначально в рандомизированном двойном слепом клиническом испытании CREATE, включавшем 15570 больных, было показано преимущество подобного подхода перед плацебо. Оказалось, что подкожное введение низкомолекулярного гепарина ревипарина на протяжении 1 недели позволяло предотвратить 14 случаев смерти, рецидива ИМ или инсульта на каждую 1000 больных в первую неделю лечения и 18 таких событий в ближайший месяц ценой возникновения 5 серьезных кровотечений (24). Причем результаты лечения распространялись как на больных, получивших тромболитическую терапию (в основном с помощью стрептокиназы или урокиназы), так и оставшихся без реперфузионного лечения.
В рандомизированное двойном слепом плацебо-контролируемом сравнительном клиническом испытании EXTRACT-TIMI 25, включавшем 20506 больных, однонедельное подкожное введение НМГ эноксапарина пациентам, получавшим тромболитическую терапию, превзошло 48-часовую внутривенную инфузию НФГ по способности предотвращать реокклюзию коронарной артерии и рецидив ИМ (25). Преимущество эноксапарина наметилось уже через 48 часов (предотвращено 5 случаев смерти или рецидива ИМ на каждую 1000 леченных больных), заметно увеличилось к 8 суткам (предотвращен 21 такой случай) и сохранялось неизменным вплоть до 30 суток после начала исследования. Оно было достигнуто ценой 7 дополнительных крупных кровотечений на каждые 1000 леченных больных, однако частота внутричерепных кровотечений не увеличилась. Полученные результаты относятся как к случаям использования фибрин-специфичных препаратов (тенектеплазы, алтеплазы), так и стрептокиназы (26).
В рандомизированном двойном слепом плацебо-контролируемом сравнительном клиническом испытании OASIS-6 участвовало 12092 больных (27). Его организация была достаточно сложной. Так, некоторые больные получали тромболитическую терапию (45% – в основном с использованием стрептокиназы), у некоторых было выполнено первичное ЧКВ (31%), а у остальных реперфузионного лечения не проводилось. Кроме того, 1-недельное подкожное введение синтетического пентасахарида фондапаринукса сопоставлялось либо с плацебо, либо с 48-часовой инфузией НФГ. В целом при длительном введении фондапаринукса с группой контроля, включавшей как больных, получавших плацебо, так и больных, получавших НФГ, риск смерти или рецидива ИМ в ближайший месяц достоверно уменьшился на 17%, что соответствует предотвращению 15 таких событий на каждую 1000 леченных больных. Частота серьезных кровотечений при этом не увеличилась. Вместе с тем есть основания полагать, что полученный результат имеет отношение, прежде всего к случаям введения стрептокиназы, а также к больным, у которых не проводилось реперфузионного лечения.
Важной особенностью (и недостатком) крупных клинических испытаний антитромботических средств при острой окклюзии коронарной артерии является объединение различных подходов к ведению подобных больных (тромболитическая терапия с помощью различных препаратов, первичное ЧКВ, отказ от реперфузионного лечения, многочисленные особенности выполнения ЧКВ в более поздние сроки заболевания). В результате судить о предпочтительном лечении в той или иной клинической ситуации приходится, ориентируясь на результаты, полученные при анализе подгрупп. А это, как известно, недостаточно надежно и может стать источником серьезных заблуждений (2). Тем не менее, поскольку другие факты в настоящее время не доступны, следует учитывать, что более очевидны результаты, полученные на большем числе испытуемых, а также в подгруппах, которые формировались с использованием стратификации – метода распределения больных, позволяющего обеспечить исходную сопоставимость лиц, у которых проводится сравнение различных способов лечения. Результаты анализа подгрупп в крупных исследованиях ExTRACT-TIMI 25 и OASIS-6 представлены в таблице.
Однако поскольку прямого сравнения (в рамках одного исследования, на одном контингенте больных) эноксапарина и фондапаринукса при ОКСПST не проводилось, судить о большей эффективности или безопасности какого-либо из этих препаратов нельзя. Можно говорить лишь о большей или меньшей убедительности результатов их сопоставления со стандартными подходами к лечению, полученных при анализе подгрупп в каждом из проведенных клинических испытаний.
В целом накопленные факты свидетельствуют, что при отсутствии реперфузионного лечения можно ожидать пользы от 1-недельного применения ревипарина или фондапаринукса, в сочетании со стрептокиназой – от ревипарина, фондапаринукса или эноксапарина, а в сочетании с фибрин-специфичными препаратами (тенектеплаза, алтеплаза) – от эноксапарина. При этом увеличения частоты серьезных кровотечений либо не ожидается (фондапаринукс, сочетание стрептокиназы и эноксапарина), либо с учетом положительного влияния на исходы заболевания она представляется приемлемой (ревипарин, сочетание фибрин-специфичных фибринолитиков и эноксапарина). В случаях, когда на фоне продолжающегося использования антикоагулянта необходимо выполнить ЧКВ, у больных, получающих эноксапарин, процедура может быть выполнена без дополнительного введения НФГ (2, 3, 18, 28). Более того, применение НФГ в этих случаях нежелательно. У больных, получающих фондапаринукс, во время процедуры есть опасность возникновения тромбоза катетера. Для предотвращения этого осложнения рекомендуют дополнительно вводить НФГ, однако методика сочетания указанных препаратов пока не отработана (обычно говорят о применении стандартных доз НФГ) (2).
Вместе с тем данные об эффективности и приемлемой безопасности продленного введения антикоагулянтов получены у больных без исходно высокого риска кровотечений и выраженного нарушения функции почек. Не исключено, что длительное введение, по крайней мере, низкомолекулярных гепаринов у больных со сниженным клиренсом креатинина (в частности, менее 60 мл/мин) не столь эффективно и безопасно (29). В настояшее время у больных с клиренсом менее 30 мл/мин рекомендуется снижение дозы эноксапанина в 2 раза (одна подкожная инъекция в сутки вместо двух), а применение фондапаринукса считается противопоказанным. Поэтому очевидно, что при использовании фибрин-специфичных фибринолитиков не утрачивает значение и 48-часовая инфузия НФГ. Продлять введение НФГ вплоть до одной недели не рекомендуется, поскольку такой подход не изучен и существуют опасения роста числа случаев иммунной тромбоцитопении (2). Кроме того, остается в силе и возможность применения стрептокиназы без гепарина.
Стандартным дополнением к первичной ЧКВ считается внутривенное болюсное введение НФГ, обеспечивающее достаточное удлинение активированного времени свертывания крови и новых данных, способных изменить эту практику, в последнее время не появилось. Результаты выполнения процедуры на фоне использования фондапаринукса указывают на необходимость дополнительного введения НФГ из-за повышенного риска тромбоза катетера и кронарных осложнений процедуры, однако методика сочетания этих антикоагулянтов не отработана (27). При первичном ЧКВ достаточно хорошо установлена польза введения блокатора гликопротеинов IIb/IIIa тромбоцитов абциксимаба (1-3, 18, 19). Однако при этом остается неясным, когда лучше начинать внутривенную инфузию препарата – непосредственно перед ЧКВ или за какое-то время до процедуры (18).
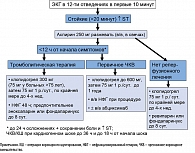
Упрощенная схема применения антитромботических препаратов у больных с ОКСПST, разработанная с учетом современных рекомендаций, представлена на рисунке.
В последние годы были усовершенствованы подходы к антитромботическому лечению больных с признаками острой окклюзии коронарной артерии, возникшей вследствие прогрессирования атеросклероза. Стала очевидной целесообразность добавления к ацетилсалициловой кислоте клопидогрела, а также продленного использования антикоагулянтов прямого действия у больных без исходно высокого риска кровотечений и существенно нарушенной функции почек. Появление новых препаратов дало возможность более дифференцированно выбирать лечение у конкретного больного. Вместе с тем многие клинические рекомендации основываются на косвенных свидетельствах эффективности и безопасности предложенных подходов. Поэтому сохраняется необходимость в проведении новых «доказательных» клинических испытаний, способных внести коррективы в сложившиеся представления об оптимальном лечении больных острым коронарным синдромом со стойкими подъемами сегмента ST на ЭКГ.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.