Церебральный атеросклероз: роль в развитии инсульта и хронической цереброваскулярной патологии
- Аннотация
- Статья
- Ссылки
- English

Введение
Церебральный атеросклероз (ЦА) – прогрессирующий патологический процесс, вызывающий атеросклеротическое поражение сосудов головного мозга с формированием атеросклеротических бляшек, что приводит к недостаточности кровоснабжения головного мозга. Атеросклероз преимущественно поражает артерии крупного и среднего калибра как экстракраниальной, так и интракраниальной локализации. К экстракраниальным артериям относятся позвоночные и внутренние сонные артерии, к интракраниальным – передняя мозговая артерия, средняя мозговая артерия (СМА), задняя мозговая артерия, внутренняя сонная артерия (ВСА), базиллярная артерия, коммуникантные артерии, а также более мелкие сосуды, отходящие от указанных артерий.
В строении интракраниальных и экстракраниальных артерий можно выделить ряд различий. Внутричерепные артерии представляют собой артерии в основном мышечного типа с малым содержанием в стенке эластических волокон. В данных артериях более тонкая медиа и адвентиция, а также повышенная активность антиоксидантных ферментов (супероксиддисмутазы марганца, супероксиддисмутазы меди и цинка, каталазы) по сравнению с экстракраниальными артериями. Такие особенности строения стенки внутричерепных артерий могут обусловливать различия в течении атеросклеротического процесса. Двумя основными чертами, которые отличают интракраниальный атеросклероз от экстракраниального, являются более позднее начало и более стабильный фенотип бляшек [1].
ЦА как интракраниальных, так и экстракраниальных артерий лежит в основе возникновения ишемического инсульта, чаще атеротромботического происхождения, и приводит к развитию хронической цереброваскулярной недостаточности.
Эпидемиология
Оценить точную распространенность ЦА сложно, поскольку долгие годы болезнь протекает бессимптомно. В среднем частота ЦА в популяции колеблется от 4,2 до 12,5% [2]. Распространенность церебральных атеросклеротических бляшек и церебрального стеноза у пациентов с ишемическим инсультом значительно выше – 43,2 и 62,2% соответственно [3], причем выраженность ЦА связана с высокой летальностью при инсульте и определяет риск рецидивов [4]. Годовая частота повторных ишемических эпизодов у пациентов с ЦА колеблется от 10 до 50% [5]. Ежегодные показатели смертности составляют 12,4% при внутричерепном стенозе ВСА, 6,8% – при стенозе СМА и 11,6% – при стенозе позвоночных артерий [6].
Церебральный атеросклероз, тромбоз и инсульт: патофизиологические механизмы
К факторам повышенного риска развития атеросклероза относятся артериальная гипертензия, сахарный диабет и курение. Первично происходят повреждение и дисфункция эндотелия, в дальнейшем снижается реактивность сосудов, что способствует избыточной продукции молекул адгезии и нарушению работы гематоэнцефалического барьера (ГЭБ). [7]. Повышение проницаемости ГЭБ сопровождается пропотеванием плазмы крови сначала в стенку сосуда, что усугубляет ее повреждение, а затем в паренхиму головного мозга с формированием периваскулярного отека, хронической гипоперфузии и вторичных морфологических изменений [8].
Поврежденный эндотелий вырабатывает меньшее количество вазодилатирующих факторов, таких как простациклин I2, окись азота, кинин, натрийуретический пептид C. При этом количество вырабатываемых факторов вазоконстрикции (тромбоксан АII, эндотелины, ангиотензин II и др.) увеличивается, что еще больше усугубляет дефицит кровотока [9].
Атеросклероз является хроническим воспалительным процессом [10]. Поврежденный эндотелий вырабатывает молекулы адгезии, провоспалительные цитокины, белки хемотаксиса, что в свою очередь приводит к миграции моноцитов, Т-клеток в субэндотелиальное пространство и усугубляет воспалительный процесс. Избыточная продукция провоспалительных цитокинов также способствует миграции гладкомышечных клеток из медиа, стимулируя их пролиферацию и образование плотного внеклеточного матрикса, содержащего коллагеновые и эластиновые волокна. В результате образуется первичная субэндотелиальная фиброзная бляшка. Формирование фиброзной бляшки является второй стадией атеросклероза – стадией липосклероза [11].
Строение сформировавшейся бляшки во многом зависит от структуры ее покрышки и размеров липидного ядра. В ряде случаев бляшки имеют плотную, хорошо выраженную фиброзную покрышку из соединительной ткани, значительную часть которой составляют компактно расположенные коллагеновые волокна. Содержание липидов и клеточных элементов в таких бляшках незначительно. Риск разрыва бляшек невелик, однако они существенно выдаются в просвет сосуда, вызывая гемодинамически значимое его сужение. Подобные бляшки называются стабильными. Бляшку с выраженным липидным ядром, составляющим более 40% бляшки, и относительно тонкой соединительнотканной капсулой (до 65 мкм) называют нестабильной. Такая бляшка чаще становится источником эмболии за счет высокого риска разрыва фиброзной капсулы [12]. Одним из факторов возникновения нестабильности бляшек является активность воспалительного процесса. В настоящее время выделяют несколько типов осложненных бляшек: липидный, дистрофически-некротический и воспалительно-эрозивный.
Бляшки липидного типа характеризуются выраженным ядром и относительно небольшой фиброзной покрышкой толщиной от 15 до 45 мкм. Атероматозное ядро занимает от 39,3 до 85,4% бляшки и состоит из атеронекротического детрита с большим количеством липидов, холестерина, пенистых клеток. Фиброзная покрышка содержит значительное количество воспалительных клеток-макрофагов и Т-лимфоцитов, распределенных неравномерно, при очень небольшом проценте гладкомышечных клеток и коллагеновых волокон, чем и объясняется ее нестабильность и склонность к разрыву. Со временем происходит дополнительная инфильтрация покрышки бляшки липидами за счет как внутриклеточных пенистых клеток, так и внеклеточной инфильтрации вдоль коллагеновых волокон, что еще больше истончает фиброзное кольцо и увеличивает риск разрыва. Выход атероматозных масс через поврежденный участок сосуда способствует активации тромбоцитов, их адгезии на поверхности бляшки. В результате создаются условия для тромбообразования с высоким риском дальнейшего тромбоза.
Бляшки дистрофически-некротического типа характеризуются толстой фиброзной капсулой (толщина свыше 90 мкм) и небольшим липидным ядром – не более 20% общей площади бляшки. В массивной покрышке формируются большое количество зон некроза, выраженные дистрофические изменения и достаточно часто обнаруживаются очаги кальцификации как в самом фиброзном слое, так и непосредственно под ним, что и создает условия для нестабильности. Кальцификаты способствуют постепенному разрушению покрышки, ее разрывам, дальнейшему формированию тромбоза. Коллагеновые волокна в таких бляшках истончены, клеточная инфильтрация воспалительными клетками или липидами выражена слабо.
Бляшки воспалительно-эрозивного типа характеризуются формированием эрозий – воспалительных и липидных. При воспалительной эрозии в поверхностных участках покрышки отмечаются скопления воспалительных клеток с последующей гибелью покрывающих этот участок эндотелиальных клеток и формированием деструкций и тромбозов на ее поверхности. При формировании липидных эрозий происходит скопление пенистых клеток в субэндотелиальном пространстве бляшки, что также ведет к гибели эндотелиоцитов и образованию зоны повреждения. Липидное ядро данных бляшек имеет относительно малые размеры, а фиброзная покрышка обильно инфильтрирована пенистыми клетками.
Атеросклеротическая бляшка в процессе развития может оставаться стабильной, нестабильной или переходить из одного состояния в другое. Надо отметить, что даже стабильная бляшка при повреждении покровного эпителия может осложняться поверхностными надрывами с формированием пристеночного тромба и облитерацией просвета сосуда. Еще больше перекрытию сосуда может способствовать кровоизлияние в атеросклеротическую бляшку, которое не только значительно увеличивает объем ядра, но и может приводить к дальнейшим ее разрывам [13]. Исходное формирование нестабильных вариантов или осложненное течение стабильных бляшек с образованием пристеночного или облитерирующего тромба в просвете сосуда является патогенетическим механизмом развития ишемического инсульта [14–16].
Факторы риска церебрального атеросклероза
Возраст – немодифицируемый фактор риска ЦА. С возрастом увеличивается количество стенозов церебральных артерий, что связано с прогрессированием атеросклероза с течением времени. Количество стенозов выше у пациентов в возрасте ≥ 65 лет. Согласно результатам патологоанатомических исследований, тяжелый ЦА (более 70%) встречается у 43% пациентов на шестом десятилетии, у 65% – на седьмом десятилетии и у 80% – на восьмом и девятом десятилетиях.
Артериальная гипертония вызывает эндотелиальную дисфункцию и является непосредственной причиной повреждения артериальной сосудистой стенки. За счет атеросклероза сосудов головного мозга и последующего снижения их реактивности сокращается и способность сосудов головного мозга обеспечивать адекватное кровоснабжение головного мозга в условиях повышения артериального давления (АД). Одинаковое влияние на прогрессирование ЦА оказывает как систолическое АД (САД), так и диастолическое АД (ДАД). При этом наиболее значимым фактором риска повторного инсульта и других сосудистых нарушений у пациентов с симптоматическим ЦА является среднее САД ≥ 140 мм рт. ст. Наряду с этим на возникновение инсульта влияет суточная и долгосрочная вариабельность АД. Под вариабельностью АД понимают колебания АД, превышающие физиологическую норму, в течение суток для суточной вариабельности или в течение нескольких месяцев для долгосрочной. При этом на вероятность развития инсульта влияет вариабельность САД и ДАД в дневные часы и САД в ночные часы [17].
Дислипидемия – установленный фактор риска атеросклероза, который включает повышение содержания липопротеинов низкой плотности (ЛПНП), снижение уровня липопротеинов высокой плотности (ЛПВП), повышение концентрации триглицеридов и липопротеина(а) (ЛП(а)). Накопление ЛПНП в интиме инициирует развитие и прогрессирование атеросклероза и в конечном итоге приводит к образованию бляшки. ЛПВП играет антиатерогенную роль, способствуя выведению холестерина из макрофагов, ингибируя окисление ЛПНП, миграцию гладкомышечных клеток и агрегацию тромбоцитов. Aполипопротеин А1 (ApoА1), основной аполипопротеин в составе ЛПВП, может инициировать обратный транспорт холестерина из кровеносных сосудов в печень, а также оказывает противовоспалительное и антиоксидантное действие. Аполипопротеин В (ApoB) генерирует множество провоспалительных продуктов и усугубляет атерогенез в сосудистой стенке посредством реакции окисления. Установлена связь между соотношением ApoB/ApoA1 и наличием и тяжестью ЦА. Это позволяет предположить, что соотношение ApoB/ApoA1 может служить биомаркером для прогнозирования риска и тяжести ЦА. Кроме того, у пациентов с ЦА высокое соотношение ApoB/ApoA1, вероятно, является показателем глубокой подкорковой ишемии, потенциальным фактором риска снижения когнитивных способностей и повторного инсульта. У пациентов с инфарктом головного мозга в анамнезе уровень ApoA1 ниже, чем у пациентов без инфаркта головного мозга, тогда как уровень ApoB существенно не отличается. Повышение уровня ЛПВП после инсульта наряду со снижением остаточных липопротеинов и низким соотношением ApoB/ApoA1 может выполнять защитную функцию в предотвращении симптоматического прогрессирования ЦА [18]. ЛП(а) представляет собой макромолекулярный комплекс, состоящий из ЛПНП и гидрофильного гликопротеина, называемого аполипопротеином (а). Уровень ЛП(а) является генетически детерминированным. При этом повышение уровня ЛП(а) считается аутосомно-доминантно наследуемым признаком. ЛП(а) участвует в формировании и росте атеросклеротической бляшки: стимулирует движение моноцитов, окисление ЛПНП и захват окисленных ЛПНП макрофагами, а также способствует разрастанию гладкомышечных клеток. Повышение уровня ЛП(а) ассоциировано с ЦА и является независимым фактором риска возникновения инсульта [19].
Метаболический синдром (МС) также относится к факторам риска ЦА. МС диагностируется при абдоминальном ожирении (для европейской популяции окружность талии ≥ 94 см у мужчин и ≥ 80 см у женщин), уровне АД ≥ 130/ ≥ 85 мм рт. ст., содержании триглицеридов ≥ 1,7 ммоль/л, низком уровне холестерина ЛПВП (у мужчин ≤ 1,03 ммоль/л, у женщин ≤ 1,29 ммоль/л), уровне глюкозы в плазме крови натощак ≥ 5,6 ммоль/л, наличии в анамнезе сахарного диабета или приема противодиабетических препаратов. МС способствует гиперкоагуляции и провоспалительному состоянию, связанному с резистентностью к инсулину, что может способствовать снижению антиоксидантной защиты и эндогенной фибринолитической активности церебрального кровообращения. МС выявлен примерно у половины пациентов с ЦА и ассоциирован с высоким риском рецидива ишемического события.
Курение увеличивает окислительную модификацию ЛПНП и изменяет биосинтез оксида азота (NO), влияя на возникновение и прогрессирование атеросклероза. Курение более распространено среди пациентов с интракраниальным атеросклерозом по сравнению с пациентами с экстракраниальным атеросклерозом. Курение может играть определенную роль в развитии ЦА у пациентов с острым ишемическим инсультом.
Биологические маркеры
Адипонектин – белок, секретируемый жировыми клетками, который оказывает защитное действие против атеросклероза и образования бляшек. Он стимулирует выработку NO в эндотелиальных клетках, снижает резистентность к инсулину, увеличивая поглощение глюкозы. Он играет противовоспалительную и антиатерогенную роль, подавляя экспрессию воспалительных цитокинов и молекул адгезии, которые связаны с транспортировкой лейкоцитов и формированием неоинтимальных клеток, снижает поглощение холестерина и ингибирует трансформацию макрофагов в пенистые клетки. Адипонектин может ингибировать вторичное воспаление и способствовать ангиогенезу после ишемии головного мозга [20]. Гипоадипонектинемия связана с ожирением, сахарным диабетом 2-го типа, метаболическим синдромом, дислипидемией, артериальной гипертонией [21]. Гипоадипонектинемия увеличивает риск системного атеросклероза и, как следствие, ишемического инсульта [22]. Чем ниже уровень адипонектина, тем более прогрессирующим будет ЦА.
Интерлейкин (ИЛ) 6, первичный воспалительный цитокин, имеет высокие значения при острых инфекциях, хронических воспалительных состояниях, ожирении, онкологическом заболевании, физиологическом стрессе и ишемическом инсульте [23]. Под действием вазоактивных пептидов, активных форм кислорода и других цитокинов различные клетки, включая моноциты, макрофаги и клетки пораженной сосудистой стенки, могут экспрессировать и высвобождать ИЛ-6 [23]. ИЛ-6 играет решающую роль в стимуляции последующей воспалительной реакции, ответственной за атеросклероз, за счет активации эндотелиальных клеток, усиления эндотелиальной дисфункции, ускорения пролиферации и миграции гладкомышечных клеток, индукции дифференцировки лимфоцитов, стимуляции синтеза в печени белков острой фазы [24, 25]. Существует связь между уровнями ИЛ-6 в сыворотке крови и эхогенностью бляшек сонных артерий. ИЛ-6 способствует образованию нестабильных бляшек и их тромботическим осложнениям [26]. Таким образом, ИЛ-6 является важным регулятором, влияющим на развитие, прогрессирование и осложнения атеросклероза на разных стадиях и может быть использован в качестве потенциальной терапевтической мишени.
С-реактивный белок (СРБ), биомаркер системного воспаления, участвует во всех стадиях развития атеросклероза. СРБ поддерживает и усиливает воспалительную реакцию в мозговых артериях, активирует каскад комплемента. СРБ инициирует хемотаксис лейкоцитов, экспрессию молекул адгезии и запускает апоптоз. СРБ может быть полезным биомаркером для оценки риска развития и дестабилизации ЦА.
Диагностика стенозирующего атеросклероза
Основным методом выявления атеросклероза брахиоцефальных артерий является ультразвуковое исследование (УЗИ). Это самый простой метод, используемый для скринингового обследования пациентов. Однако данный метод носит субъективный характер, поэтому желательно выполнять дублирующее исследование для получения более точной информации о степени стеноза и строении атеросклеротической бляшки. Ультразвуковая оценка атеросклеротических бляшек включает определение степени выраженности стеноза, а также оценку структуры бляшки и характеристик ее поверхности. В ходе УЗИ определяется утолщение внутренней и средней оболочек сосуда. Изменение толщины комплекса «интима – медиа» – ранний признак атеросклероза. С помощью УЗИ брахиоцефальных артерий можно не только оценить выраженность стеноза сосуда, но и получить представление о строении бляшки. Так, фиброзно-липидные бляшки характеризуются низкой эхогенностью за счет высокого содержания липидов, фиброзные бляшки – более высокой эхогенностью, что связано с высоким содержанием коллагеновых волокон. УЗИ дополняется ультразвуковой допплерографией, которая позволяет оценить линейную скорость кровотока. Для диагностики атеросклероза интракраниальных артерий используются ультразвуковые методы, магнитно-резонансная (МР) и компьютерная томография (КТ), цифровая субтракционная ангиография, а также прямая ангиография. Ангиография считается золотым стандартом диагностики [27]. Она позволяет точно определить степень стеноза артерии. Однако ангиография – инвазивное вмешательство, которое предполагает введение контрастного вещества и несет определенные риски. В частности, метод сопряжен с развитием преходящего и стойкого неврологического дефицита, частота которого может достигать 1,8 и 0,6% соответственно [28].
В отношении точности более безопасных и доступных неинвазивных методов однозначные данные отсутствуют. Так, при МР-ангиографии визуализация просвета сосуда зависит от кровотока в нем, при этом степень сужения сосуда может искажаться в случае критического стеноза с низким кровотоком (он может выглядеть как окклюзия), а также при стенозах большой степени при высокой скорости кровотока.
В некоторых исследованиях показано, что МР-ангиография может использоваться в качестве скрининга при исследовании интракраниальных артерий, особенно области сифона внутренней сонной артерии. Однако она недостаточно точна для определения выраженности стеноза [29].
КТ-ангиография примерно соответствует МР-ангиографии по точности диагностики, но некоторые исследователи считают, что данный метод даже превосходит МР-ангиографию и уступает в точности только прямой рентгеновской ангиографии [30]. КТ- или МР-ангиография может быть дополнена КТ- или МРТ-перфузией.
Церебральный атеросклероз и дисциркуляторная энцефалопатия
Дисциркуляторная энцефалопатия (ДЭП) – прогрессирующая форма цереброваскулярной патологии, связанная с многоочаговым или диффузным поражением головного мозга и характеризующаяся развитием комплекса неврологических и нейропсихических расстройств. В отличие от инсульта, преимущественно связанного с поражением крупных мозговых сосудов, в основе большинства случаев ДЭП лежит поражение мелких/малых сосудов головного мозга [31]. Несмотря на то что атеросклероз поражает артерии среднего и крупного калибра, риски развития церебральной микроангиопатии значительно увеличиваются начиная с этапа изменения толщины комплекса «интима – медиа», то есть практически с самых ранних стадий патологического процесса.
Существует несколько ключевых механизмов, посредством которых ЦА может влиять на поражение малых церебральных артериол. Прежде всего значительное увеличение жесткости сосудистой стенки. Известно, что по мере разветвления артериального русла жесткость сосудистой стенки нарастает (от большего диаметра к меньшему). В условиях ЦА и снижения эластичности и амортизации крупных как экстра-, так и интракраниальных артерий происходит дополнительное увеличение жесткости сосудистой стенки, которое становится максимальным в наиболее дистальных ответвлениях. К ним и относятся малые церебральные сосуды. Таким образом, атеросклероз приводит к формированию артериолосклероза (рис. 1).
Еще одной причиной формирования хронической цереброваскулярной патологии в условиях ЦА является нарушение реактивности сосудистой стенки вследствие формирующейся ригидности артерий, что нарушает возможности нейрогенной и миогенной регуляции тонуса мозговых сосудов. Снижение реактивности и возможности подстраивать диаметр сосуда с учетом особенностей перфузионного кровотока приводит к нарушениям кровоснабжения и гомеостаза ЦНС. Так, в норме, при значительном ограничении кровотока, в условиях сохранной ауторегуляции и реактивности, происходит расширение сосуда, что обеспечивает дополнительный приток крови и поддерживает кровоснабжение. И наоборот, при значительном повышении перфузионного давления в норме развивается вазоконстрикция, что обеспечивает снижение поступления крови и поддерживает постоянство внутренней среды. Отсутствие этих механизмов приводит к постоянному нарушению мозгового кровоснабжения и дополнительному повреждению микроциркуляторного русла. Именно поэтому степень ограничения мозгового кровотока при атеросклеротическом повреждении экстракраниальных артерий прежде всего определяется не размером бляшки: даже при стенозе брахиоцефальных артерий более 70% у многих пациентов признаков ДЭП не выявляется, что связано с сохранными механизмами ауторегуляции и возможностью подстраивать кровоток, несмотря на механические ограничения. Возможна и обратная ситуация: бляшка относительно небольшая, при этом отмечаются значительные признаки дефицита кровотока, что опять же будет определяться нарушением реактивности сосудистого русла, а не преградами для притока крови в виде атеросклеротической бляшки.
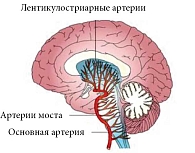
В качестве третьей причины развития хронических цереброваскулярных заболеваний при ЦА можно назвать микроэмболизацию. Так, микроэмболы обнаруживаются у 36,1% пациентов с симптоматическим атеросклеротическим стенозом СМА во время острой фазы церебральной ишемии [15]. Риски эмболизации дистальных отделов малых церебральных сосудов прежде всего определяются стабильностью бляшки и наличием/отсутствием сопутствующей артериальной гипертензии с нарушением перфузионного кровотока. Особенностью лентикулостриарных артерий, которые являются главным пулом малых церебральных сосудов, поражаемым при ДЭП, является перпендикулярность их отхождения от более крупных артериальных стволов (рис. 2). Это создает условия для формирования турбулентных потоков, поскольку ламинарность кровотока в подобных условиях нарушается. В условиях дополнительного повышения перфузионного давления интенсивность формирующихся турбулентных потоков значительно нарастает, что, с одной стороны, приводит к повреждению эндотелия, с другой – при наличии даже небольших атеросклеротических бляшек в устье лентикулостриарных артерий способствует отрыву их фрагментов и эмболизации концевых частей малых сосудов.
Таким образом, увеличение жесткости, снижение реактивности сосудистой стенки с нарушением ауторегуляции, а также микроэмболизация фрагментами атеросклеротической бляшки – ключевые механизмы, посредством которых ЦА увеличивает риск развития хронической цереброваскулярной патологии [16]. Доказано, что атеросклероз церебральных артерий служит независимым фактором риска возникновения атрофии головного мозга [32].
Заключение
Церебральный атеросклероз – системное прогрессирующее мультифокальное заболевание, преимущественно поражающее крупные и средние артерии и являющееся одной из основных причин ишемического инсульта и транзиторной ишемической атаки. Кроме того, ЦА достоверно увеличивает риск развития ДЭП и других форм хронической цереброваскулярной патологии, что связано с эндотелиальной дисфункцией, снижением реактивности сосудистой стенки и нарушением ауторегуляции. По некоторым данным, ЦА может увеличивать риск возникновения атрофии мозга и болезни Альцгеймера, что, по всей видимости, обусловлено значительной ролью нейровоспаления и окислительного стресса в его развитии.
Таким образом, разнообразие механизмов ЦА и многофакторность причин его развития определяют необходимость поиска новых индивидуальных стратегий терапии и профилактики этого состояния.
Авторы заявляют об отсутствии конфликта интересов.
A.S. Litvinenko, E.E. Vasenina, PhD, Prof., O.S. Levin, PhD, Prof., A.G. Komarova, S.A. Bliznyuk, PhD, Yu.V. Karabach, N.M. Krivosheeva, PhD, E.I. Yakupova, A.A. Shavarov, N.L. Lyakhova, PhD
Multidisciplinary Scientific-Clinical Center named after S.P. Botkin
Russian Medical Academy of Continuous Professional Education
Contact person: Alisa S. Litvinenko, alisalitvinenko@mail.ru
Cerebral atherosclerosis (CA) is a progressive pathological process that causes stenosis of the cerebral vessels, mainly medium and large caliber arteries. CA underlies a large number of stroke cases, predominantly of the atherothrombotic subtype, determines the risk of recurrent ischemic events, and also negatively impacts patient mortality. Furthermore, СА significantly increases the risk of chronic cerebrovascular disease.
This is largely due to increased vascular wall stiffness, reduced vascular reactivity, impaired autoregulation, and high risk of microembolization. The causes and mechanisms of CA are multifactorial and include metabolic disorders, endothelial dysfunction, neuroinflammation, oxidative stress, cellular apoptosis, and many other.
This review is dedicated to the role of CA in the development of both acute and chronic cerebrovascular pathology.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.