Современные подходы к лечению бронхиальной астмы
- Аннотация
- Статья
- Ссылки


Этиология бронхиальной астмы
Бронхиальная астма – это хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. Хроническое воспаление обусловливает развитие бронхиальной гиперреактивности, которая приводит к повторяющимся эпизодам свистящих хрипов, одышки, чувства заложенности в груди и кашля, особенно по ночам или ранним утром. Эти эпизоды обычно связаны с распространенной, но изменяющейся по своей выраженности обструкцией дыхательных путей в легких, которая часто бывает обратимой либо спонтанно, либо под действием лечения [1].
Выделяют внутренние и внешние факторы, влияющие на развитие и проявления бронхиальной астмы. К внутренним факторам относятся: пол, ожирение, генетическая обусловленность (гены, предрасполагающие к атопии, и гены, предрасполагающие к бронхиальной гиперреактивности). К внешним факторам относятся: аллергены, инфекции (чаще вирусные), профессиональные вредности, курение, загрязнение воздуха, питание. Наиболее важными факторами, ответственными за развитие БА, являются аллергены, которые сенсибилизируют дыхательные пути, провоцируют начало заболевания и в дальнейшем поддерживают течение болезни. Выявление и элиминация аллергенов являются залогом успешного лечения БА.
Труднее всего бороться с бытовыми аллергенами, из которых наибольшее значение имеют клещи домашней пыли. Они содержатся в коврах, драпировочном материале, постельных принадлежностях, мягких игрушках, мягкой мебели. Клещевая БА характеризуется круглогодичным возникновением обострений, приступы развиваются преимущественно ночью. Рекомендуют исключение из обихода вышеперечисленных предметов, в качестве набивного материала для одеял и подушек желательно использовать синтепон, для уничтожения клещей применяют аттрактанты, обязательна ежедневная влажная уборка помещения, кипячение постельного белья, его вымораживание или проветривание на солнце.
Широко распространены аллергены животного происхождения: шерсть, пух, перо, перхоть, экскременты, слюна разных видов животных (кошек, собак, хомяков, морских свинок, птиц, кроликов, а также тараканов). Не следует держать в квартире аллергиков аквариумы, так как сухой корм для рыб обладает выраженной аллергенной активностью. Даже если животного уже нет в квартире, высокий уровень аллергенов сохраняется в течение нескольких лет.
Грибковые аллергены вызывают сенсибилизацию к плесневым и дрожжевым грибам. Грибы содержатся как внутри помещений, так и в окружающей среде. Наиболее часто грибковому заражению подвержены ванные комнаты, подвальные помещения. Грибы могут находиться в большом количестве весной в непросушенной даче, в прелой листве на приусадебном участке. Необходимо чаще проветривать помещения, бороться с влажностью и очагами плесени.
Пыльцевые аллергены, вызывающие БА, могут быть трех видов: деревья и кустарники (береза, ольха, лещина, орешник, ива, дуб, каштан, тополь, ясень и др.); злаковые травы (тимофеевка, овсяница, мятлик, пырей, гречиха, пшеница и т.д.); сорные травы (лебеда, амброзия, одуванчик, конопля, крапива, полынь и т.д.). В условиях средней полосы России отмечается 3 пика обострения болезни: весенний (апрель – май), обусловленный пыльцой деревьев; летний (июнь – август), связанный с пыльцой злаковых; осенний (август – октябрь), обусловленный пыльцой сорных трав. Уменьшение контакта с пыльцой осуществляется путем ограничения прогулок, кондиционирования воздуха жилых помещений, временного переезда на жительство в климатические зоны, где период цветения причинно-значимых растений завершился или еще не начался. Эффективна специфическая иммунотерапия.
Факторами, способствующими возникновению БА, являются респираторные инфекции, поллютанты промышленные (загрязнение атмосферного воздуха промышленными отходами), поллютанты помещений (газовые плиты), вещества, выделяемые при приготовлении пищи, химические вещества, выделяющиеся из отделочных материалов, моющие синтетические средства. Ведущее место среди лекарств, вызывающих приступы удушья, занимают антибиотики, особенно пенициллинового ряда, сульфаниламиды, витамины, ацетилсалициловая кислота и нестероидные противовоспалительные препараты. Отдельно выделяют аспириновую бронхиальную астму. Аллергенами могут быть продукты и вещества, содержащиеся в таких продуктах, как цитрусовые, шоколад, мед, орехи, а также искусственные красители, консерванты, гистамин и др. Нередко ингаляционные аллергены имеют общие антигенные свойства с определенными пищевыми веществами. Например, пыльца злаковых растений, пыльца полыни и подсолнечник могут спровоцировать перекрестную аллергию к ракообразным, пыльца березы – к моркови, яблокам, гречке [2].
Мощным фактором возникновения БА является табакокурение, в том числе и пассивное. Немаловажную роль в развитии бронхиальной астмы играют психологические аспекты. Спровоцировать приступы БА могут также стрессовые ситуации и физическая нагрузка. Еще Гиппократ отмечал роль эмоционального состояния больного в развитии и продолжительности проявления БА. Раздражение и страх часто могут провоцировать приступы болезни.
Терапия бронхиальной астмы
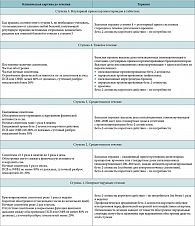
Лечение БА является комплексным. Оно включает соблюдение противоаллергического режима, медикаментозное и немедикаментозное лечение. Большое значение уделяется подбору базовой терапии, исходя из степени контроля над симптомами астмы. В настоящее время рекомендована классификация бронхиальной астмы по уровню контроля, которая отражает не только выраженность клинических проявлений, но и адекватность терапии (табл. 1). Все препараты для медикаментозного лечения подразделяются на два вида: для базисного лечения и для купирования обострения.
Национальная программа по стратегии лечения бронхиальной астмы рекомендует ступенчатый подход к терапии (табл. 2), при котором терапия становится интенсивнее по мере увеличения степени тяжести заболевания. Ступенчатый подход позволяет учитывать разнообразие тяжести течения заболевания у разных людей и у одного и того же пациента в разные временные периоды. Целью ступенчатого подхода является достижение контроля над астмой с применением наименьшего количества препаратов. Если течение астмы ухудшается, то количество и частота приема лекарств соответственно увеличиваются («ступень вверх»). Если же течение астмы хорошо контролируется в течение 3 мес., то количество и частота приема терапии уменьшаются («ступень вниз»).
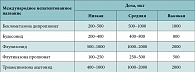
Снижение дозы базовой терапии проводится в том случае, если состояние больного остается стабильным не менее 3 мес. (что контролируется ведением дневника, данными пикфлуометрии и обследованием врача). Уменьшение терапии проводится ступенчато, предыдущая доза препарата уменьшается на 25–50%, или отменяются дополнительные препараты. При комбинированной терапии ингаляционными глюкокортикостероидами (ИГКС) и системными глюкокортикоидами (ГК) сначала снижают и отменяют системные гормональные препараты, не изменяя доз ИГКС. При снижении дозы препаратов необходимо контролировать симптомы БА, клинические проявления и показатели функции внешнего дыхания. В настоящее время наиболее эффективными препаратами для контроля заболевания являются ИГКС. Их назначение рекомендовано при персистирующей БА любой степени тяжести. Длительная терапия ИГКС значимо снижает частоту и тяжесть обострений. Чем выше степень тяжести БА, тем бóльшие дозы ингаляционных стероидов надо применять (табл. 3).
Противовоспалительный эффект ИГКС связан с их ингибирующим действием на клетки воспаления и их медиаторы, включая продукцию цитокинов, вмешательство в метаболизм арахидоновой кислоты и синтез лейкотриенов и простагландинов, снижение проницаемости микрососудов, предотвращение прямой миграции и активации клеток воспаления, повышение чувствительности бета-рецепторов гладкой мускулатуры. ИГКС увеличивают апоптоз и снижают количество эозинофилов путем ингибирования интерлейкина-5. Таким образом, ИГКС приводят к стабилизации клеточных мембран, уменьшают проницаемость сосудов, улучшают функцию бета-2-адренорецепторов, стимулируют эпителиальные клетки. Учитывая, что лечение ИГКС является местным, оно обеспечивает выраженный противовоспалительный эффект непосредственно в бронхиальном дереве с минимальными системными проявлениями.
Наиболее важной характеристикой ИГКС является липофильность, благодаря чему препарат накапливается в дыхательных путях, замедляется их высвобождение из тканей и увеличивается его сродство к глюкокортикоидному рецептору. Эти препараты быстрее захватываются из просвета бронхов и длительно задерживаются в тканях дыхательных путей. Именно липофильность отличает ИГКС от системных препаратов, поэтому бесполезно назначать ингаляции системных ГКС (гидрокортизона, преднизолона, дексаметазона). Они независимо от способа применения обладают только системным действием. К ИГКС относятся: бекламетазона дипропионат, будесонид, флутиказона пропионат, флунизолид, триамцинолона ацетонид, мометазона фуроат (табл. 4). Форма выпуска – дозированные аэрозоли, дозированные порошки, растворы для использования в небулайзерах.
Легочная биодоступность зависит от наличия или отсутствия носителя. Ингаляторы, не содержащие фреон, имеют лучшие показатели эффективности. Так, бекламетазона дипропионат с фреоновым носителем используется в дозах вдвое больших, чем при использовании без фреонового носителя. Количество ИГКС, доставляемое в дыхательные пути, зависит также от дозы, типа ингалятора и техники ингаляции.
Можно привести следующие принципы применения ИГКС.
- ИГКС следует рекомендовать тем больным, у которых обычная потребность в применении бета-2-агонистов короткого действия составляет 2–3 раза в день и больше.
- ИГКС могут позволить сократить применение системных ГК у больных с ГКС-зависимой БА.
- Контроль БА быстрее достигается при назначении более высоких доз ИГКС.
- Все препараты группы ИГКС в эквивалентных дозах достаточно эффективны.
- Доказана эффективность ИГКС при назначении их 2 раза в день. При увеличении приема до 4 раз в сутки эффективность повышается незначительно при тех же дозах.
- Стандартные дозы ИГКС (800 мкг бекламетазона) при неэффективности могут быть увеличены до 2000 мкг в пересчете на бекламетазон.
- Снижение доз ИГКС следует осуществлять, постепенно уменьшая дозу на 25–50%, после того как состояние остается устойчивым в течение 3 мес.
Основные пути доставки лекарственных средств в дыхательные пути:
- дозированные аэрозольные ингаляторы: обычные, активируемые вдохом («легкое дыхание»), в комбинации со спейсером;
- дозированные порошковые ингаляторы: одноразовые, мультидозовые резервуарные, мультидозовые блистерные;
- небулайзеры: ультразвуковые, струйные.
Практически все аэрозольгенераторы имеют как свои преимущества, так и недостатки: достаточная или недостаточная портативность, необходимость или отсутствие необходимости координации вдоха и начала ингаляции, заправка лекарственных средств в процессе использования или возможность применения без дозаправки, стоимость и др. Следует учитывать, что у 80% пациентов возникают трудности при использовании дозированных аэрозолей. Врач должен обучить пациента правильной технике ингалирования, рекомендовать для использования небулайзеры и спейсеры. Основное преимущество последних заключается в том, что в бронхи попадает гораздо больше лекарства, меньшее количество оседает в ротовой полости, горле, языке, что снижает риск получить осиплость голоса, грибковые осложнения и кашель от удара струи аэрозоля. Пациентам рекомендуется полоскание рта водой после ингаляции для предупреждения развития грибковой инфекции.
При длительном лечении высокими дозами ИГКС могут проявляться системные побочные эффекты: геморрагии, угнетение коры надпочечников, остеопороз, катаракта, глаукома. ИГКС не противопоказаны при сопутствующем туберкулезе. Учитывая возможность развития побочных осложнений терапии ИГКС, целесообразно проводить комбинированную терапию, позволяющую достичь контроля над бронхиальной астмой меньшими дозами ИГКС.
Начиная с 3-й ступени при недостаточности контроля астмы к ИГКС необходимо добавлять бета-2-агонисты длительного действия, которые рассматриваются как альтернатива увеличению доз ингаляционных ГК у больных, плохо отвечающих на противовоспалительную терапию. С одной стороны, назначение бета-2-агонистов должно предшествовать очередному повышению доз ИГКС. С другой стороны, назначение этих лекарственных средств в качестве монотерапии не должно практиковаться, так как они не обладают выраженным противовоспалительным действием. Кроме того, появились данные, что у отдельных пациентов применение бета-2-агонистов увеличивает риск смерти. Регулярное применение бета-2-агонистов может приводить к развитию рефрактерности.
Комбинированная терапия способна значительно улучшить функцию дыхания, уменьшить число ночных приступов, снизить потребность в бета-2-агонистах короткого действия. Добавление бета-2-агонистов длительного действия более эффективно, чем увеличение ГКС в 2 раза. Наиболее частое применение находят 2 препарата – сальметерол и формотерол. Сальметерол характеризуется медленным началом действия. Бронхорасширяющий эффект наступает через 10–20 мин после ингаляции и сохраняется 12 ч. Липофильность сальметерола многократно превышает аналогичный показатель сальбутамола. Препарат уменьшает проницаемость легочных капилляров, стабилизирует мембраны тучных клеток, уменьшает местную и системную концентрацию гистамина. У большинства больных контроль над БА достигается назначением сальметерола по 50 мкг 2 раза в сутки. Следует отметить, что сальметерол обладает и рядом неожиданных свойств, в частности, вызывает снижение патогенности P. aeruginosa и оказывает протективный эффект в отношении Н. influenzaе. Формотерол по клиническим свойствам не уступает сальметеролу. Поддерживающая доза составляет 12–24 мкг. При сравнении эффективности этих 2 препаратов исследователи не смогли выявить значимых отличий. Формотерол, как полный агонист бета-2-адренорецепторов, обладает несколько большим эффектом и отличается большей дозозависимостью, что позволяет подбирать минимально эффективную дозировку.
Комбинированные препараты для ингаляционного введения, содержащие в своем составе ГКС и бета-2-агонисты длительного действия, появились несколько лет назад. Несмотря на это, они занимают центральное место в терапии БА и являются самыми перспективными средствами в оптимизации лечения БА. Эффективность ИГКС в комбинации с бета-2-агонистами значительно возрастает. Кроме того, попав при ингаляции на один и тот же участок дыхательных путей, препараты могут лучше взаимодействовать друг с другом. Комбинированные лекарственные средства обеспечивают лучшую приверженность больных лечению, а их использование обходится дешевле, чем использование двух препаратов по отдельности. При использовании комбинированной терапии повышается эффективность препаратов в более низких дозах ИГКС. Соединение препаратов в одном ингаляторе облегчает пациенту выполнение техники ингалирования.
К комбинированным препаратам относятся Серетид Мультидиск (салметерола ксинафоат + флютиказона пропионат) и Симбикорт Турбухалер (будесонид и формотерола фумарата дигидрат). Использование этих препаратов дает возможность гибкого дозирования (1–4 ингаляции в сутки) в зависимости от состояния больного. На фоне применения бета-2-агонистов длительного действия должен быть продолжен прием препаратов с коротким действием для купирования симптомов.
Наиболее эффективны для облегчения симптомов бета-2-агонисты с быстрым началом действия. Они являются наиболее эффективными бронходилататорами и препаратами выбора для купирования острых симптомов астмы. Препараты выпускаются в виде аэрозоля, таблеток, порошка. Из бронхолитиков пролонгированного действия нашли применение теофиллин и тербуталин. Эти препараты достаточно эффективны для купирования симптомов БА в ночные часы.
Системные стероиды при БА обычно применяют при обострении заболевания перорально или внутривенно (значительно реже) высокими дозами. Механизмы действия такие же, как у ИГКС. Однако системные ГК могут достигать других клеток-мишеней и формировать при длительном приеме системные осложнения. Стандартная доза – 40–50 мг преднизолона в сутки в течение 5–10 дней в период обострения. Назначение системных ГК для длительного контроля при персистирующей БА сразу определяет больного как тяжелого и требует назначения высоких доз ИГКС и ингаляционных бета-2-агонистов длительного действия. Ведение больного на монотерапии системными стероидами является грубой врачебной ошибкой, так как требует более высоких доз глюкокортикостероидов и приводит к развитию тяжелых осложнений: остеопороза, сахарного диабета, ожирения и др. [4].
План обследования больных, длительно получающих ГК, включает регулярный контроль физического развития; контроль артериального давления; обследование с помощью щелевой лампы для своевременного выявления катаракты; контроль электролитного обмена; систематическое исследование уровня сахара; анализ кала на скрытую кровь; оценку признаков возможного воспалительного процесса в легких или других органах; исследование базального уровня кортизола.
При БА применяются такие ГКС, как преднизолон, метилпреднизолон, которые обладают минимальным минералокортикоидным эффектом, относительно коротким периодом полувыведения и нерезко выраженным действием на поперечнополосатую мускулатуру. Если возможно, их следует назначать через день. Триамцинолон противопоказан беременным и детям, поражает желудочно-кишечный тракт, ведет к развитию мышечной дистрофии. Дексаметазон обладает выраженным подавлением функции коры надпочечников и низкой эффективностью при БА. Применение депонированных форм длительного действия категорически не рекомендуется. Любой пациент, которому назначены системные ГК для контроля БА, подлежит обследованию для установления причин, приведших к необходимости данного лечения.
Обозначим некоторые врачебные ошибки при терапии БА:
- неназначение ИГКС;
- недооценка степени тяжести на предшествующих этапах;
- попытка контроля воспаления в период обострения низкими дозами ГК, применение бета-блокаторов;
- неправильный подбор системы доставки для ИГКС;
- продолжающаяся экспозиция аллергена.
В ряде случаев имеет место неправильный диагноз БА, где респираторные симптомы являются следствием другой патологии. Перед врачом стоит задача контролировать БА меньшими дозами ГК, как системными, так и ингаляционными. Следует снижать системные ГК на фоне высоких доз ИГКС, уменьшая дозу не ранее чем каждые 3–4 недели во избежание развития осложнений. На фоне ее снижения нельзя уменьшать дозы ИГКС. После отмены системных ГК титрование ИГКС должно проводиться с учетом ступенчатого подхода. Одним из триггеров в развитии и обострении БА является инфекционный компонент. Как правило, это БА в сочетании с бронхитом или пневмонией. При назначении антибактериальной терапии следует повторно уточнить аллергологический анамнез. Чаще всего аллергические реакции развиваются на пенициллины и сульфаниламиды. При аллергии на пенициллины существует риск развития побочных реакций на использование любых бета-лактамных антибиотиков (цефалоспорины, карбапенемы), тогда могут быть показаны доксициклин, макролиды.
Недокромил или кромогликат натрия могут быть использованы в качестве дополнения к ИГКС или как их альтернатива у больных, которые не могут или не хотят применять стероиды. Хотя недокромил более эффективен, чем плацебо, степень его эффективности не позволяет рекомендовать его в качестве препарата первого ряда при лечении БА. Препараты этого ряда тормозят высвобождение медиаторов аллергии, предотвращают бронхоконстрикцию. Назначаются препараты длительно – не менее 2 мес. по 2 ингаляции 2 раза в день [5].
Из других препаратов медикаментозного лечения БА нашли применение антилейкотриеновые препараты в связи с доказанной ролью лейкотриенов в формировании наиболее важных патогенетических звеньев БА. Антилейкотриеновые препараты снижают симптомы бронхиальной астмы, уменьшают кашель, обладают противовоспалительным и слабым бронхорасширяющим эффектом. Это 2 группы препаратов: первая – ингибиторы синтеза; вторая – блокаторы рецепторов к лейкотриенам. Побочный эффект этой группы препаратов – гепатотоксичность.
Анти-IgE-терапия показана пациентам с повышенным уровнем IgE в сыворотке крови. Данные об эффективности омализумаба получены в 7 клинических исследованиях, проведенных у больных атопической БА, включая исследование с участием только больных с тяжелой персистирующей атопической БА, неконтролируемой, несмотря на медикаментозное лечение согласно 4-й ступени по руководству GINA, и 6 других исследованиях с преимущественным участием пациентов с тяжелой персистирующей БА. Прием омализумаба позволил снизить частоту клинически значимых и тяжелых обострений БА на 38 и 50% соответственно, а частоту обращений за неотложной медицинской помощью – на 47%. На протяжении года после назначения омализумаба в дополнение к стандартной базисной терапии 49% пациентов не нуждались в пероральном приеме стероидов, что на 47% больше по сравнению с группой базисной терапии. Лечение омализумабом позволило на 80% снизить потребность больных в препаратах неотложной помощи (бета-2-агонистах короткого действия). По сравнению с плацебо омализумаб улучшал качество жизни пациентов с БА на 49%. Кроме того, по данным проведенных клинических исследований, омализумаб имеет высокий профиль безопасности [6].
Немедикаментозное лечение БА включает в себя: респираторную терапию (тренировка дыхания, контроль дыхания, интервальная гипоксическая тренировка); массаж, вибромассаж; лечебную физкультуру; спелеотерапию и горноклиматическое лечение; физиотерапию; иглоукалывание; фитотерапию; психотерапию; санаторно-курортное лечение. Одно из центральных мест в лечении занимают самообразование больных и диспансерное наблюдение. Для оценки эффективности лечения каждый больной должен проводить мониторинг БА с помощью пикфлоуметрии, что дает возможность объективной оценки течения заболевания и соответствующей коррекции схемы лечения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.