Современные подходы к терапии гиперпластических процессов эндометрия
- Аннотация
- Статья
- Ссылки


Гиперпластические процессы репродуктивной системы у женщин – системная патология, проявляющаяся множественным поражением органов-мишеней [1]. В структуре гинекологической патологии гиперпластические процессы эндометрия (ГПЭ) составляют от 5 до 26%.
Больные с ГПЭ в позднем репродуктивном, пре- и постменопаузальном периодах, особенно на фоне нейро-обменных нарушений, относятся к группе высокого риска развития рака эндометрия. Своевременная диагностика и адекватные методы лечения этой группы больных могут обеспечить надежную профилактику рака эндометрия, частота которого заметно выше в пре- и постменопаузальном периодах [2].
Причины ГПЭ: нарушения центральной регуляции репродуктивной системы, гиперпластические процессы в яичниках, гормональные опухоли яичников, нарушения тканевой рецепции, нарушение жирового обмена, нарушение метаболизма половых гормонов, нарушение иммунитета [3, 4]. Многочисленные исследования продемонстрировали роль эстрогенов в возникновении ГПЭ, а также в инициации и поддержании роста злокачественных опухолей эндометрия. В литературе обсуждается в основном пролиферативный эффект эстрогенов, вместе с тем доказано прямое генотоксическое действие метаболитов эстрогенов [5].
Выбор тактики ведения зависит от морфологической характеристики гиперпластического процесса, а также от возраста пациентки [6]. Гормональное лечение ГПЭ патогенетически обосновано. Гормонотерапия оказывает как центральное действие (торможение выделения гонадотропных гормонов и стероидогенеза в яичниках), так и местное (подавление пролиферации эндометрия).
Эффективность применяемой в настоящее время гормональной терапии может быть различной, включая полную нечувствительность эндометрия к лечению гормонами, что объясняется не только различным содержанием сывороточных половых гормонов, но и состоянием рецепторного аппарата матки [7].
Широкое внедрение агонистов гонадотропных рилизинг-гормонов (аГнРГ) в клиническую практику для лечения большого числа гормоночувствительных заболеваний послужило поводом для дальнейшего изучения механизмов действия аГнРГ. Механизм действия препаратов данной группы заключается в следующем: после связывания аГнРГ с рецепторами на поверхности гонадотропных клеток происходит интенсивное высвобождение ЛГ и ФСГ и, опосредованно, увеличение синтеза эстрадиола в яичниках. Продолжительное воздействие аГнРГ на гипофиз в течение нескольких часов приводит к десенситизации клеток гипофиза и быстрому уменьшению интенсивности секреции и биосинтеза гонадотропинов, особенно ЛГ. В таком десентизированном состоянии гонадотропные клетки могут оставаться до тех пор, пока продолжается непрерывное воздействие высоких доз агонистов на гипофиз [8].
Этот феномен называют «медикаментозная кастрация». Угнетение стероидогенеза, вызываемое аГнРГ, индуцирует атрофию самого эндометрия, эктопических эндометриальных желез и стромы. Блокада является обратимой – после отмены аГнРГ полностью восстанавливается чувствительность аденогипофиза к гипоталамической стимуляции [7, 9].
Бусерелин-лонг ФС (ЗАО «Ф-Синтез», Россия) – агонист ГнГР, рекомендованный при всех видах гормонозависимых пролиферативных процессов матки. Препарат обеспечивает стойкий терапевтический эффект при внутримышечном введении один раз в 28 дней в дозировке 3,75 мг. Бусерелин ФСинтез (ЗАО «Ф-Синтез», Россия) – дозированный назальный спрей, применяется по 300 мкг 3–4 раза в сутки (900–1200 мкг/сут). Рекомендованная длительность лечения – до 6 мес. Медикаментозная терапия ГЭ осуществляется в течение 6 мес. после верификации диагноза [10].
Безопасное использование препаратов Бусерелин-лонг ФС и Бусерелин ФСинтез обусловлено отсутствием влияния на углеводный и липидный обмен, гепатобилиарную систему, сердечно-сосудистую систему, свертывающую систему. Именно поэтому возможно их использование при сахарном диабете, ожирении, артериальной гипертензии, варикозной болезни и др.
Разработка эндохирургических методов, оказывающих воздействие на слизистую тела матки, позволила пересмотреть традиционные подходы к терапии ГПЭ. Электрохирургические методы воздействия на эндометрий (аблация эндометрия) представляют собой деструкцию слизистой с помощью электродов с широким основанием (шар, бочонок, ролик).
Для повышения эффективности аблации эндометрия были предложены различные модификации как самой процедуры, так и подготовительных мероприятий. Было доказано, что медикаментозная подготовка (использование аГнРГ) к аблации эндометрия увеличивает эффективность манипуляции [11]. В комбинированной терапии ГПЭ применяется следующая схема использования препарата: подготовка к аблации в течение 2 циклов, послеоперационное использование в течение 4 мес. [12].
Через два цикла использования Бусерелина-лонг ФС наблюдается атрофия эндометрия, что является оптимальным для эффективной деструкции эндометрия. Больным с полипами эндометрия на фоне железистой ГПЭ в позднем репродуктивном и пременопаузальном периодах после гистерорезекции полипа показано продолжение применения Бусерелина-лонг ФС до шести месяцев. Использование данной тактики особенно актуально в возрастной группе, близкой к естественной менопаузе, а также при сочетании ГПЭ и аденомиоза, миомы матки [2].
Цель настоящего исследования – оценка эффективности лечения гиперпластических процессов эндометрия при использовании аГнРГ Бусерелин-лонг ФС (ЗАО «Ф-Синтез», Россия) и гистерорезектоскопии с учетом клинико-морфологических и молекулярно-биологических данных в позднем репродуктивном и пременопаузальном периодах.
Была обследована 81 пациентка, находившаяся на лечении в гинекологическом отделении Московской городской клинической больницы № 1 им. Н.И. Пирогова. Средний возраст обследованных больных составил 43,21 ± 2,15 года. Основной жалобой при поступлении были кровянистые выделения из половых путей. Средняя величина М-эхо составила 9,34 ± 1,12 мм (в том числе на фоне кровотечения). УЗ-исследование не выявило специфических изменений для различных форм гиперплазии эндометрия (эхогенность средняя, эхоструктура однородная).
Учитывая жалобы и результаты обследования, было показано раздельное лечебно-диагностическое выскабливание стенок полости матки и цервикального канала (РДВ) под контролем гистероскопии. В ходе гистологического исследования были обнаружены следующие морфоструктурные изменения слизистой: простая гиперплазия эндометрия без атипии – у 51,85% (ПГ), сложная гиперплазия эндометрия без атипии – у 48,15% больных (СГ).
Контрольную группу составили 30 женщин позднего репродуктивного и пременопаузального возраста, которым было выполнено РДВ по поводу кровотечения. Средний возраст пациенток контрольной группы составил 45,6 ± 1,35 лет. При морфологическом исследовании слизистой оболочки матки женщин контрольной группы в 28 (93,3%) случаях выявлен эндометрий в фазе пролиферации, в 2 (6,7%) случаях – в фазе секреции.
Проводилось изучение полученных биоптатов эндометрия иммуногистохимическим методом (ИГХ): определение уровня маркеров пролиферации и апоптоза – Ki-67 и APAF-1, уровня экспрессии мРНК VEGF, накопления VEGF. ИГХ-реакции проводили по общепринятой методикe с демаскировкой антигенов в СВЧ печи на серийных парафиновых срезах эндометрия. В качестве первичных специфических антител использовались моноклональные антитела к Ki-67 (LabVision, 1:100), к белку APAF-1 (LabVision, 1:100), к VEGF (LabVision, 1:200). Для метки вторичных антител использовался авидин-биотиновый комплекс (UltraV HRP polymer KIT, LabVision). Проводили негативные и позитивные контрольные реакции. Результаты ИГХ-реакций для APAF-1, VEGF оценивались в баллах полуколичественным методом по количеству позитивно окрашенных клеток [13]. Оценка продукта реакции Ki-67 осуществлялась путем подсчета процента окрашенных ядер на 3000 клеток.
Молекулярно-биологическое исследование экспрессии генов VEGF включало в себя выделение тотальной РНК, постановку обратной транскрипции, анализ экспрессии изучаемых генов путем определения концентрации кДНК на приборе Real-time PCR (RotorGene 6000, производитель – Corbett Research) с использованием интеркалирующего красителя SYBR-green I (ЗАО «Синтол», Россия) методом относительного количественного анализа (∆∆Сt). Уровень продукции мРНК каждого фактора в пролиферативном эндометрии принимался за единицу.
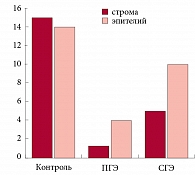
Согласно данным ИГХ-исследования, уровень пролиферативной активности гиперплазированного эндометрия оказался достоверно (p < 0,05) ниже, чем эндометрия в фазе пролиферации, что в определенной мере противоречит традиционному представлению о гиперплазии эндометрия как о патологическом процессе, который характеризуется аномально высокой пролиферацией. Показатель Ki-67 в эндометрии при ПГ составил 1,62 ± 0,2% в строме и 4,13 ± 0,3% в эпителии. В образцах СГ содержание Ki-67 в строме – 4,85 ± 0,5%, в эпителии – 10,6 ± 0,6%. Заслуживает внимания изменение соотношения пролиферативной активности клеток стромального и эпителиального компонентов гиперплазированного эндометрия: в нормальном пролиферативном эндометрии показатель Ki-67 в строме превышал таковой в эпителии, при развитии гиперплазии это соотношение становилось обратным (рис. 1).
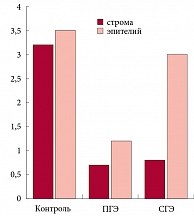
Уровень APAF-1 в эндометрии пациенток с ПГ составил 0,76 ± 0,2 балла в строме и 1,26 ± 0,1 балла в эпителии. При СГ уровень APAF-1 составил 0,9 ± 0,2 в строме и 3,1 ± 0,3 в эпителии (рис. 2).
При ИГХ-исследовании было выявлено, что в основе формирования доброкачественной ГЭ лежит не высокий уровень пролиферативной активности клеток, а нарушение баланса между процессами пролиферации и апоптоза (Ki-67, APAF-1), в нормальных условиях обеспечивающего тканевой гемостаз.
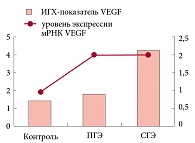
Согласно данным, полученным в ходе нашего исследования, развитие гиперплазии эндометрия без атипии происходит на фоне усиления процессов неоангиогенеза, о чем свидетельствует повышение уровня экспрессии мРНК и накопления VEGF в эндометрии при гиперплазии по сравнению с нормальным пролиферативным эндометрием. Сравнительный анализ ИГХ-показателей VEGF в образцах различных морфологических вариантов гиперплазии показал, что, несмотря на отсутствие различий в уровнях экспрессии, выявлено достоверное повышение содержания VEGF при сложной гиперплазии по сравнению с простой (рис. 3).
В ходе исследования пациентки были разделены на 2 группы. первая группа (n = 42) после выполнения РДВ получала Бусерелин-лонг ФС в течение 6 мес. в качестве монотерапии. Второй группе пациенток (n = 39) после РДВ с лечебно-диагностической целью была выполнена гистерорезектоскопия. Резекция эндометрия была выполнена с помощью электрода-петли и дополнена аблацией шариковым электродом в области маточных углов, то есть использовали комбинированный режим. В качестве средства, расширяющего полость матки, применяли 5% раствор глюкозы. При контрольной гистероскопии обработка стенок была равномерной и полной, эндометрий был серо-белесоватого цвета. Во время процедуры гистерорезектоскопии интраоперационных осложнений выявлено не было. Осложнений, связанных с экстрагенитальной патологией и анестезиологическим пособием, также не отмечалось. Гистерорезектоскопию выполняли при незаинтересованности пациентки в сохранении менструальной, репродуктивной функции; при отказе пациенток от гормонотерапии и от лечения аГнРГ.
С целью контроля (через 6 мес.) выполняли УЗИ органов малого таза. При этом были выявлены достоверные различия (p < 0,05) средней величины М-эхо обследуемых пациенток по сравнению с аналогичным показателем до лечения. Средняя величина М-эхо достоверно не различалась (p > 0,05) в исследуемых группах и составила в первой группе 2,42 ± 0,77 мм, во второй – 2,57 ± 0,85 мм.
При гистероскопии, проведенной через 6 мес. после начала лечения, у всех пациенток была выявлена картина атрофичного эндометрия. У 83,72% пациенток первой группы соскобы из полости матки были скудными. При этом результат гистологического исследования соответствовал атрофии эндометрия. Продукт реакции Ki-67 практически отсутствовал как в стромальном, так и в эпителиальном компоненте, что свидетельствует о крайне низкой пролиферативной активности ткани и согласуется с морфологической картиной атрофии (табл. 1).
Показатель APAF-1 при ПГ составил в строме 4,54 ± 0,3, в эпителии 4,89 ± 0,4 балла. При СГ: в строме – 4,4 ± 0,5, в эпителии – 5,1 ± 0,3 балла. Показатель APAF-1 достоверно превышал (p < 0,05) аналогичный показатель до лечения. Таким образом, интенсификация апоптоза во всех изучаемых образцах ткани слизистой оболочки матки после лечения происходила в большей степени в стромальном компоненте (табл. 2).
Оценка состояния процессов неоангиогенеза в эндометрии пациенток после гормональной терапии показала, что при достоверном снижении уровня экспрессии мРНК VEGF, по сравнению с показателем до лечения, продукт реакции VEGF в исследуемых образцах тканей пациенток первой группы практически не выявлялся (менее 5% положительно окрашенных клеток в пяти полях зрения) (рис. 3).
При гистологическом исследовании эндометрия у 16,28% пациенток первой группы и у всех пациенток второй группы определялись сгустки крови, обрывки гладкомышечных волокон, поэтому ИГХ-исследование было неинформативным.
Наблюдение за пациентками продолжалось в среднем 9 мес. Рецидива патологии эндометрия не было зарегистрировано в обеих группах. У 38 пациенток первой группы через 3 мес. восстановился менструальный цикл, у 4 пациенток наступила стойкая аменорея. У 2 пациенток второй группы отмечались мажущие кровянистые выделения в циклическом режиме.
Таким образом, в ходе нашего исследования были получены данные, свидетельствующие о реализации терапевтического эффекта Бусерелина-лонг ФС на молекулярном уровне при лечении ГПЭ. При незаинтересованности пациенток позднего репродуктивного и пременопаузального периодов в сохранении репродуктивной и/или менструальной функции рекомендовано эндохирургическое лечение ГПЭ. С целью улучшения результатов гистерорезектоскопии возможно комбинированное лечение данной возрастной группы: сочетание использования Бусерелина-лонг ФС и гистерорезектоскопии [2].
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


