Современные стратегии фармакотерапии бронхиальной астмы
- Аннотация
- Статья
- Ссылки


Бронхиальная астма (БА) – хроническое воспалительное заболевание дыхательных путей, главным патогенетическим механизмом которого является гиперреактивность бронхов, а основным клиническим проявлением – частично или полностью обратимая (спонтанно или вследствие лечения) бронхиальная обструкция, наступающая вследствие бронхоспазма, гиперсекреции и отека слизистой оболочки бронхов. Распространенность БА в мире варьирует в пределах от 1 до 18%. Если оценить распространенность БА в России при помощи общепринятых международных методик (International Study of Asthma and Allergies in Childhood (ISAAC) и др.), этот показатель среди взрослого населения составит 5,6–7,3%, а среди детей – 5,6–12,1%. Однако, согласно официальной статистике, распространенность БА в Российской Федерации – менее 2%, что свидетельствует о гиподиагностике этого заболевания в нашей стране.
Этиология и патогенез БА
Факторы, повышающие риск развития БА, можно условно разделить на 2 основные группы: 1) внутренние, или обусловливающие развитие заболевания, 2) преимущественно внешние, или провоцирующие появление симптомов. К внутренним факторам относят генетические (наличие генов, предрасполагающих к развитию атопии и бронхиальной гиперреактивности) и ожирение. К внешним – в первую очередь неинфекционные аллергены: ингаляционные (бытовые, эпидермальные, пыльцевые, грибковые, продукты химического производства, частицы тел насекомых); пероральные (пищевые продукты, пищевые добавки); парентеральные (лекарственные средства, сыворотки, вакцины, яд перепончатокрылых насекомых). Провоцировать развитие БА могут также респираторные (особенно вирусные) и паразитарные инфекции, активное и пассивное курение, загрязнение воздуха, физическое усилие, особенности питания. Механизмы влияния внешних и внутренних факторов на развитие и проявления БА являются сложными и взаимозависимыми. Например, предрасположенность к БА может определяться как процессами взаимодействия генов между собой, так и воздействием на них внешних факторов. Появляются также данные о том, что на риск возникновения БА влияют особенности развития организма ребенка с генетической предрасположенностью к аллергии (в частности, сроки созревания системы иммунного ответа и время контакта с возбудителями инфекций в первые годы жизни ребенка).
В основе формирования аллергического воспаления бронхов при БА участвуют иммунные реакции I (преимущественно), III и IV типов (по классификации P. Gell и R. Coombs), а также неиммунные механизмы.
Выделяют особую – аспириновую – форму БА, патогенез которой обусловлен нарушением метаболизма арахидоновой кислоты и повышением выработки лейкотриенов. Аспириновая астма часто сочетается с рецидивирующим полипозным риносинуситом и непереносимостью ацетилсалициловой кислоты и других нестероидных противовоспалительных препаратов.
В дыхательных путях больных БА наряду с воспалительной реакцией отмечается формирование структурных изменений (предположительно, в результате восстановительных процессов в ответ на хроническое воспаление). Эти изменения, представляющие собой необратимую трансформацию, рассматриваются как процесс ремоделирования бронхов, который включает в себя гиперплазию бокаловидных клеток и бокаловидных желез подслизистого слоя бронхов, гиперплазию и гипертрофию гладкой мускулатуры бронхиальных стенок, увеличение васкуляризации подслизистого слоя бронхов, накопление коллагена в зонах, расположенных ниже базальной мембраны, и субэпителиальный фиброз [1–2].
Клиническая картина БА
Основным симптомом БА любой этиологии является приступ удушья, возникающий преимущественно в ночные и утренние часы, с затрудненным выдохом, часто сопровождающийся дистанционными хрипами (свистящее дыхание). При атопической БА обычно четко прослеживается связь между приступом удушья и контактом с причинно-значимым аллергеном. Помимо удушья многие пациенты отмечают приступообразный сухой кашель (может быть основным и единственным симптомом и расценивается как эквивалент приступа удушья), одышку, отхождение вязкой мокроты при кашле на завершающей стадии удушья. При атопической форме БА характерно ее сочетание с другими аллергическими заболеваниями (аллергическим ринитом, конъюнктивитом, атопическим дерматитом).
По причине хронического воспаления слизистой оболочки дыхательных путей больные БА чаще других подвержены респираторным инфекциям. В свою очередь, некоторые инфекционные агенты (особенно вирусы) способны изменять локальный иммунный ответ слизистой оболочки бронхов, приводить к нарушению барьерной функции дыхательных путей и облегчать сенсибилизацию (повышение чувствительности) к аэроаллергенам.
Принципы лечения БА
Алгоритм лечения БА предполагает проведение следующих мероприятий:
- профилактика;
- купирование и профилактика приступов и обострений БА (фармакотерапия);
- контроль БА (базисная терапия);
- патогенетическая терапия (аллергенспецифическая иммунотерапия в случае атопической БА);
- лечение осложнений БА;
- коррекция сопутствующей патологии;
- обучение пациентов.
Объем стартовой фармакотерапии зависит от степени тяжести БА, фазы течения заболевания (ремиссия/обострение) и/или выраженности обострения. В дальнейшем, если не удается достичь целевого уровня контроля заболевания, терапия корректируется. В основе лечения БА у лиц любого возраста лежит применение ингаляционных бронхолитических средств (для купирования приступа/обострения) и противовоспалительных профилактических средств (с целью контроля БА).
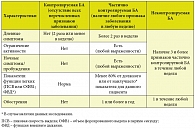
Ведущими мировыми экспертами по различным аспектам БА разработана программа GINA (Global Initiative for Asthma – Глобальная инициатива по бронхиальной астме). Будучи основанным на новейших достижениях в области медицины, фармакологии и молекулярной биологии, документ определяет стратегию в отношении диагностики, лечения и профилактики БА [3]. На основе рекомендаций GINA 2010 г. разработаны национальные согласительные документы и руководства для врачей по наиболее оптимальному лечению БА в России [4, 5]. Целью лечения БА является достижение и поддержание контроля клинических проявлений заболевания (табл. 1). Новый подход к оценке полноты контроля БА основан на нескольких наблюдениях:
- степень тяжести БА может изменяться в течение нескольких месяцев или лет [6];
- существующие классификации степеней тяжести БА обеспечивают неполное представление о бремени заболевания [7];
- ответ на лечение БА является гетерогенным и различается даже у пациентов, имеющих идентичную степень тяжести заболевания [6].
Лекарственные средства (ЛС), применяемые при БА, подразделяются на препараты, контролирующие течение заболевания (поддерживающая терапия), и препараты неотложной помощи (для облегчения симптомов заболевания). Ингаляционный путь введения ЛС является предпочтительным перед системным введением, поскольку быстрый и оптимальный способ доставки ЛС в бронхи обеспечивает максимальный терапевтический эффект при низких дозах ЛС, что снижает риск развития побочных эффектов.
Препараты неотложной помощи принимают по потребности. Эти ЛС действуют быстро, устраняя бронхоспазм и купируя его симптомы. К препаратам неотложной помощи относят следующие ЛС:
- ингаляционные бета-2-агонисты короткого действия (сальбутамол, фенотерол) или длительного действия с быстрым началом действия (формотерол) или комбинированные ЛС, включающие холинолитики и бета-2-агонисты (фенотерол/ипратропия бромид), в лекарственных формах для доставки с помощью дозированного аэрозольного ингалятора или небулайзера;
- метилксантины короткого действия (аминофиллин);
- ингаляционные глюкокортикостероиды (будесонид) для введения через небулайзер;
- системные глюкокортикостероиды (преднизолон, дексаметазон).
При назначении терапии, направленной на купирование обострения БА, должна быть учтена исходная степень тяжести обострения и наличие осложнений БА. При легком обострении БА с нерезко выраженными обструктивными изменениями в легких (снижение пиковой скорости выдоха менее чем на 20%) рекомендовано использование ингаляционных препаратов – агонистов бета-2-адренорецепторов короткого действия или комбинированных ЛС (бета-2-агониста и холинолитика), а также ингаляционных глюкокортикостероидов (ГКС). Для облегчения ингаляций и повышения эффективности ЛС предпочтительнее использовать небулайзер. При наличии среднетяжелого и тяжелого обострения БА показано дополнительное применение системных ЛС. В этих случаях предпочтительнее использовать инфузионные формы препаратов, так как при их применении быстрее достигается эффект и исключается непосредственное негативное воздействие лекарства на органы желудочно-кишечного тракта (ЖКТ). Кроме того, инфузионные формы системных ЛС позволяют корректировать дозу препарата в соответствии с объективным состоянием пациента. Доза и длительность инфузионного введения ЛС (системные ГКС, аминофиллин) зависят от скорости объективной стабилизации состояния пациента. Пациентов с тяжелым обострением БА следует лечить в стационаре в палате интенсивной терапии, где возможно обеспечить объективную оценку бронхиальной обструкции, сатурации кислородом и функции сердца. При отсутствии выраженной бронхиальной обструкции с уменьшением дозы и частоты введения инфузионных ЛС должно проводиться их замещение ингаляционными и/или таблетированными препаратами.
Поддерживающая терапия БА
Препараты, контролирующие течение БА, предназначены для ежедневного приема в течение длительного времени. Контроль над клиническими проявлениями БА достигается благодаря противовоспалительному действию препаратов этой группы, к которым относятся следующие ЛС:
- ингаляционные ГКС (будесонид, флутиказона пропионат, циклесонид, мометазона фуроат, беклометазона дипропионат);
- антилейкотриеновые препараты (АЛТР) (монтелукаст и зафирлукаст);
- ингаляционные бета-2-агонисты длительного действия (ДДБА) в комбинации с ингаляционными ГКС (будесонид/формотерол, флутиказона пропионат/салметерол, беклометазона дипропионат/формотерол);
- теофиллин замедленного высвобождения;
- кромоны (кромоглициевая кислота, недокромил натрия) (в настоящее время применяются все реже в связи с недостаточной эффективностью и неудобством применения);
- системные ГКС (метилпреднизолон, преднизолон, дексаметазон);
- моноклональные антитела к иммуноглобулинам класса Е (IgE) (омализумаб).
В соответствии с рекомендациями GINA 2010 г. предусматривается ступенчатый подход к выбору объема фармакологического лечения БА (табл. 2).
На всех ступенях терапии БА помимо ежедневного приема препарата базисной терапии возможно применение ингаляционных бета-2-агонистов быстрого действия по потребности, однако следует помнить, что применение этих препаратов чаще 2 раз в неделю свидетельствует о неполном контроле заболевания и требует пересмотра базисной терапии.
Ингаляционные ГКС
Основной группой фармакологических средств базисной терапии БА являются ингаляционные ГКС. Среди всех существующих препаратов для поддерживающей терапии они демонстрируют наибольшую эффективность. В основе противоаллергического и противовоспалительного действия ингаляционных ГКС лежат молекулярные механизмы двухэтапной модели действия этих препаратов (геномный и внегеномный эффекты) [8–9]. Терапевтический эффект ингаляционных ГКС связан с их способностью ингибировать образование в клетках провоспалительных веществ (цитокинов, оксида азота, фосфолипазы А2, молекул адгезии лейкоцитов и др.) и активировать образование белков, оказывающих противовоспалительное действие (липокортина-1, нейтральной эндопептидазы и др.). Местное воздействие ингаляционных ГКС проявляется повышением количества бета-2-адренергических рецепторов на клетках гладкой мускулатуры бронхов; снижением сосудистой проницаемости, уменьшением отека и секреции слизи в бронхах, снижением числа тучных клеток в слизистой бронхов и усилением апоптоза эозинофилов; уменьшением выброса воспалительных цитокинов Т-лимфоцитами, макрофагами и эпителиальными клетками; уменьшением гипертрофии субэпителиальной мембраны и подавлением тканевой специфической и неспецифической гиперреактивности. Ингаляционные ГКС угнетают пролиферацию фибробластов и уменьшают синтез коллагена, что замедляет темпы развития склеротического процесса в стенках бронхов [8–9].
В отличие от системных, ингаляционные ГКС обладают высокой селективностью, выраженной противовоспалительной и минимальной минералокортикоидной активностью. При ингаляционном пути введения препарата в легких откладывается приблизительно 10–30% номинальной дозы [10]. Это количество зависит от свойств молекулы ингаляционного ГКС, от системы доставки препарата в дыхательные пути (тип ингалятора) и от техники ингаляции. Бóльшая часть дозы ингаляционного ГКС проглатывается, абсорбируется из ЖКТ и быстро метаболизируется в печени, что обеспечивает высокий терапевтический индекс ингаляционных ГКС [11].
Ингаляционные ГКС отличаются по активности и биодоступности, чем обусловлена некоторая вариабельность клинической эффективности и выраженности побочных эффектов отдельных представителей этой группы.
Современные ингаляционные ГКС обладают высокой липофильностью, способствующей лучшему преодолению мембраны клетки; высокой степенью сродства к глюкокортикоидным рецепторам (ГКР), что обеспечивает оптимальную местную противовоспалительную активность; малой системной биодоступностью и низкой вероятностью развития системных побочных эффектов. Эффективность некоторых препаратов зависит от типа используемого ингалятора. С увеличением дозы ингаляционного ГКС противовоспалительный эффект возрастает, однако начиная с определенной дозы кривая «доза – эффект» приобретает вид плато, и отмечается развитие побочных явлений, характерных для системных ГКС.
На территории Российской Федерации зарегистрированы и разрешены к применению следующие ингаляционные ГКС: будесонид (суспензия для небулайзера разрешена к применению с 6-месячного возраста, в виде порошкового ингалятора – с 6 лет), флутиказона пропионат (разрешен к применению с возраста 1 год), циклесонид (может применяться с 6-летнего возраста), беклометазона дипропионат (разрешен к применению с 6-летнего возраста) и мометазона фуроат (разрешен к применению у детей с 12 лет и взрослых). Все препараты обладают доказанной эффективностью, однако различия в химической структуре отражаются на фармакодинамических и фармакокинетических свойствах ингаляционных ГКС и, следовательно, на степени эффективности и безопасности препарата.
Эффективность ингаляционного ГКС зависит, в первую очередь, от его местной активности, которая определяется аффинностью (сродством к ГКР), селективностью и продолжительностью персистирования в тканях [11]. Все известные современные ингаляционные ГКС обладают высокой местной глюкокортикоидной активностью, которую определяют по сродству ингаляционного ГКС к ГКР (обычно в сравнении с дексаметазоном, активность которого принимают за 100), и модифицированными фармакокинетическими свойствами (табл. 3). Наибольшей аффинностью к ГКР обладают мометазона фуроат (2244), флутиказона пропионат (1800) и будесонид (935) [12]. Циклесонид (аффинность в неактивированном состоянии составляет 12) и беклометазона дипропионат (аффинность в неактивированном состоянии – 53) не обладают исходной фармакологической активностью, и только после приема, попадая в органы-мишени и подвергаясь действию эстераз, они превращаются в свои активные метаболиты дезциклесонид и беклометазона 17-монопропионат и становятся фармакологически активными. Сродство к ГКР у активных метаболитов выше и составляет 1212 и 1345 соответственно.
Степень липофильности и активности связывания с дыхательным эпителием, а также длительность ассоциации с ГКР обусловливают длительность действия препарата. Благодаря липофильности увеличивается концентрация ингаляционного ГКС в дыхательных путях, замедляется высвобождение препарата из тканей, увеличивается сродство к ГКР и удлиняется время связывания с этими рецепторами. Следует, однако, отметить, что оптимальная величина липофильности ингаляционных ГКС до сих пор не определена [11]. В наибольшей степени липофильность проявляется у мометазона фуроата, флутиказона пропионата и циклесонида. Для будесонида и циклесонида характерно участие в реакции этерификации, происходящей внутриклеточно в тканях легких с образованием обратимых конъюгатов будесонида и дезциклесонида с жирными кислотами. Липофильность конъюгатов во много десятков раз превышает таковую интактных будесонида и дезциклесонида, что обусловливает длительность пребывания последних в тканях дыхательных путей.
Безопасность ингаляционных ГКС и вероятность развития системных побочных эффектов при их применении определяются системной биодоступностью препаратов (абсорбция со слизистой ЖКТ и легочная абсорбция), уровнем свободной фракции препарата в плазме крови (связывание с белками плазмы крови) и уровнем инактивации ГКС при первичном прохождении через печень (наличие/отсутствие активных метаболитов) [11–13].
Ингаляционные ГКС быстро всасываются в ЖКТ и дыхательных путях. На абсорбцию ГКС из легких могут оказывать влияние размеры ингалируемых частиц, так как частицы размером менее 1 мкм откладываются в альвеолах и всасываются в легочный кровоток. При использовании дозированных аэрозольных ингаляторов или сухой пудры (порошков) ГКС через Дискхалер, Турбухалер и другие устройства только 10–20% ингалированной дозы откладывается в дыхательных путях (респирабельная фракция), при этом до 90% дозы откладывается в ротоглоточной области и проглатывается [10]. Для более современных ингаляционных устройств (Твистхейлер) респирабельная фракция составляет 30–40% дозы препарата [11]. Проглоченная часть ингаляционного ГКС, абсорбируясь из ЖКТ, попадает в печеночный кровоток, где бóльшая часть (до 80% и более) препарата инактивируется. В системный кровоток ингаляционные ГКС поступают преимущественно в виде неактивных метаболитов, поэтому системная оральная биодоступность для большинства ингаляционных ГКС (мометазона фуроата, циклесонида, флутиказона пропионата) очень низка – практически равна нулю [12–14].
Ингаляционные ГКС характеризуются довольно высоким связыванием с белками плазмы крови (табл. 3); у мометазона фуроата и циклесонида оно составляет 98–99%, что несколько выше по сравнению с флутиказона пропионатом, будесонидом и беклометазона дипропионатом (90, 88 и 87% соответственно).
Ингаляционные ГКС отличаются быстрым клиренсом, его величина примерно равна величине печеночного кровотока. Это свойство препаратов данной группы является одной из причин минимального проявления системных нежелательных эффектов при их применении. Кроме того, быстрый клиренс обеспечивает ингаляционным ГКС высокий терапевтический индекс [12–14].
Эффективность терапии ингаляционными стероидами зависит не только от свойств молекулы ингаляционного ГКС, но и (даже в большей степени) от типа используемого ингаляционного устройства. По данным некоторых авторов, эффективность ингаляционной терапии лишь на 10% определяется самим лекарственным препаратом, а на 90% – правильной техникой ингаляции [15].
Учитывая, что процессы воспаления и ремоделирования происходят во всех отделах дыхательных путей, включая дистальные отделы и периферические бронхиолы [16], актуальным представляется вопрос об оптимальном способе доставки лекарственного препарата в легкие вне зависимости от состояния бронхиальной проходимости и соблюдения техники ингаляции. Предпочтительный размер частиц ингаляционного препарата, обеспечивающий равномерное распределение его в крупных и дистальных бронхах, составляет для взрослых 1–5 мкм, а для детей – 1,1–3 мкм [7, 17–19]. С целью уменьшения количества ошибок, связанных с техникой ингаляции, влекущих за собой снижение эффективности лечения и повышение частоты и выраженности побочных эффектов, ведется постоянное усовершенствование способов доставки ЛС. Дозированные аэрозольные ингаляторы можно использовать вместе со спейсером. Спейсер представляет собой вспомогательное устройство для ингаляций – камеру, которая служит промежуточным резервуаром для аэрозоля. Лекарство из баллончика ингалятора поступает в спейсер, а затем вдыхается пациентом.
Использование небулайзера позволяет эффективно купировать обострение БА в амбулаторных условиях, снижая/отменяя необходимость в инфузионной терапии. Для препаратов базисной терапии были созданы такие системы доставки препаратов, как Аэролайзер, Турбухалер, Аутохалер, дисковый порошковый ингалятор и др. Согласно Межправительственному соглашению по охране озонового слоя Земли (Монреаль, 1987), все производители ингаляционных лекарственных препаратов перешли на бесфреоновые формы дозированных аэрозольных ингаляторов. Новый пропеллент норфлуран (гидрофторалкан, ГФА 134а) значительно повлиял на размер частиц некоторых ингаляционных ГКС, в частности беклометазона дипропионата и циклесонида. Сегодня существенная доля частиц этих препаратов имеет размер от 1,1 до 2,1 мкм (экстрамелкодисперсные частицы) [20–22].
Согласно заключению экспертов GINA 2010 г., среди доступных на сегодняшний день препаратов для контроля БА одними из наиболее эффективных являются ингаляционные ГКС, соответственно, монотерапия ингаляционными ГКС может помочь контролировать персистирующую астму у значительной части пациентов. В случаях, когда не удается добиться контроля БА низкими и средними дозами ингаляционных ГКС, рекомендуется добавлять к терапии стероидами ДДБА, а при наличие факторов риска, связанных с ДДБА, а также при определенных фенотипах БА (сочетание астмы с аллергическим ринитом, аспириновая астма и др.) рекомендуется к ингаляционным ГКС добавлять АЛТР. Синергичность действия ингаляционных ГКС и ДДБА обусловлена их комплементарным взаимодействием на молекулярном и рецепторном уровнях. Ингаляционные ГКС обеспечивают высокую плотность бета-рецепторов на мембране клеток-мишеней и повышают их активность. ДДБА активируют ГКР, при этом в присутствии ДДБА для активации рецептора требуются более низкие дозы ингаляционного ГКС. ДДБА обеспечивают повышение ядерной транслокации стероид-рецепторного комплекса в ядро, где он взаимодействует со специфичной областью гена-мишени, что приводит к усилению противовоспалительной активности и, в свою очередь, к повышению синтеза бета-рецепторов. Использование фиксированной комбинации в одном ингаляторе позволяет, с одной стороны, почувствовать быстрое облегчение (благодаря действию ДДБА), что усиливает комплаенс пациента, с другой стороны, улучшить контроль заболевания (благодаря тому, что больной получает поддерживающую дозу ингаляционного ГКС). Из-за возможного развития побочных эффектов (стимуляция сердечно-сосудистой системы, тремор скелетных мышц и гипокалиемия) ДДБА не могут быть заменой ингаляционным или системным ГКС, не используются в качестве монотерапии и должны назначаться только в комбинации с адекватными, то есть назначенными врачом, дозами ингаляционных ГКС.
Антилейкотриеновые препараты
В патогенезе аллергического воспаления участвуют десятки различных медиаторов, которые могут обладать сходными биологическими эффектами. При аллергическом воспалении главным ферментом метаболизма арахидоновой кислоты в тучных клетках, эозинофилах, макрофагах, Т-лимфоцитах и нейтрофилах дыхательных путей является 5-липоксигеназа, под действием которой синтезируются цистеиниловые лейкотриены (LTС₄, LTD₄, LTE₄). Эффекты цистеиниловых лейкотриенов опосредуются соответствующими рецепторами. На сегодняшний день выделяют 3 типа таких рецепторов. АЛТР (монтелукаст) являются антагонистами рецепторов 1-го типа (CysLT1). CysLT1-рецепторы представлены на клетках слизистой носовой полости, трахеи, бронхов и др. Цистеиниловые лейкотриены, взаимодействуя с CysLT1-рецепторами, индуцируют продукцию слизи, развитие отека, хемотаксис эозинофилов и спазм гладкой мускулатуры стенок бронхов. Показано, что синтез лейкотриенов активируется при контакте организма с аллергеном, а также как неспецифический механизм при контакте с поллютантами, после охлаждения дыхательных путей или физических упражнений [23]. Помимо вазоактивных свойств, лейкотриены способствуют созреванию воспалительных клеток, а также их накоплению в тканях [24].
АЛТР блокируют эффекты цистеиниловых лейкотриенов, обладают противовоспалительной активностью, слабым и вариабельным бронхорасширяющим эффектом, уменьшают выраженность симптомов БА, включая кашель, улучшают функцию легких. АЛТР могут использоваться при любой степени тяжести БА либо в качестве монотерапии, как альтернатива низким дозам ингаляционных ГКС, либо в качестве дополнения к ингаляционным ГКС или комбинированным препаратам, повышая эффективность терапии. Назначение АЛТР у больных с сочетанием аллергического ринита и БА позволяет одновременно контролировать аллергическое воспаление как в носовой полости, так и в бронхах. Особым показанием к назначению АЛТР являются случаи аспириновой астмы и профилактика бронхоспазма, вызванного физической нагрузкой.
БА является хроническим воспалительным заболеванием, в большинстве случаев требующим регулярного приема ЛС. Как говорилось выше, основным способом доставки ЛС при БА считается ингаляционный путь введения. Однако такой метод требует тщательного, иногда многократного, обучения пациентов, а неправильная техника ингаляции существенно снижает эффективность лечения. Существуют современные специальные устройства для ингаляции, однако они не всегда применимы у отдельных категорий пациентов, в частности, у детей младшей возрастной группы, подростков, пожилых или неврологических больных, а также у пациентов без должной мотивации. По данным некоторых исследователей [25], количество больных с низким комплаенсом среди пациентов с легким персистирующим течением БА существенно больше, чем в группе пациентов с тяжелым течением заболевания. Основными нарушениями, допускаемыми больными, являются нерегулярность использования ингалятора и неправильная техника ингаляции. Эти проблемы можно решить с помощью использования пероральных форм противовоспалительных противоастматических ЛС, предназначенных для приема один раз в сутки. Специально выполненные исследования показали, что энтеральный путь введения ЛС по сравнению с ингаляционным повышает правильность выполнения пациентами врачебных назначений до 80% [26]. По этой причине АЛТР являются ценной альтернативой ингаляционному средству у больных с низкой дисциплиной и плохой техникой ингаляции. В педиатрической практике клиническая эффективность монтелукаста была показана при всех степенях тяжести БА. В частности, в серии работ монтелукаст применялся либо в качестве монотерапии, либо в комбинации с ингаляционными ГКС [25–28]. Появление нового ингаляционного ГКС с возможностью применения один раз в сутки (мометазона фуроат) позволило предложить удобную схему «двойной» терапии – комбинацией «мометазон + монтелукаст» с кратностью приема один раз в сутки вечером.
Данные доказательной медицины свидетельствуют, что на фоне применения монтелукаста отмечено достоверное снижение числа обострений, уменьшение потребности в препаратах симптоматической терапии, а в случае комбинированной терапии – снижение дозы ингаляционного ГКС. Применение монтелукаста приводит к снижению гиперреактивности дыхательных путей, обусловленной как специфическими, так и неспецифическими (холодный воздух, физическая нагрузка) раздражителями [29]. В клинических исследованиях было показано снижение частоты обострений БА, обусловленных вирусной инфекцией, среди детей 2–5 лет, получавших монтелукаст в течение 12 месяцев, при хорошем профиле безопасности терапии [30].
Теофиллин
Еще одним средством, применяемым в поддерживающей терапии БА, является бронхолитик теофиллин. Препарат выпускается в виде лекарственных форм с замедленным высвобождением, которые можно принимать один или два раза в сутки в качестве монотерапии или комбинации с ГКС. Побочные эффекты теофиллина, особенно в высоких дозах, могут быть значительными (нарушения со стороны ЖКТ, жидкий стул, нарушения ритма сердца, судороги), что ограничивает применение этого препарата.
Кромоны
Препараты кромоглициевой кислоты характеризуются слабым противовоспалительным действием, по своей эффективности в терапии БА они существенно уступают ингаляционным ГКС и АЛТР. Для достижения лечебного эффекта необходимо регулярное продолжительное использование кромонов с не очень удобной для пациентов кратностью приема – 3–4 раза в сутки. Препараты кромоглициевой кислоты являются безопасными и практически полностью лишены побочных эффектов, благодаря чему они в некоторых случаях могут применяться в педиатрической практике для лечения больных с легкой персистирующей БА.
Системные ГКС
При тяжелой неконтролируемой БА может потребоваться длительная терапия пероральными ГКС, однако продолжительность их использования ограничивается риском развития серьезных нежелательных эффектов. При длительной терапии предпочтительно назначение пероральных препаратов, так как по сравнению с парентеральными (внутримышечными или внутривенными) они обладают менее выраженным минералокортикоидным эффектом, относительно коротким периодом полувыведения, меньшим воздействием на поперечно-полосатые мышцы, а также большей гибкостью дозировок, что позволяет титровать дозу до минимальной, но достаточной для поддержания контроля БА.
Моноклональные антитела
Противовоспалительный эффект моноклональных антител к IgE (омализумаб) основан на ключевой роли IgE в аллергическом воспалении и выражается в снижении уровня циркулирующего свободного IgE и подавлении экспрессии Fc-эпсилон-рецептора 1-го типа (Fc-эпсилон-R1) на поверхности базофилов и дендритных клеток. Анти-IgE-антитела избирательно распознают и конкурентно связывают IgE, образуя небольшие (менее 1000 кДа) комплексы, не способные связывать комплемент, которые элиминируются с помощью ретикуло-эндотелиальной системы, не вызывая побочных эффектов. Таким образом, снижая уровень циркулирующего свободного IgE, омализумаб препятствует связыванию IgE с рецепторами: высокоаффинным Fc-эпсилон-R1 и низкоаффинным Fc-эпсилон-рецептором 2-го типа, предотвращая высвобождение медиаторов из клеток-мишеней аллергии (тучных клеток, базофилов) при стимуляции их специфическим аллергеном [31]. Омализумаб применяется у взрослых и детей от 12 лет и старше со среднетяжелой и тяжелой БА, не контролируемой или плохо контролируемой с помощью ингаляционных ГКС.
ЛС других групп в терапии БА
Помимо противоастматических средств пациентам с БА могут быть назначены ЛС других групп. Применение антигистаминных препаратов (Н₁-блокаторов) для лечения БА не показано, однако может возникнуть необходимость их назначения при наличии сопутствующей аллергопатологии. Использование антигистаминных препаратов первого поколения в острый период заболевания нежелательно, так как они затрудняют дренаж бронхиального секрета. Предпочтительным является применение антигистаминных препаратов последнего поколения (лоратадин, дезлоратадин, цетиризин, левоцетиризин, фексофенадин). При наличии инфекционных осложнений (пневмонии, бронхита, гайморита и др.) возможно назначение антибактериальных ЛС как в сочетании с противогрибковой терапией, так и без нее в соответствии с протоколом ведения данного осложнения.
Вместо заключения
Для достижения контроля БА необходимо не только назначение правильно подобранной терапии, но и установление доверительных отношений между врачом и пациентом, адекватное обучение пациентов, постоянное мониторирование их состояния. Пациентам следует указать на необходимость ежедневного самоконтроля с помощью пикфлоуметров – портативных приборов для измерения пиковой скорости выдоха. По результатам пикфлоуметрии можно оценить степень бронхиальной обструкции и уровень контроля БА, а также на ранних этапах выявить развитие обострения заболевания.
Каждые 3–6 месяцев врач осуществляет пересмотр персональной программы лечения больного, при необходимости интенсивность терапии корректируют в зависимости от изменения тяжести состояния. При этом следует помнить не только о необходимости усиления терапии, но и о возможности «понижения ступени» терапии (стратегия «степ-даун»), то есть обеспечивать оптимальный контроль БА минимальным количеством и дозами препаратов. Такой комплексный индивидуальный подход крайне важен в терапии этого хронического заболевания, поскольку позволяет получить наилучший эффект от лечения с применением наименьшего количества ЛС, что, в свою очередь, снижает риск развития побочных эффектов фармакотерапии.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.