Современные возможности лечения больных остеоартритом: фокус на обогащенную тромбоцитами плазму
- Аннотация
- Статья
- Ссылки
- English
Определение и механизмы развития
Остеоартрит (ОА) признан одним из основных инвалидизирующих факторов. Поэтому патология ассоциируется с огромным экономическим бременем [1, 2].
Эксперты Международного общества по изучению остеоартроза (Osteoarthritis Research Society International – OARSI) предложили рассматривать ОА как расстройство, поражающее подвижные суставы и характеризующееся клеточным стрессом, а также деградацией внеклеточного матрикса, которые инициируются микро- и макротравмами, активирующими неадаптивные реакции воспаления и провоспалительные механизмы локального иммунитета. Необходимо отметить, что заболевание проявляется прежде всего как молекулярное расстройство (аномальный метаболизм суставных тканей), за которым следуют анатомические и/или физиологические расстройства, которые становятся кульминацией болезни [3]. Речь, в частности, идет о деградации хряща, ремоделировании костной ткани, образовании остеофитов, воспалении суставов и потере нормальной функции суставов.
В отсутствие медикаментозного лечения ОА неуклонно прогрессирует, что приводит к полной потере слоя суставного хряща, изнашиванию суставной щели и окостенению сустава. Указанные изменения сопровождаются выраженным болевым синдромом и снижением подвижности суставов.
Важно отметить, что в хряще на долю хондроцитов приходится только несколько процентов объема ткани, большая часть представлена высокоорганизованным межклеточным веществом [4, 5]. Межклеточное вещество содержит плотную сеть коллагеновых фибрилл, которые отвечают за упругость ткани, и гиалуроновые агрегаты, которые формируются при спонтанном взаимодействии гиалуронана и протеогликанов. Данные агрегаты способны абсорбировать воду за счет осмоса и таким образом создавать повышенное напряжение в сети коллагеновых волокон. Сжатость гиалуроновых агрегатов обеспечивает не только повышенное давление, но и сопротивление ткани сдавлению с минимальной деформацией. За счет этого поддерживается функция прочной, упругой, переносящей нагрузки поверхности. Поверхность хряща покрыта гиалуроновой оболочкой, защищающей его от медиаторов воспаления и протеаз [6].
Некоторые авторы предполагают, что патогенетические процессы при ОА сначала развиваются в синовиальной жидкости: наблюдается постепенное увеличение концентрации медиаторов воспаления, таких как интерлейкин (ИЛ) 1, оксид азота (NO), простагландины (ПГ) и свободные радикалы [7]. Оксид азота и свободные радикалы взаимодействуют непосредственно с молекулой гиалуронана. Это приводит к разрушению и деполимеризации, сопровождающейся снижением молекулярной массы и сокращением времени полураспада молекулы. Кроме того, ИЛ-1 и ПГ усиливают проницаемость синовиальной оболочки. Как следствие, увеличивается объем внеклеточной жидкости. Повышение проницаемости синовиальной оболочки в свою очередь способствует снижению концентрации гиалуронана [8].
Результатом описанных выше процессов является нарушение смазочных и вязко-эластических свойств синовиальной жидкости и ее способности к фильтрации. Синовиальная оболочка становится доступной для медиаторов воспаления, что усиливает проявления синовита. Восприимчивость хрящевой ткани к медиаторам катаболизма повышается. Последние запускают каскад реакций: ИЛ-1 стимулирует продукцию ходроцитами медиаторов воспаления (в частности, ПГ) и металлопротеиназ, коллагеназа, желатиназа и стромиелизин разрушают коллаген и протеогликаны, способствуя созданию внутрисуставных фрагментов. Данные фрагменты стимулируют хемотаксис лейкоцитов, при этом NO вызывает разрушение хондроцитов. Концентрация лимфоцитов в суставе постепенно возрастает, они начинают усиленно продуцировать воспалительные цитокины [8, 9]. Согласно результатам последних исследований, в синовиальной оболочке суставов, пораженных ОА, уровень ИЛ-17 повышен, что обычно наблюдается при воспалительных артритах – псориатическом и ревматоидном [10].
Подходы к терапии
Согласно современным подходам к терапии, пациенты с ОА прежде всего должны осознать свое состояние и уметь им управлять. Это предполагает изменение образа жизни и выполнение физических упражнений, поддерживающих функцию суставов. Терапия должна быть направлена на уменьшение болевого синдрома, улучшение функционального состояния суставов и качества жизни больных, предотвращение разрушения суставного хряща, деформации суставов и инвалидизации. У больных ОА также следует контролировать развитие побочных эффектов на фоне проводимого лечения и обострений сопутствующих патологий.
Исходя из современных представлений о патогенезе ОА, основным принципом лечения является восстановление нормальной функции сустава и его морфологических повреждений. Это может быть достигнуто активацией анаболических и подавлением катаболических процессов в хрящевой ткани. Поэтому лечение должно быть комплексным и включать немедикаментозные (ограничение нагрузки, использование дополнительной опоры, снижение массы тела, увеличение силы мышц, стабилизирующих пораженный сустав, коррекция ортопедических нарушений), физиотерапевтические и медикаментозные методы.
Среди медикаментозных методов лечения особое место отводится анальгетикам и нестероидным противовоспалительным препаратам (НПВП) [11, 12].
С начала 1980-х гг. в клинической практике применяются глюкозамин, хондроитин и гиалуроновая кислота (ГК). В настоящее время их эффективность доказана в десятках рандомизированных контролируемых исследований. Поэтому данные препараты входят в перечень терапевтических агентов, рекомендуемых для лечения ОА экспертами Европейской антиревматической лиги (Еuropean League Against Rheumatism – EULAR), OARSI, Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартроза (European Society for Clinical and Economic Aspects of Osteoporosis – ESCEO), а также Американской коллегии ревматологов (American College of Rheumatology – ACR), с высоким уровнем доказательности [13–16].
Стоит отметить, что важным отличием препаратов ГК от других хондропротекторов является метод введения – непосредственно в пораженный сустав. Считается, что при локальном введении вся доза препарата попадает в сустав и сохраняется некоторое время в его полости. Благодаря этому обеспечивается максимальное воздействие на пораженные структуры сустава. В то же время при системном введении (в основном пероральном) хондроитина и глюкозамина наблюдается равномерное распределение препарата по всей соединительной ткани с крайне малым адресным фармакологическим воздействием. По мнению ряда авторов, при ОА целесообразен дифференцированный подход к назначению хондропротективных препаратов – в зависимости от количества пораженных суставов. При локальных формах (например, гонартрозе) оправданно введение препаратов ГК, при полиостеоартрите – системный прием хондроитина и глюкозамина. В настоящий момент времени остается неясным вопрос, имеет ли какое-либо преимущество комбинированное применение препаратов ГК и других хондропротекторов.
В отношении немедикаментозных методов лечения эксперты отмечают, что модификация образа жизни, особенно выполнение физических упражнений и снижение массы тела, является основным компонентом терапии ОА. Так, избыточная масса тела признана фактором риска развития ОА [17, 18]. Кроме того, получены данные о краткосрочных положительных эффектах медикаментозной терапии в отношении снижения боли и улучшения функций суставов. При этом сочетание медикаментозных методов с выполнением программ домашних упражнений обусловливает долгосрочный лечебный эффект. Пациентам с ОА рекомендуется избегать перегрузок и травм пораженного сустава, а также проводить корректирующие процедуры при плохой осанке [19].
Положительный эффект уменьшения массы тела вследствие регулярных физических упражнений и диеты или хирургического вмешательства заключается не только в облегчении симптомов ОА, замедлении потери хряща в суставах, подвергающихся нагрузке [20], но и в снижении уровня воспалительных цитокинов и адипокинов, которые могут участвовать в деградации хряща [21].
Обогащенная тромбоцитами плазма
История вопроса
Обогащенная тромбоцитами плазма (ОТП) представляет собой часть плазменной фракции аутологичной крови с концентрацией тромбоцитов выше базовой линии.
ОТП-терапия начала широко использоваться в регенеративной медицине и других медицинских областях после сообщений о ее клинической эффективности в 1980-х и 1990-х гг. [22]. D.R. Knighton и соавт. провели серию работ и одними из первых описали использование «локально действующих факторов роста, полученных из тромбоцитов человека и применяемых местно». Ученые подчеркнули их перспективность для стимулирования регенерации тканей, особенно для лечения хронических ран. Для получения ОТП исследователи использовали лабораторные пробирки без какого-либо полимерного сепарирующего геля [23, 24].
В дальнейшем в исследованиях в области кардиохирургии было продемонстрировано, что ОТП является эффективным аутологичным источником переливаемой плазмы для устранения хирургической кровопотери и гематологических нарушений при сердечно-легочном шунтировании [25]. После этих сообщений были инициированы исследования в других областях медицины. В частности, E. Anitua и соавт. изучали возможность применения ОТП в стоматологии [26], R.E. Marx и соавт. проанализировали ее влияние на скорость созревания и плотность костной ткани при реконструкции дефектов непрерывности нижней челюсти с использованием костного трансплантата [27]. Добавление ОТП к трансплантатам ускоряло формирование костной ткани.
Позднее ОТП начали применять в других областях медицины: спортивной медицине, ортопедии, сердечно-сосудистой хирургии, эстетической медицине, челюстно-лицевой и пластической хирургии, офтальмологии. Относительно низкая стоимость и простота использования способствовали быстрому внедрению ОТП в медицинскую практику [28].
В настоящее время для получения ОТП применяют разные технологии, в том числе центрифугирование пробирок небольших объемов и более крупные устройства для афереза [29]. Способ получения ОТП значительно упростился также благодаря появлению и развитию коммерческих медицинских изделий для получения таковой. Перечисленные технологические улучшения позволили применять ОТП не только в стационарных, но и в амбулаторных условиях. ОТП теперь можно безопасно получать за 15–30 минут [30].
J. Fitzpatrick и соавт. (2017) разделили препараты ОТП на два типа. Основой для препаратов первого типа является плазма, второго – лейкоцитарные пленки. Для получения первых производится центрифугирование, а также исключение эритроцитов и лейкоцитов [31].
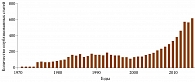
Возрастание интереса к использованию ОТП подтверждается тем, что за последние годы данный метод лечения стал предметом многих публикаций (рис.). На данный момент проводится почти сто клинических исследований ОТП-терапии, в большинстве из которых она применяется при патологиях опорно-двигательного аппарата (ClinicalTrials.gov).
Сегодня ОТП в инъекционной форме активно применяется в ортопедии, косметологии, челюстно-лицевой хирургии, сердечно-сосудистой хирургии и урологии.
Патофизиологическое обоснование применения
Целесообразность применения ОТП при ОА базируется на способности тромбоцитов обеспечивать и высвобождать из своих альфа-гранул необходимые факторы роста и цитокины в объеме, превышающем физиологический. Это обеспечивает регенеративные стимулы, которые ускоряют рост и восстановление тканей [22].
Известно, что тромбоциты содержат много хемокинов и факторов роста, которые могут инициировать регенерацию тканей. К последним, в частности, относятся факторы роста тромбоцитов альфа и бета, трансформирующий фактор роста бета, фактор роста эндотелия сосудов, фактор роста эпидермиса, фактор роста фибробластов, фактор роста соединительной ткани и инсулиноподобный фактор роста 1. Важно отметить, что ОТП также включает белки плазмы, которые действуют как молекулы адгезии клеток, – фибрин, фибронектин и витронектин [32, 33].
Факторы роста, выделяемые тромбоцитами, могут стимулировать восстановление поврежденного хряща, оказывать протективный эффект и обеспечивать смазку суставов путем регулирования синтеза эндогенной ГК. Данные вещества влияют на мезенхимальные стволовые клетки суставных тканей, такие как синовиум или жировые тела Гоффа, хондроциты, остеобласты, фибробласты, эндотелиальные клетки и эпидермальные клетки. Воздействие цитокинов стимулирует прямую клеточную пролиферацию, образование матриц и остеоидов, синтез коллагена, а также предотвращает апоптоз хондроцитов. Таким образом обеспечивается восстановление и регенерация тканей [34–36].
Белковые компоненты ОТП при активации образуют временный фибрин, который может связывать несколько белков плазмы, включая витронектин, фибронектин, фактор Виллебранда и тромбоспондин. Фибронектин известен как основной фактор сыворотки крови человека, способствующий созданию субхондральных клеток-предшественников [20]. Агрегаты тромбоцитов вместе с волокнами фибрина формируют трехмерный каркас, который становится резервуаром факторов роста, оказывающих положительное воздействие на клетки и стимулирующих клеточную адгезию, миграцию и пролиферацию. Эти свойства фибриновой матрицы ОТП активно используются в челюстно-лицевой хирургии при восстановлении ран на фоне хронического воспаления. Каркас ОТП может имитировать начальную стадию заживления раневых дефектов и восстановления ткани, которая не может быть самостоятельно инициирована в суставном хряще, так как он состоит из постмитотических клеток, неспособных к размножению [28, 29].
Установлено, что из тромбоцитов могут высвобождаться многочисленные противовоспалительные цитокины, включая антагонисты рецепторов интерлейкина (ИЛ) 1, рецепторы растворимого фактора некроза опухоли (ФНО) 1 и 2, ИЛ-4, -10, -13 и интерферон гамма [28]. Показано, что агонисты рецептора ИЛ-1 блокируют рецепторы ИЛ-1 и их биологическую активность. Передача сигнала ФНО-альфа прекращается, когда рецепторы растворимого ФНО-1 и -2 связываются со свободным ФНО-альфа. ИЛ-4, -10 и -13 могут действовать как при увеличении продукции агонистов рецепторов ИЛ-1, так и при снижении продукции простагландина E2, индуцированной ФНО-альфа. Производство ИЛ-18 индуцируется интерфероном гамма, что приводит к ингибированию ИЛ-18.
Следует добавить, что тромбоциты также могут секретировать провоспалительные цитокины, такие как ИЛ-1-альфа, -1-бета, -6, -8, -17 и -18, а также ФНО-альфа, однако их концентрации значительно ниже, чем концентрации противовоспалительных цитокинов.
Таким образом, действие ОТП в большей степени связано с противовоспалительными стимулами, что подтверждает потенциальную роль ОТП в подавлении воспаления, защите хряща и уменьшении боли при ОА [37, 38].
В совокупности введенная интраартикулярно ОТП может влиять на катаболизм суставной ткани, модулировать воспалительную реакцию, индуцировать миграцию и пролиферацию клеток, а также регулировать ангиогенез и клеточную дифференциацию.
Исследование эффективности
Эффективность ОТП и ГК сравнивалась в многочисленных исследованиях. В большинстве из них продемонстрировано преимущество ОТП. Ряд исследований был посвящен сравнению эффективности комбинированной терапии ОТП и ГК и монотерапии ГК.
Так, в рандомизированном клиническом исследовании, проведенном S.A. Raeissadat и соавт. (2015), оценивался долгосрочный эффект внутрисуставного введения ОТП и ГК на клинические исходы ОА и качество жизни больных. В исследовании приняли участие 160 пациентов с ОА коленного сустава первой – четвертой степени по классификации Kellgren – Lawrence. В группе ОТП (n = 87) проведено две внутрисуставные инъекции с перерывом четыре недели, в группе ГК (n = 73) – три инъекции c аналогичным интервалом. Данные по обеим группам были проанализированы проспективно. Состояние больных оценивалось исходно и по окончании лечения с помощью индекса выраженности ОА Университетов Западного Онтарио и МакМастера (Western Ontario and McMaster Universities Osteoarthritis Index – WOMAC) и опросника для оценки качества жизни (Short Form 36 – SF-36). Через 12 месяцев в обеих группах значительно улучшились показатели WOMAC и наблюдалось уменьшение болевого синдрома, при этом результаты в группе ОТП превосходили результаты в группе ГК (p < 0,001) [39].
E. Montañez-Heredia и соавт. (2016) получили аналогичные результаты при проведении двойного слепого рандомизированного клинического исследования с участием 55 пациентов с ОА. Одним из них была назначена терапия ОТП, другим – ГК. В двух группах было зафиксировано снижение боли через шесть месяцев. При этом показатели, характеризующие болевой синдром, в группе ОТП улучшились не менее чем на 50% от исходных [40].
E.A. Sundman и соавт. (2014) проанализировали состояние синовиальной жидкости и хрящевой ткани у пациентов, подвергшихся тотальной артропластике коленного сустава с помощью культивирования на средах с ОТП или ГК. Ученые доказали, что ОТП может стимулировать эндогенную продукцию ГК и уменьшать катаболизм хряща. Лечение как ОТП, так и ГК приводило к снижению катаболизма хряща, при этом терапия ОТП была ассоциирована со значительным уменьшением экспрессии матричной металлопротеиназы 13, увеличением экспрессии гиалуронан-синтазы 2 в синовиоцитах и синтетической активности. Было также продемонстрировано, что ОТП и ГК с одинаковой эффективностью подавляли медиаторы воспаления и экспрессию их генов в синовиоцитах и хрящевой ткани [41].
В недавнем систематическом обзоре и метаанализе L. Shen и соавт. (2017), включавшем 14 рандомизированных клинических исследований и в общей сложности 1423 участника, оценивался временный эффект ОТП на выраженность боли и функцию коленного сустава. Контрольная группа получала физиологический раствор как плацебо, ГК, озон и глюкокортикостероиды. Инъекции ОТП у пациентов с ОА коленного сустава способствовали значительному уменьшению общей оценки по WOMAC, боли по WOMAC и улучшению функционального состояния сустава через три, шесть и 12 месяцев наблюдения (p = 0,02, 0,004, < 0,001 соответственно). Тем не менее применение ОТП было связано с незначительным увеличением риска развития побочных реакций [42].
Еще в одном систематическом обзоре и метаанализе, проведенных W. Kanchanatawan и соавт. (2016), сравнивали влияние терапии ОТП, ГК или плацебо не только на клинические проявления ОА коленного сустава (оценивали по WOMAC и LISOH (Lequesne Index Severity Osteoarthritis Hip)), но и на частоту побочных эффектов. Инъекции ОТП по сравнению с ГК и плацебо значительно улучшали функцию суставов, не приводя к статистически значимому увеличению частоты нежелательных явлений [43].
A. Gobbi и соавт. (2015) инициировали проспективное рандомизированное клиническое исследование для оценки эффектов инъекций ОТП в коленный сустав у пациентов с ОА на ранних стадиях и определения влияния циклического применения препарата на конечный результат. В исследовании участвовали 93 пациента (119 коленных суставов). Последующий период наблюдения составил не менее двух лет. Курс лечения предполагал три инъекции с интервалом один месяц с и без повторения через год. Согласно результатам исследования, отмечалось значительное улучшение всех показателей относительно исходных (p < 0,001). Через 12 месяцев в обеих группах зафиксировано аналогичное и значимое улучшение. Однако через 18 месяцев между группами было отмечено значительное различие по всем показателям, за исключением значений шкалы оценки исходов повреждений и заболеваний коленного сустава (Knee injury Osteoarthritis Outcome Score – KOOS) и шкалы Тегнера. Лучшая динамика наблюдалась у пациентов, которым был проведен второй курс лечения (p < 0,001). Через два года в обеих группах показатели снизились, но оставались выше исходных [2].
G. Filardo и соавт. (2011) сравнивали эффективность двух схем лечения ОТП: с однократным и двукратным внутрисуставным введением. В исследовании с участием 144 пациентов с ОА продемонстрировано значительное улучшение в обеих группах, особенно у пациентов более молодого возраста [44]. В другом сравнительном исследовании эффективности ОТП и ГК у 150 пациентов, проведенном E. Kon и соавт. (2010), установлено, что показатели по шкале оценки коленного сустава (International Knee Documentation Commitee – IKDC) и визуальной аналоговой шкале (ВАШ) в обеих группах улучшились через два и шесть месяцев. Однако ОТП-терапия оказалась эффективнее [45].
В работе S.J. Jang и соавт. (2013) проанализирован диапазон повреждений хряща и дегенерации пателлофеморального сустава при дегенеративном ОА, а также оценена длительность положительных эффектов ОТП. 65 пациентов проспективно наблюдали через один, три, шесть, девять и 12 месяцев после процедуры. В качестве диагностических методов использовали ВАШ и IKDC. Через шесть месяцев после инъекции показатели ВАШ в среднем снизились с 7,4 до 4,2, однако через год после процедуры опять увеличились до 5,0. Значения IKDC также имели статистическую значимость (p < 0,05). Был сделан вывод, что внутрисуставная инъекция ОТП может использоваться для лечения раннего ОА, однако у пациентов пожилого возраста и при наличии дегенеративных процессов ее терапевтический потенциал снижается [46].
Терапия, улучшающая вязко-эластические свойства синовиальной жидкости сустава (вискосапплементация – от англ. viscosupplementation), при помощи препаратов ГК одобрена экспертами OARSI для лечения слабовыраженного ОА коленного сустава. Следует учитывать, что по сравнению с ГК эффект ОТП при лечении ОА коленного сустава более отсроченный, однако он превосходит таковой ГК. Считается, что как ГК, так и ОТП способствуют регенерации клеток хрящевой ткани, хотя они воздействуют через разные механизмы. Поэтому совместное использование ОТП и ГК может дать аддитивный положительный эффект, если оба продукта вводят в коленный сустав. Так, в исследовании E.A. Sundman и соавт. (2014) было показано, что как ОТП, так и ГК оказывали противовоспалительное действие, но двумя разными способами. Они уменьшали продукцию ФНО-альфа, что приводило к снижению концентрации ИЛ-6. Лечение ОТП привело к значительному уменьшению экспрессии матричной металлопротеиназы 13 и увеличению экспрессии гиалуронан-синтазы 2 в синовиоцитах, что стимулировало синтетическую активность хряща. Однако на фоне применения ГК таких результатов получено не было [41].
В недавнем рандомизированном клиническом исследовании, проведенном D. Dallari и соавт. (2016), включавшем 111 пациентов с ОА тазобедренного сустава, больные случайным образом были распределены на три группы терапии: три еженедельные инъекции либо ОТП (44 пациента), либо ОТП + ГК (31 пациент), либо ГК (36 пациентов). Состояние больных оценивали по ВАШ, шкале Харриса (Harris Hip Score – HHS) и WOMAC через два, шесть и 12 месяцев после лечения. Результаты показали, что внутрисуставные инъекции ОТП привели к значительному клиническому улучшению у пациентов с ОА тазобедренного сустава без соответствующих побочных эффектов. Напротив, авторы отметили, что добавление ОТП к ГК не приводило к значительному регрессу симптомов [47].
ОТП и ГК широко используются для улучшения любрикативных свойств суставов. Они являются модуляторами воспаления и средствами, изменяющими катаболическую микросреду. Их действие нацелено не только на купирование клинических симптомов ОА, но и замедление его прогрессирования. Эффективность комбинации «ОТП + ГК» при ОА должна быть дополнительно подтверждена в более крупных исследованиях для лучшего понимания аддитивных молекулярных механизмов и долгосрочных клинических эффектов.
V.A. Kushnir, D.E. Karateev
Polyclinic № 3 of the RF President Administration
Moscow Regional Research and Clinical Institute
Contact person: Dmitry Evgenyevich Karateev, dekar@inbox.ru
The review is devoted to the modern principles of treatment of osteoarthritis, including both systemic drug therapy and methods of local treatment, the review examines in detail the role of platelet-rich plasma in the therapy of osteoarthritis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.