Медикаментозная терапия болевого синдрома у больных артритом
- Аннотация
- Статья
- Ссылки
- English

Введение
Хроническая боль является одним из основных проявлений артритов – остеоартрита, или остеоартроза (ОА), и ревматоидного артрита (РА). Общепринятым критерием хронической боли является ее сохранение в течение как минимум трех месяцев. Однако у значительной части пациентов с ОА и РА хронический болевой синдром подходит под определение тяжелого (high impact). Под таковым понимается постоянная боль с существенным ограничением возможности профессиональной деятельности, социальной активности и самообслуживания в течение шести месяцев и более [1].
Хроническая боль представляет собой сложное и многофакторное явление [2]. Для артритов наиболее типична хроническая скелетно-мышечная боль [3], относящаяся к ноцицептивному типу боли (возникает вследствие возбуждения периферических болевых рецепторов при повреждении/воспалении пораженной ткани). Однако у значительного числа пациентов развивается нейропатическая боль, связанная с поражением соматосенсорной нервной системы [4].
Лечение ноцицептивной боли
Ревматоидный артрит
Боль – один из наиболее сложных симптомов у пациентов с РА.
Боль при РА традиционно считалась следствием воспаления в суставах. Однако результаты последних исследований свидетельствуют, что в ее развитии задействовано несколько механизмов. Подтверждением тому служат следующие факты. Боль может начаться еще до появления симптомов РА, степень ее выраженности часто не коррелирует со степенью воспаления или фармакологического подавления активности болезни [5]. Причины возникновения боли могут различаться на разных стадиях (ранняя или поздняя) РА, зависеть от наличия обострений, а также от индивидуальных особенностей пациентов. Боль может сохраняться даже в отсутствие обострений [6, 7]. Она может усиливаться при нарастании повреждений суставов, вторичных по отношению к воспалительному процессу. Более того, распространенность хронических невоспалительных болевых синдромов, таких как фибромиалгия, среди пациентов с РА выше, чем в популяции [8, 9].
Согласно результатам международного исследования QUEST-RA (7028 больных РА, 83 центра в 30 странах, включая Россию) [10], боль – самая важная детерминанта общей оценки состояния пациентом. По данным норвежских исследователей, у 30% пациентов с РА, взятых под наблюдение на ранних стадиях заболевания, в течение десяти лет, несмотря на активное противовоспалительное и иммуносупрессивное лечение, выраженность боли оставалась достаточно высокой (> 40 мм по визуальной аналоговой шкале (ВАШ)) [11].
Как уже упоминалось выше, механизм возникновения боли при артритах преимущественно локальный (ноцицептивный). Многие медиаторы воспаления (брадикинин, гистамин, аденозинтрифосфат, нейротрофины и цитокины), а также поврежденные молекулярные структуры активируют сенсорные нейроны для генерирования потенциалов действия и/или усиливают возбудимость нейронов и сенсорную трансдукцию через нейронные рецепторы. Это приводит к появлению болевых ощущений и гипералгезии. Вклад цитокинов в инициирование боли подтверждается тем, что она ослабевает при нейтрализации цитокинов или блокировании рецепторов цитокинов в месте воспаления [12].
Установлено, что воспаленная синовиальная оболочка генерирует медиаторы, такие как простагландины, брадикинин и провоспалительные цитокины (фактор некроза опухоли (ФНО) альфа, интерлейкины (ИЛ) 1 и 6, фактор роста нервов бета). Они сенсибилизируют периферические нервы и таким образом способствуют возникновению и поддержанию боли [13–16]. Необходимо отметить, что помимо синовиальной оболочки сенсорные нервы локализованы в области капсулы сустава, связок, внешних областей менисков, субхондральной кости, сухожильных оболочек и мышц [13]. Они также могут стать источником болевых импульсов.
При лечении многих состояний, сопровождающихся болью, включая ревматические заболевания, широко используются нестероидные противовоспалительные препараты (НПВП), поскольку они обладают жаропонижающим, противовоспалительным и обезболивающим эффектами [17]. В отличие от базисных противовоспалительных препаратов НПВП оказывают анальгетический эффект, их лечебное действие развивается быстро. Именно поэтому препараты данной группы являются основой симптоматической (обезболивающей) терапии РА. Так, это основная группа средств для контроля болевого синдрома при РА в России [18] и США [19].
Подавляющее большинство НПВП не различаются по эффективности [20]. В то же время установлено, что НПВП могут отличаться профилями безопасности в отношении желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы, почек и печени [21].
Основные фармакологические эффекты НПВП связаны с подавлением активности циклооксигеназы (ЦОГ) 2 [22]. Данный фермент ответственен за выработку медиаторов воспаления – простагландинов. Активация ЦОГ-2 приводит к развитию болевого синдрома, включая центральные механизмы передачи болевого импульса, воспалительной реакции, неоангиогенеза и т.д. [23]. Другая изоформа фермента – ЦОГ-1 играет важную роль в поддержании многих параметров гомеостаза, в том числе защитного потенциала слизистой оболочки ЖКТ, почечного кровотока, процесса агрегации тромбоцитов. Применение НПВП связано с закономерным риском развития нежелательных реакций – эрозивно-язвенным поражением ЖКТ, кровотечением, нарушением функции почек, дестабилизацией артериального давления, тромботическими осложнениями. В зависимости от способности НПВП в большей или меньшей концентрации ингибировать активность ЦОГ-2 или ЦОГ-1 их подразделяют на разные группы. Ингибирование преимущественно ЦОГ-1 характерно для ацетилсалициловой кислоты. Так, для подавления ЦОГ-1 требуется значительно меньшая концентрация ацетилсалициловой кислоты, чем для подавления ЦОГ-2. Поэтому для реализации антиагрегантного действия требуется доза в десятки раз меньшая, чем для реализации противовоспалительного. Большинство НПВП относятся к неселективным ЦОГ-ингибиторам. Они способны тормозить активность обеих изоформ в близких концентрациях (ибупрофен, индометацин, напроксен, пироксикам, диклофенак и др.). Применение неселективных НПВП связано с достаточно высоким риском развития нежелательных реакций со стороны ЖКТ [24]. Внутри данной группы нередко выделяют умеренно селективные ингибиторы ЦОГ-2, для которых концентрации, требующиеся для подавления активности этой изоформы, многократно ниже концентраций, требующихся для ингибирования ЦОГ-1 [25]. К этой группе относятся мелоксикам (препарат Артрозан®), нимесулид и этодолак. Более селективными в отношении ЦОГ-2 являются препараты из группы коксибов – целекоксиб и эторикоксиб [26]. Применение селективных и умеренно селективных ингибиторов ЦОГ-2 ассоциировано с достоверно меньшим риском развития нежелательных реакций со стороны ЖКТ.
В связи с высокой селективностью коксибов в отношении ЦОГ-2 изначально возникали опасения повышения риска сердечно-сосудистых осложнений. Действительно, подавление ЦОГ-2 (без влияния на ЦОГ-1) может приводить к дисбалансу синтеза тромбоксана А2 и простациклина и, следовательно, повышать риск тромбоза сосудов. У пациентов с сердечно-сосудистой коморбидностью это чревато увеличением риска развития инфаркта миокарда и ишемического инсульта [27, 28].
Результаты метаанализов также подтверждают повышение сердечно-сосудистого риска на фоне лечения коксибами [29]. Кроме того, в 2004–2005 гг. с фармацевтического рынка были отозваны рофекоксиб и вальдекоксиб – преимущественно по причине развития сердечно-сосудистых катастроф [30, 31]. В дальнейшем было показано, что и другие НПВП в той или иной степени могут увеличивать сердечно-сосудистые риски [32–36].
Хорошим соотношением гастроинтестинальной и сердечно-сосудистой безопасности обладает препарат мелоксикам – один из первых ЦОГ-2-селективных НПВП.
Мелоксикам – нестероидный противовоспалительный препарат из группы оксикамов. Период его полувыведения составляет около 20 часов. Как следствие, возможность применения один раз в день. Ни умеренная почечная, ни печеночная недостаточность существенно не изменяют фармакокинетику мелоксикама.
Кроме того, пациентам пожилого возраста не требуется корректировки дозы препарата [37].
Мелоксикам наряду с нимесулидом относится к умеренно селективным ингибиторам ЦОГ-2. Соотношение концентраций препарата, необходимых для подавления активности ЦОГ-1 и ЦОГ-2, для него составляет от 2,0 до 6,1, при измерении разными методами [38–40].
Широкое применение мелоксикама началось с 1995 г. К клиническим характеристикам мелоксикама (препарата Артрозан®) относится выраженная анальгетическая и противовоспалительная активность.
Препарат был апробирован при РА. Уже к началу 2000-х гг. на основании результатов метаанализов рандомизированных клинических исследований стало очевидным, что мелоксикам не уступает по эффективности неселективным НПВП при значимо лучшем профиле безопасности [41, 42]. Так, согласно результатам рандомизированного клинического исследования, включавшего 894 больных РА в фазе обострения [43], мелоксикам в разных дозах (до 22,5 мг/сут) продемонстрировал достаточную безопасность при эффективности, сопоставимой с диклофенаком в дозе 150 мг/сут.
Необходимо отметить, что мелоксикам имеет один из наиболее благоприятных профилей безопасности. Кроме того, он относится к наиболее экономически приемлемым препаратам [44, 45].
Еще одним преимуществом мелоксикама является наличие разных лекарственных форм, в том числе инъекционной (для внутримышечного введения).
Локальная и общая переносимость мелоксикама и пироксикама при в/м введении сравнивалась в многоцентровом рандомизированном клиническом исследовании [46] у пациентов с РА (n = 95) или OA (n = 116). Препараты вводили в течение семи дней. Локальная переносимость мелоксикама была значительно лучше, чем таковая пироксикама. Речь, в частности, идет о таких показателях, как покраснение после первой инъекции (р = 0,03) и глобальная оценка после первой и конечной инъекций (р < 0,05). На фоне терапии мелоксикамом в отличие от применения пироксикама повышения уровня креатинфосфокиназы (маркера повреждения мышечного волокна) не наблюдалось (р = 0,0001). В целом переносимость обоих типов лечения была хорошей. Преимущества мелоксикама отмечались в отношении глобальной оценки эффективности терапии при РА (р < 0,05) и общей интенсивности боли при ОА (р = 0,02).
Еще один важный аспект при выборе НПВП – учет возможных лекарственных взаимодействий. В первую очередь это касается метотрексата, поскольку НПВП теоретически могут задерживать его выведение. Установлено, что мелоксикам не влиял на фармакокинетику метотрексата [47].
Кроме того, мелоксикам не повышал риск скрытой гепато- и нефротоксичности при совместном применении с метотрексатом [48]. В то же время, согласно результатам Кокрановского метаанализа, существуют определенные риски в отношении сочетанного применения метотрексата, целекоксиба и эторикоксиба, особенно – противовоспалительных доз ацетилсалициловой кислоты [49]. Так, для эторикоксиба при одновременном приеме с метотрексатом зафиксировано развитие тяжелого токсико-аллергического осложнения (синдрома Стивенса – Джонсона) [50]. Получены данные о неблагоприятном лекарственном взаимодействии метотрексата и неселективных НПВП (кетопрофена, индометацина, напроксена, диклофенака, ибупрофена) [51, 52]. Перечисленные выше НПВП конкурируют или ингибируют (в частности, эторикоксиб) транспортер органических анионов (hOAT3), что замедляет выведение метотрексата и, следовательно, приводит к повышению риска токсичности [51].
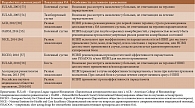
В таблице 1 суммируются приведенные выше факты [28, 53].
Остеоартрит
Широкая распространенность боли в гериатрической популяции [54] вносит существенный вклад в общетерапевтическую проблему хронической боли. Долгосрочная анальгезия у пожилых пациентов представляет сложный и недостаточно изученный вопрос. Лица пожилого возраста часто не включаются в рандомизированные клинические исследования, поэтому в литературе имеются ограниченные данные в отношении этой популяции. Кроме того, у таких больных нередко отмечается несколько сопутствующих заболеваний, включая сердечно-сосудистые. Как следствие, увеличивается риск лекарственных взаимодействий и ограничивается диапазон терапевтических опций [54]. Это прежде всего касается НПВП. Необходимо отметить, что наряду с простыми анальгетиками (парацетамолом) НПВП наиболее часто назначаются при ОА [55, 56].
Показания для применения НПВП при ОА согласно рекомендациям разных медицинских сообществ представлены в табл. 2 [55, 57–64]. Так, НПВП системно следует использовать в качестве препаратов второй линии при недостаточной эффективности простых анальгетиков (парацетамола) или местно (гели, мази, пластыри). Однако в реальной практике [65] в связи с ограниченными возможностями контроля болевого синдрома с помощью парацетамола НПВП зачастую назначают в качестве терапии первой линии.
Еще один немаловажный вопрос, связанный с НПВП, – использование без учета относительных противопоказаний [66]. Поэтому нередко их применение ассоциируется с существенными проблемами безопасности.
При назначении НПВП необходимо минимизировать риск развития побочных реакций, особенно у пожилых пациентов. В связи с этим возрастает интерес к применению при ОА мелоксикама – одного из первых представителей умеренно селективных ингибиторов ЦОГ-2. Мелоксикам подтвердил высокую эффективность при ОА, в том числе в низких дозах [67].
В исследованиях при ОА [41, 68–70] мелоксикам 7,5 и 15,0 мг/сут продемонстрировал эффективность, безопасность и хорошую переносимость. Было отмечено его преимущество перед плацебо, по всем первичным и вторичным точкам он был сопоставим с диклофенаком 100 мг/сут, пироксикамом 20 мг/сут и напроксеном 750–1000 мг/сут. При этом частота нежелательных реакций со стороны ЖКТ на фоне его применения была ниже, чем при использовании диклофенака.
По сравнению с традиционными НПВП мелоксикам реже вызывал диспепсию. Кроме того, он ассоциировался с меньшей частотой отмены лечения из-за осложнений со стороны ЖКТ [71].
Хорошая переносимость мелоксикама подтверждается результатами сетевого метаанализа 36 рандомизированных клинических исследований (n = 112 351). Его авторы сравнивали частоту осложнений со стороны ЖКТ при использовании коксибов и умеренно селективных НПВП – мелоксикама, набуметона и этодолака. В целом риск серьезных осложнений при лечении мелоксикамом был ниже, чем при применении неселективных НПВП [37, 72, 73].
Субъективная оценка переносимости НПВП существенно влияет на качество жизни и нередко становится причиной прерывания терапии, особенно у пациентов пожилого возраста. В реальной практике мелоксикам наряду с другими ингибиторами ЦОГ-2 продемонстрировал несомненное преимущество в этом отношении над большинством неселективных НПВП [74, 75]. Так, в немецком наблюдательном исследовании 13 307 пациентов получали мелоксикам 7,5–15,0 мг/сут [76]. Показаниями к применению НПВП были ОА (61%), ревматоидный артрит (24%), анкилозирующий спондилоартрит (1,6%) и другие ревматические патологии (28%). У значительной части пациентов имел место высокий риск развития нежелательных реакций: у 12% – в анамнезе перфорация, изъязвления и кровотечения в ЖКТ, у 24% – как минимум одно сопутствующее сердечно-сосудистое нарушение и у 26% – антигипертензивная терапия. До мелоксикама многие (58%) больные принимали НПВП. У 43% из них предшествующая терапия оказалась недостаточно эффективной, у 21% – возникли нежелательные реакции на фоне НПВП. У 85 и 94% больных соответственно эффективность и переносимость терапии мелоксикамом были оценены как хорошие или очень хорошие. Качество жизни и функционирование в повседневной жизни улучшились у 64 и 84% пациентов. Только 0,8% больных сообщили о побочных реакциях со стороны ЖКТ: четыре случая изъязвления желудка, один – серьезная перфорированная язва желудка и еще один – серьезное осложнение со стороны тонкой кишки после неправильного использования или передозировки мелоксикама. Таким образом, несмотря на наличие у пациентов высокого риска развития побочных эффектов, безопасность лечения была хорошей.
Безопасность мелоксикама в отношении сердечно-сосудистой системы также подтверждена в достаточной степени. Результаты обширного популяционного исследования, проведенного в Финляндии (33 309 эпизодов острого инфаркта миокарда, контроль составили 138 949 лиц без данной патологии), свидетельствовали, что риск сердечно-сосудистых катастроф на фоне приема мелоксикама был не выше, чем при использовании нимесулида, набуметона и этодолака, коксибов и неселективных НПВП [77]. Прямое и косвенное сравнение с коксибами продемонстрировало определенное преимущество мелоксикама. Согласно результатам метаанализа, включавшего большое количество рандомизированных клинических исследований [44], умеренно селективные ингибиторы ЦОГ-2 (мелоксикам, этодолак) достоверно превосходили неселективные НПВП (диклофенак, пироксикам и др.) по частоте развития нежелательных явлений со стороны ЖКТ при аналогичной эффективности и отсутствии повышения риска развития нежелательных явлений со стороны сердечно-сосудистой системы. Высокоселективные ингибиторы ЦОГ-2 (рофекоксиб, целекоксиб, эторикоксиб) также были достоверно более безопасными, чем неселективные НПВП, в отношении ЖКТ, однако ассоциировались с повышением риска инфаркта миокарда.
Сравнительное исследование в реальной практике показало более низкую частоту гастроинтестинальных и более высокую частоту тромбоэмболических осложнений на фоне лечения рофекоксибом по сравнению с терапией мелоксикамом [78, 79].
Мелоксикам также характеризуется минимальной гепатотоксичностью [80]. В рандомизированных клинических исследованиях мелоксикам, целекоксиб и эторикоксиб существенно реже вызывали повышение уровня аланинаминотрансферазы и аспартатаминотрансферазы, чем неселективные НПВП [81, 82].
По результатам анализа базы данных U.S. Drug Induced Liver Injury Network, которая представляет собой перспективный реестр тяжелой идиосинкразической лекарственной гепатотоксичности [83], из 1322 случаев лекарственной гепатотоксичности только 30 были ассоциированы с НПВП, в большинстве (53%) из них – с диклофенаком. В отношении мелоксикама зафиксировано только три случая вероятной гепатотоксичности по типу холестаза с благоприятным исходом.
В недавно опубликованном метаанализе [84] ни в одном из 18 отобранных исследований не сообщалось о гепатотоксичности мелоксикама. В восьми исследованиях указывалось на гепатотоксичность трех НПВП: целекоксиба, эторикоксиба и диклофенака.
Результаты российских исследований подтверждают данные международных наблюдений. В многоцентровом исследовании ПРИНЦИП, результаты которого были опубликованы не так давно [85], продемонстрировано, что в реальной практике мелоксикам в отношении таких показателей, как выраженность боли и удовлетворенность пациентов лечением, безопасность лечения, частота развития нежелательных реакций (диспепсии, периферических отеков и повышения артериального давления), сопоставим с целекоксибом, нимесулидом, ацеклофенаком и напроксеном. Однако частота диспепсий на фоне мелоксикама была значительно меньше, чем при применении диклофенака. Согласно данным по Республике Крым, количество нежелательных реакций, связанных с лечением мелоксикамом, было ниже, чем при приеме диклофенака, ибупрофена, ацетилсалициловой кислоты, кеторолака, метамизола, парацетамола, нимесулида [86].
Таким образом, преимущества назначения умеренно селективных ингибиторов ЦОГ-2 (представителем которых является мелоксикам) при ОА очевидны, в первую очередь для пожилых пациентов.
В связи со сказанным необходимо напомнить о концепции золотой середины [28], которая основана на оптимальном соотношении достаточно высокой безопасности препарата в отношении как ЖКТ, так и сердечно-сосудистой системы. Данная концепция носит универсальный характер и обсуждалась применительно к разным препаратам [22].
Дополнительным преимуществом мелоксикама в качестве препарата первой линии при ОА является его потенциально положительное влияние на хрящ. Установлено, что при ОА мелоксикам и ацеклофенак в концентрациях, обнаруженных в синовиальной жидкости, оказывали положительное воздействие на общий метаболизм протеогликанов и гиалуроновой кислоты в хряще. Следовательно, эти два препарата не должны нарушать биомеханические свойства тканей суставов и могут препятствовать прогрессированию ОА [87]. В эксперименте показано, что мелоксикам, а также напроксен способны подавлять активность металлопротеиназ в синовиальной ткани суставов, тем самым оказывая органопротективное действие в отношении хрящевой ткани [88, 89]. Хотя данный эффект, по-видимому, относится к разным противовоспалительным препаратам.
Мелоксикам как в низких, так и в высоких дозах оказывал хондропротекторное воздействие на модели остеоартрита у животных. Его высокие дозы ассоциировались с защитой субхондральной кости от повреждений [90].
Терапия нейропатической боли
Нейропатическая боль встречается примерно у 7% населения [91]. Она может быть вызвана рядом заболеваний, травмами, хирургическими вмешательствами, которые приводят к нарушению соматосенсорных путей в периферической или центральной нервной системе [92].
Важное место среди причин нейропатической боли занимают ревматические болезни, в частности РА и ОА.
Высокая распространенность нейропатической боли при ревматических заболеваниях связана с хроническим воспалением. При хроническом воспалительном процессе изменяется порог возбудимости нейронов болевой системы – периферическая и центральная сенситизация. В процессе воспалительной реакции межклеточное пространство в области повреждения заполняется провоспалительными медиаторами, такими как ФНО-альфа, ИЛ-1, ИЛ-6, простагландинами, а также нейротропными факторами (фактором роста нервов бета, серотонином, субстанцией Р, нейрокинином А и др.) [93]. При этом сначала болевые рецепторы сенситизируются (становятся более чувствительными) к механическому или химическому раздражению, потом становятся полимодальными (приобретают способность возбуждаться от любых внешних стимулов), активируются так называемые молчащие ноцицепторы, включающиеся лишь после стимуляции провоспалительными медиаторами [94, 95]. В итоге развиваются первичная гипералгезия (слабые болевые стимулы воспринимаются как сильные и длительные), вторичная гипералгезия, которая захватывает неповрежденные ткани, аллодиния (ощущение боли при воздействии неболевых стимулов) [93].
При ОА нейропатический компонент боли проявляется локальной симптоматикой в виде парестезий (жжение, онемение), развитием гипералгезии [96–98]. При этом активируются структуры мозга, отвечающие за восприятие боли как проявления центральной сенситизации [99, 100].
Еще более нейропатическая боль характерна для РА. Так, согласно результатам отечественного исследования, таковая при помощи опросника для диагностики вида боли (Douleur Neuropathique 4 questions – DN4) была обнаружена у 43% больных РА [101].
При РА к механизмам индуцируемой воспалением периферической и центральной сенситизации также относят:
- сенситизацию ноцицептивных нейронов с включением не связанного с воспалительной реакцией механизма прямого воздействия аутоантител (в частности, антицитруллиновых антител) на мембранные структуры ноцицепторов нервных клеток [93, 102];
- развитие прямого иммуновоспалительного повреждения нервной системы в виде сенсомоторной полинейропатии, мононейропатии [101];
- механическое повреждение периферических нервов при туннельных синдромах, спинного мозга (шейная миелопатия при поражении атланто-аксиального сустава и других структур шейного отдела позвоночника) [101, 103].
При ревматических заболеваниях терапия нейропатической боли должна входить в комплекс мероприятий по лечению скелетно-мышечной боли в тех случаях, когда она имеет хронический характер и в ее патогенезе участвует механизм центральной сенситизации [104]. Как правило, в этот комплекс включают НПВП. Известно, что НПВП могут оказывать влияние на центральные механизмы формирования боли, поскольку один из важнейших механизмов определяется выработкой и накоплением в ткани центральной нервной системы провоспалительных медиаторов, среди которых ведущую роль играет простагландин Е2 [105].
Важность данного компонента терапии доказывается эффективностью НПВП при прямом повреждении периферической нервной системы – радикулопатиях. Так, мелоксикам высокоэффективен не только в отношении спинального корешкового синдрома [106], особенно в инъекционной форме [107–109], но и в отношении профилактики его осложнений [110].
В настоящее время при нейропатической боли рекомендованы следующие фармакологические методы лечения [111, 112]:
- первая линия – противосудорожные препараты (габапентин и прегабалин), антидепрессанты (трициклические антидепрессанты и двойные ингибиторы обратного захвата серотонина и норадреналина);
- вторая линия – опиоидные анальгетики и трамадол;
- третья линия – некоторые противоэпилептические препараты, антагонисты рецепторов N-метил-D-аспартата, капсаицин и др.
При нейропатической боли также широко применяются инвазивные методы, такие как нервно-мышечные блокады, стимуляция спинного мозга, интратекальное введение анестетиков и нейрохирургические вмешательства [113]. Указанные виды лечения требуют отдельного рассмотрения и поэтому остаются за рамками данного обзора.
При нейропатической боли эффективность нефармакологических неинвазивных методов, таких как чрескожная электростимуляция нервов и когнитивно-поведенческая терапия, не изучена в достаточной степени, поэтому их роль остается неясной [113].
Особое место в лечении нейропатической боли отводится антиконвульсантам.
Последнее время все большее место в терапии боли при ревматических заболеваниях занимает габапентин (Конвалис®). Габапентин – антиконвульсант для лечения эпилепсии, а также нейропатической боли. Габапентин по строению схож с нейротрансмиттером гамма-аминомасляной кислотой (ГАМК), однако механизм его действия не связан с прямым влиянием на ГАМК-рецепторы. Установлено, что габапентин связывается с альфа-2-дельта-субъединицей потенциалзависимых кальциевых каналов и таким образом подавляет поток ионов кальция, играющих важную роль в возникновении нейропатической боли. В клинически значимых концентрациях габапентин не связывается с другими распространенными рецепторами к лекарственным препаратам и нейромедиаторам, присутствующими в головном мозге, в том числе ГАМКА и ГАМКВ. Применение габапентина приводит к подавлению высвобождения нейротрансмиттеров моноаминовой группы [114].
Согласно рекомендациям экспертов Европейской федерации неврологических сообществ [115], группы по изучению невропатической боли при Международной ассоциации по изучению боли [116], Британского национального института здоровья и клинического качества [117], а также Российского экспертного сообщества [118], габапентин является препаратом первой линии для лечения нейропатической боли.
Помимо доказанной эффективности габапентин обладает хорошим профилем безопасности и отсутствием неблагоприятных лекарственных взаимодействий [114]. Его можно назначать в комбинации с большинством НПВП, в том числе с мелоксикамом [119].
В качестве метода аддитивной терапии, усиливающей действие основных препаратов, при нейропатической боли традиционно назначают витамины группы В [120]. Активной комбинацией таких витаминов являются Комбилипен® (в инъекционной форме) и Комбилипен® табс (в форме таблеток). В состав данных препаратов входят пиридоксин, тиамин/бенфотиамин, цианокобаламин в лечебных дозах [121]. Первый компонент обеспечивает синаптическую передачу и обезболивающий эффект, участвуя в синтезе ключевых нейромедиаторов: норадреналина, дофамина, ГАМК, серотонина, задействован в транспорте компонента оболочки нерва – сфингозина. Вторые два компонента стимулируют регенерацию нервной ткани, обеспечивая аксональный транспорт, участвуют в проведении нервного импульса. И наконец, третий компонент – цианокобаламин участвует в синтезе миелиновой оболочки нерва, оказывает непосредственное обезболивающее воздействие.
Данные препараты показаны для комплексной терапии моно- и полинейропатий различного генеза, дорсалгии, люмбоишиалгии, плексопатии, корешкового синдрома, вызванного дегенеративными изменениями позвоночника.
В эксперименте продемонстрирован потенцирующий эффект комбинации витаминов группы В при совместном назначении с НПВП [122]. Комбинированное применение мелоксикама (препарата Артрозан®) и Комбилипена® у пациентов с болью в нижней части спины характеризовалось выраженным снижением интенсивности болевого синдрома, сокращением сроков его купирования, хорошей переносимостью, низкой частотой клинически значимых нежелательных побочных эффектов [123]. При этом положительный эффект сохранялся и по окончании курса терапии.
Эффективность Комбилипена® табс в комбинации с Конвалисом доказана при нейропатической боли у пациентов с диабетической нейропатией [124]. Так, назначение комплекса витаминов группы В сопровождалось значимым снижением выраженности нейропатической боли.
Заключение
Болевой синдром при ревматических заболеваниях, таких как ревматоидный артрит и остеоартрит, определяется комбинацией ноцицептивной и нейропатической боли.
Основой терапии скелетно-мышечной боли при артритах являются НПВП. Для большинства пациентов, исходя из оптимального сочетания профилей гастроинтестинальной и сердечно-сосудистой безопасности, препаратами выбора могут стать умеренно селективные НПВП (мелоксикам).
При нейропатической боли при ревматоидном артрите и остеоартрите целесообразно назначение комбинации НПВП и антиконвульсантов (мелоксикама и габапентина). В качестве дополнительного средства, потенцирующего действие основных препаратов, можно рассматривать комплекс тиамина, пиридоксина и цианокобаламина (препарат Комбилипен®).
D.E. Karateev, E.L. Luchikhina
Moscow Regional Research and Clinical Institute
Contact person: Dmitry Evgenyevich Karateev, dekar@inbox.ru
The principles of drug therapy for neuropathic pain in patients with joint pathology are presented. The review examines the current potential of drug treatment for pain in patients with rheumatoid arthritis and osteoarthritis. Particular attention is paid to the place of NSAIDs, and in particular meloxicam, in the arsenal of a rheumatologist, general practitioner, family doctor and other doctors in the treatment of patients with arthritis, considered the concept of the golden mean in relation to this drug.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.