Сравнительная эффективность неэрголиновых агонистов дофаминовых рецепторов при болезни Паркинсона
- Аннотация
- Статья
- Ссылки
- English
![Таблица 1. Основные характеристики неэрголиновых АДР [9]](/upload/resize_cache/iblock/03b/195_350_1/mirapex1.jpg)


![Таблица 6. Побочные эффекты неэрголиновых АДР [9]](/upload/resize_cache/iblock/5ce/195_350_1/mirapex6.jpg)
Введение
Неэрголиновые агонисты дофаминовых рецепторов (АДР) широко используются при лечении болезни Паркинсона (БП). Благодаря химическим свойствам они напрямую стимулируют дофаминовые рецепторы, воспроизводя эффект дофамина. АДР позволяют отсрочить начало приема препаратов леводопы, а также уменьшить выраженность моторных флуктуаций. Тем не менее применение этой группы препаратов связано со специфическими побочными эффектами, которые могут значительно влиять на качество жизни пациентов с БП. Некоторые из АДР несут значительные риски для пожилых лиц, имеющих в анамнезе сердечно-сосудистые заболевания, когнитивные расстройства, психотические нарушения. При назначении АДР необходимо учитывать фармакокинетические и фармакодинамические аспекты терапии.
Для повышения сниженной дофаминергической активности при БП АДР применяются с 1971 г. Сначала они использовались в качестве дополнения к леводопе, однако позже было установлено, что на ранних стадиях БП АДР обладают сопоставимым по эффективности с леводопой эффектом [1–4]. Кроме того, их раннее назначение снижает риск возникновения моторных флуктуаций и лекарственных дискинезий. На развернутых стадиях БП АДР уменьшают моторные флуктуации и позволяют сократить суточную дозу леводопы [5, 6]. Некоторые АДР не только эффективно контролируют основные симптомы БП, в том числе тремор, но и уменьшают выраженность депрессии и тревоги, которые часто сопутствуют БП.
Дофаминовые рецепторы представлены во многих тканях организма, преимущественно в головном мозге. Были выделены две группы дофаминовых рецепторов, которые принадлежат группе белковых рецепторов G. К D1-подобным рецепторам относятся рецепторы D1 и D5, D2-подобные рецепторы включают D2-, D3- и D4-рецепторы. Дофаминергические связи задействованы в большом количестве физиологических функций, включая когнитивные функции, продуцирование чувств удовольствия, ощущения награды, формирование зависимости, осуществление мелкой моторики, модуляцию нейроэндокринных путей и обучение. Двигательная активность преимущественно контролируется D1-, D2- и D3-рецепторами. D1- и D2-рецепторы имеют решающее значение для процессов обучения и механизмов памяти, которые опосредуются префронтальной корой, а также доминируют в системе вознаграждения и подкрепляющих путей (в меньшей степени в этом процессе задействованы D3-рецепторы). D2-рецепторы задействованы в регуляции психической деятельности и поведения. D3-рецепторы, расположенные в лимбической части головного мозга, принимают участие в процессах формирования зависимости. Стимуляция D4-рецепторов играет роль в развитии склонности к употреблению стимуляторов.
Противопаркинсонический эффект связан со стимуляцией D2-рецепторов. Дофаминергические нейроны имеют пресинаптические ауторецепторы, влияющие на активность нейрона, синтез и высвобождение дофамина. Их роль выполняют D2- и D3-рецепторы. Предполагается, что с активацией именно этих рецепторов связан нейропротективный эффект АДР. Функция D4- и D5-рецепторов остается неизвестной. Некоторые из АДР повышают умственную работоспособность, память, внимание за счет избирательного взаимодействия с D2- и D3-рецепторами мезолимбической системы и уменьшения разрушения дофамина в лобной коре [7].
Дофаминергические связи играют важную роль во взаимодействии вне центральной системы. D2-рецепторы в гипофизе регулируют секрецию пролактина. Они также представлены в клубочках, клубочковой зоне коры надпочечников, почечных канальцах и постганглионарных симпатических нервных окончаниях. D1-подобные рецепторы содержатся в юкстагломерулярном аппарате и почечных канальцах. Таким образом, дофамин участвует в почечных и сердечно-сосудистых процессах, таких как увеличение сократимости миокарда и сердечного выброса [8].
Неэрголиновые АДР
Основные характеристики неэрголиновых АДР представлены в табл. 1. Неэрголиновые АДР могут назначаться перорально (прамипексол, пирибедил, ропинирол), трансдермально (ротиготин) или подкожно (апоморфин). Не так давно были разработаны пероральные АДР длительного действия, благодаря чему стал возможным прием один раз в сутки. Эти препараты поддерживают более стабильную концентрацию лекарственного средства в плазме, тем самым сводя к минимуму моторные флуктуации.
Пирибедил
Стимулирует D3-подтип D2-рецепторов, блокирует пресинаптические альфа-2-адренорецепторы, способствуя усилению норадренергической передачи [9]. Стимуляция D3-подтипа D2-рецепторов в лимбической системе сопряжена с антидепрессивным эффектом АДР. Пирибедил, будучи антагонистом альфа-2-адренорецепторов, улучшает норадренергическую передачу в коре, лимбической системе и голубом пятне. Кроме того, посредством повышения активности норадренергической системы пирибедил стимулирует холинергическую передачу в коре головного мозга, что может положительно влиять на позу и походку, а также на когнитивные функции у больных БП.
Ропинирол
Связывается с периферическими и центральными рецепторами, имеет максимальное сродство к D3-подтипу рецепторов. Препарат немедленного высвобождения быстро всасывается и достигает максимальной концентрации в плазме через один-два часа. Биодоступность составляет 50%. Метаболизируется в печени цитохромом P450. Ципрофлоксацин, флувоксамин и высокие дозы эстрогенов повышают концентрацию ропинирола в плазме, в то время как употребление табака, напротив, ее уменьшает [10]. Препарат в форме замедленного высвобождения под воздействием кишечных ферментов становится желатинообразным, что делает возможным медленное равномерное высвобождение и поглощение лекарственного средства в течение 24 часов, независимо от приема пищи. Биодоступность препарата с длительным высвобождением составляет около 50%. Фармакокинетика линейна. Период достижения максимальной концентрации – от шести до десяти часов. Сравнительные исследования показали, что более стабильная концентрация лекарственного средства в плазме крови достигается на фоне приема препарата в форме длительного действия по сравнению с аналогичной дозой препарата в форме немедленного высвобождения, который принимается три раза в день [10].
Ротиготин
Имеет низкую молекулярную массу и является высоко жирорастворимым, что позволяет ему проникать через роговой слой кожи. Препарат представляет собой силиконовую клейкую форму с алюминизированным полиэфирным пленочным покрытием. Лекарственное средство высвобождается постоянно и пропорционально площади поверхности пластыря. Ротиготин имеет высокое сродство к D3-рецепторам, стимулирует 5НТ1А-серотониновые и адренергические рецепторы [11]. Трансдермальная абсорбция составляет в среднем 46,1 ± 10,6% от общего содержания пластыря. При условии, что пластырь меняется ежедневно, концентрация в плазме остается стабильной. Ротиготин метаболизируется в печени цитохромом P450, его метаболиты выводятся с мочой [11].
Апоморфин
Неэрголиновый агонист, взаимодействующий с D2- и D3-рецепторами, в основном применяется в виде подкожных инъекций или подкожных инфузий для купирования эпизодов выключения.
Прамипексол
Прамипексол (Мирапекс) является мощным агонистом D2-рецепторов с максимальным сродством к подтипу D3-рецепторов. Прамипексол немедленного высвобождения быстро всасывается и достигает максимальной концентрации через один-два часа после введения или позже, если принят вместе с пищей. Биодоступность составляет около 90%. Прамипексол характеризуется линейной фармакокинетикой, низкой связывающей способностью с белками плазмы (< 20%) и большим объемом распределения. Бóльшая часть дозы (80%) выводится в неизменном виде посредством канальцевой секреции мочи. Не было описано значимых лекарственных взаимодействий, за исключением возможного снижения экскреции прамипексола у пациентов, получавших его одновременно с циметидином и амантадином [12].
При прямом сравнении эффективности прамипексола и леводопы в качестве начальной терапии больных на ранних стадиях БП в течение четырех лет прамипексол значительно уменьшал частоту развития двигательных флуктуаций (на 30%) и лекарственных дискинезий (на 50%) (исследование CALM-PD) [13]. Продолжительные открытые исследования показали, что многие больные БП могут оставаться только на монотерапии прамипексолом в течение достаточно длительного срока (более трех лет), поскольку его эффективность на ранних стадиях почти сопоставима с препаратами леводопы. Исследование, посвященное изучению эффективности прамипексола на развернутых стадиях БП, показало, что добавление прамипексола к леводопе уменьшает выраженность моторных флуктуаций [14].
Благодаря селективной стимуляции D3-рецепторов в мезолимбической дофаминергической системе прамипексол оказывает воздействие на нейропсихологические нарушения и уменьшает степень депрессивного синдрома (связывание с D3-рецепторами обеспечивает антидепрессивный и антиангедонический эффект). Международные двойные слепые контролируемые исследования выявили наличие дозозависимого антидепрессивного эффекта прамипексола при лечении как психиатрических больных с депрессией, так и больных БП с аффективными нарушениями. При этом фармакотерапевтический эффект прамипексола был выше, чем у антидепрессантов флуоксетина и сертралина [15].
Прамипексол значительно уменьшает выраженность тремора при БП и позволяет добиться улучшения качества жизни больных с трудно курабельной дрожательной формой заболевания.
С 2009 г. в клинической практике стал применяться прамипексол с постепенным высвобождением активного вещества (пролонгированный), который принимается один раз в сутки. Фармакокинетический профиль прамипексола с постепенным высвобождением характеризуется высокой биодоступностью – более 90%. Время достижения максимальной концентрации в плазме составляет шесть часов, связывание с белками плазмы – менее 20%, период полужизни в плазме – 8–12 часов.
К преимуществам прамипексола постепенного высвобождения относятся стабильная концентрация препарата в плазме, 24-часовая продолжительность действия, а также возможность повышения приверженности больного терапии. Известно, что низкая комплаентность пациентов с БП связана со многими факторами:
- сложным режимом приема препаратов;
- необходимостью комбинации различных лекарственных препаратов;
- периодом титрации доз при введении нового противопаркинсонического средства;
- частым изменением схемы приема препаратов лечащим врачом в зависимости от клинической эффективности терапии и наличия побочных эффектов.
Кроме того, аффективные расстройства (тревога, депрессия, апатия) и когнитивные нарушения при БП часто приводят к преждевременному отказу от приема лекарственных средств или изменению схемы терапии пациентами самостоятельно. Получены данные, что 50% больных пропускают прием одной дозы, а 20% – прием трех и более доз противопаркинсонического препарата в течение одной недели наблюдения [16]. Проведенное в Европе исследование выявило, что пациенты с БП предпочитают однократный прием трехкратному приему препарата [17].
Таблетки пролонгированного действия принимают один раз в день, приблизительно в одно и то же время дня, независимо от приема пищи. Таблетки проглатывают целиком, запивая водой, их нельзя разжевывать, разламывать или измельчать. Если пропущен прием препарата и с момента обычного времени приема прошло не более 12 часов, дозу следует принять. Если прошло более 12 часов, то пропущенную дозу принимать не следует, очередная доза должна приниматься на следующий день в обычное время. Пациентов, которые уже принимают таблетки быстрого высвобождения, можно перевести на таблетки пролонгированного действия в течение одних суток, в той же дозе.
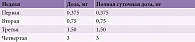
Начиная со стартовой дозы 0,375 мг/сут, дозу прамипексола пролонгированного действия следует постепенно увеличивать каждые пять – семь дней. Для предотвращения нежелательных побочных эффектов доза подбирается до достижения максимального терапевтического эффекта (табл. 2). Если необходимо дальнейшее наращивание дозы, дневную дозу повышают на 0,75 мг через недельные интервалы до максимальных 4,5 мг в день.
Фармакотерапевтическая эффективность прамипексола постепенного высвобождения была изучена в многоцентровых рандомизированных двойных слепых плацебоконтролируемых исследованиях с участием большого количества пациентов на ранних и поздних стадиях БП [14].
Две формы прамипексола – постепенного и немедленного высвобождения – отличаются только скоростью реализации активного вещества. Они содержат ту же активную субстанцию, характеризуются одинаковым профилем взаимодействия с дофаминовыми рецепторами, сходной фармакотерапевтической эффективностью. Постепенное высвобождение активного вещества из депо-таблетки обеспечивает более продолжительный период полужизни препарата в плазме и более стабильную концентрацию в течение суток, что позволяет реализовать концепцию постоянной дофаминергической стимуляции постсинаптических рецепторов для профилактики возникновения и терапии уже развившихся моторных флуктуаций и лекарственных дискинезий. Кроме того, пролонгированная форма препарата, вероятно, дает возможность лучше контролировать ночные моторные и немоторные симптомы у больных БП.
Прамипексол постепенного высвобождения показан на ранних и развернутых стадиях БП. На ранних стадиях заболевания он может назначаться однократно в сутки в виде монотерапии или в комбинации с амантадинами и ингибиторами моноаминоксидазы типа В, на развернутых стадиях – в комбинации с препаратами леводопы.
Перевод больных с прамипексола немедленного высвобождения на прамипексол постепенного высвобождения осуществляется на следующий день после ночного перерыва в эквивалентной суточной дозе. Если эффект фармакотерапии несколько снижается после перевода на пролонгированную форму, возможна коррекция суточной дозы на последующих этапах лечения.
Большим преимуществом прамипексола постепенного высвобождения является однократный прием в течение суток, что значительно увеличивает комплаентность больных БП.
Целью собственного исследования, проведенного на кафедре неврологии РМАПО, являлось сравнительное изучение частоты побочных эффектов, возникающих у больных БП на фоне приема двух лекарственных форм прамипексола: немедленного и замедленного высвобождения.
Под наблюдением находились две группы больных на развернутых стадиях БП, получавших комбинированную терапию препаратами леводопы и прамипексолом. Группы больных были сопоставимы по полу, возрасту, а также продолжительности и степени тяжести заболевания (основные характеристики представлены в табл. 3). Первую группу составили 15 пациентов, они получали наряду с леводопой прамипексол немедленного высвобождения в дозе 3 мг/сут (1 мг три раза в день). Вторую группу – 15 больных, которые принимали прамипексол длительного высвобождения в дозе 3 мг один раз в день перед сном в комбинации с леводопой. Продолжительность наблюдения составила три месяца.
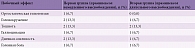
Частота основных побочных эффектов при терапии разными формами прамипексола в комбинации с препаратами леводопы представлена в табл. 4. Следует отметить, что на фоне приема пролонгированного прамипексола однократно на ночь у больных на развернутых стадиях БП отмечалась меньшая частота возникновения ортостатической гипотензии и дневной сонливости.
Конечно, проведенное исследование имеет определенные недостатки (короткий период наблюдения (три месяца) и небольшая выборка пациентов). Однако у всех больных БП на развернутых стадиях заболевания с ночной акинезией и симптомами гиперактивного мочевого пузыря (ноктурией), получавших пролонгированную форму прамипексола на ночь, отмечалась тенденция к уменьшению этих симптомов. Необходимо провести более длительное наблюдение, включающее большее количество пациентов.
Преимущества и недостатки АДР
Преимущества и недостатки применения АДР указаны в табл. 5 [18].
Преимущества
Одним из важных аргументов в пользу целесообразности начала терапии БП с назначения АДР является их возможный нейропротективный эффект. В эксперименте на животных и в культуре нейронов было показано, что АДР защищают дофаминергические и недофаминергические нейроны от различных токсинов [19, 20]. Они могут замедлять прогрессирование БП за счет снижения оборота дофамина, образования и высвобождения свободных радикалов, уменьшения эксайтотоксичности, повышения регуляции нейротрофических факторов, нормализации биоэнергетических нарушений, ингибирования апоптоза и реверсирования патологии убиквитин-зависимой протеасомной системы [19].
В нескольких исследованиях изучалась скорость уменьшения числа дофаминовых рецепторов у группы пациентов с БП, получающих только АДР, и группы больных, получающих только леводопу, с применением позитронно-эмиссионной томографии с 18F-3,4-дигидроксифенилаланином (18F-dopa9) или однофотонной эмиссионной компьютерной томографии с 2-бета-карбометокси-3-бета-(4-йодофенил)тропаном (бета-CIT) [21]. Позитронно-эмиссионная томография с использованием 18F-dopa обеспечивает оценку способности сохранившихся нигростриарных нейронов захватывать ДОФА-декарбоксилазу и сохранять производные дофамина в нервных окончаниях. Однофотонная эмиссионная компьютерная томография с использованием бета-CIT оценивает количество транспортеров дофамина в оставшихся окончаниях дофаминовых нейронов. Длительное исследование продемонстрировало корреляцию между степенью снижения маркеров и тяжестью двигательных расстройств при БП [22]. В исследовании CALM-PD-CIT оценивалось уменьшение транспортера дофамина у больных БП, первоначально получавших монотерапию прамипексолом или леводопой. Было показано, что скорость уменьшения поглощения бета-CIT в полосатом теле была значительно меньше у тех пациентов, которые принимали прамипексол, по сравнению с группой больных, получавших леводопу [21].
Побочные эффекты
Наиболее характерными побочными эффектами всех АДР являются тошнота, рвота, диспепсия, постуральная гипотензия, сердечные аритмии, а также центральные побочные эффекты в виде галлюцинаций и психозов, нарушений сна и приступов дневной сонливости (табл. 6). Психотические расстройства наблюдаются чаще в пожилом и старческом возрасте при наличии выраженных когнитивных нарушений, поэтому таким больным АДР следует назначать с осторожностью, в меньших терапевтических дозах и с более длительным периодом титрования суточной дозировки. В последние годы обсуждаются возможные побочные эффекты агонистов в виде развития патологических влечений (игромании, шопингомании, гиперсексуальности).
Выраженность побочных эффектов АДР зависит от режима лечения, типа используемых лекарственных препаратов (или их комбинации) и индивидуальной психофизиологической и генетической конституции [18].
Переход с одного АДР на другой
Несмотря на то что, по данным контролируемых клинических испытаний, фармакотерапевтическая эффективность и профиль побочных эффектов разных АДР приблизительно одинаковы, некоторые исследования показали, что эффективность агонистов может отличаться. В этой связи иногда возникает необходимость перевода больного с одного агониста на другой.
Замена АДР проводится при развитии нежелательных явлений, снижении эффекта терапии, а также в случае необходимости коррекции специфических немоторных симптомов (депрессии, ортостатической гипотензии, нарушений сна, синдрома беспокойных ног и др.).
Переход может происходить постепенно, в течение одной – двух недель методом снижения дозы одного препарата вплоть до полной его отмены с последующим введением нового агониста и наращиванием его дозы. Именно этот способ ретитрации распространен в повседневной практике. Однако при его применении неизбежно некоторое ухудшение симптомов паркинсонизма.
Второй способ – перевод больного с одного на другой агонист сразу (на следующий день) в эквивалентной дозе без периода ретитрации. По результатам некоторых немногочисленных исследований, этот способ перевода также безопасен [23]. К тому же он не сопровождается временным нарастанием двигательных симптомов. В одном открытом клиническом исследовании изучалась безопасность быстрого способа перевода (на следующий день) на прамипексол 227 пациентов с БП, получавших или бромокриптин, или перголид, или ропинирол в комбинации с леводопой [24]. После перевода у всех пациентов с БП отмечалось улучшение показателей унифицированной шкалы оценки проявлений болезни Паркинсона (United Parkinson’s Disease Rating Scale) на 26–30%, причем удалось незначительно уменьшить суточную дозу леводопы.
Наконец, третий способ – снижение дозы текущего АДР с постепенным введением и повышением дозы нового агониста. При этом способе два агониста принимаются вместе в течение двух недель, и далее первый агонист вытесняется вторым. В крупном исследовании (n = 1202) H. Reichmann и соавт. установили, что независимо от способов перевода больных БП с других агонистов на прамипексол во всех случаях отмечалось улучшение состояния больных [25].
Заключение
К преимуществам АДР нового поколения по сравнению с препаратами леводопы можно отнести следующие свойства:
- непосредственное стимулирование дофаминовых рецепторов;
- отсутствие конкуренции с аминокислотами пищи за всасывание в кишечнике и проникновение через гематоэнцефалический барьер;
- длительный период полувыведения, обеспечивающий стабильную и близкую к физиологической стимуляцию дофаминовых рецепторов, что снижает риск развития моторных флуктуаций и лекарственных дискинезий;
- отсутствие окислительного метаболизма АДР, что в свою очередь не приводит к образованию свободных гидроксильных радикалов, которые могут ускорять апоптоз нейронов;
- возможный нейропротективный эффект;
- наличие форм с немедленным и постепенным высвобождением.
Существуют значительные различия между АДР в продолжительности периода полувыведения в плазме крови, их связывания с норадренергическими и серотонинергическими рецепторами. Проводилось только одно прямое сравнительное исследование эффективности АДР, где сопоставлялось влияние прамипексола и ропинирола на нейропсихологический профиль пациентов с БП. В этом исследовании прамипексол приводил к значительному регрессу показателей шкалы апатии [26].
Хотя применение нескольких АДР одновременно не рассматривается в литературе, иногда могут быть полезными некоторые комбинации, такие как вводящийся подкожно апоморфин, трансдермальный пластырь ротиготин и один из пероральных АДР [27].
Замена одного АДР на другой возможна и безопасна, хотя в первые дни могут возникать побочные эффекты. Следствием резкого прекращения приема АДР может стать синдром отмены. Временное прекращение приема любого АДР, особенно прамипексола, может приводить к возникновению апатии.
Перспективным представляется прямое сравнительное исследование эффективности различных АДР, а также дальнейшее изучение нейропротективных свойств АДР в клинической практике, их влияния на аффективные и когнитивные нарушения при БП. Кроме того, интерес представляет изучение динамики лекарственных дискинезий различного типа на фоне приема прамипексола постепенного высвобождения.
Отсутствие двойных слепых контролируемых сравнительных исследований АДР затрудняет выявление специфических свойств этого класса препаратов. Некоторые данные позволяют предполагать определенные различия клинического эффекта АДР у больных БП.
Для сравнительной оценки фармакотерапевтической эффективности различных АДР, частоты побочных эффектов терапии, а также выявления возможных преимуществ пролонгированных форм АДР необходимо провести контролируемые сравнительные исследования с участием большого количества пациентов с БП.
N.V. Fedorova, S.M. Omarova
Russian Medical Academy of Postgraduate Education
Contact person: Natalia Vladimirovna Fedorova, natalia.fedorova@list.ru
Dopamine receptor agonists (DRA) replenish dopaminergic deficits in Parkinson’s disease providing stimulation of dopamine receptors in the brain. These drugs have benefits over levodopa, but also may be a culprit of occurring adverse events. Here, pharmacological properties of major non-ergolinic DRAs are reviewed including benefits and specifics of using long-term release drugs, and side effects related to DRA pharmacotherapy. The data of personal study are presented that compared rate of side effects associated with immediate- and extended-release pramipexole.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.