Сравнительное изучение фармакокинетики различных лекарственных форм интерферона-альфа-2b
- Аннотация
- Статья
- Ссылки


Экспериментальные исследования и опыт практического применения препаратов интерферона доказали, что их парентеральное введение целесообразно не при всех заболеваниях. Препараты, предназначенные для местного применения (мази, суппозитории, капли и т. д.), при ряде нозологических форм оказываются эффективнее, т. к. способны обеспечить более высокие концентрации препарата непосредственно в очаге поражения при отсутствии побочных эффектов, свойственных парентеральному введению высоких доз интерферона. Однако следует заметить, что при лечении инфекционно-воспалительных заболеваний урогенитального тракта важным является не только местное действие интерферона, но и общее, позволяющее достичь системного иммуномодулирующего и противовирусного эффекта. Особенно большое значение имеет накопление препарата в органах малого таза ввиду того, что распространение инфекции при этих заболеваниях нередко носит восходящий характер. Поэтому данные о фармакокинетике препаратов интерферона, вводимых в виде суппозиториев, представляют большой научный и практический интерес.
Единичные исследования, посвященные фармакокинетике рекомбинантного ИФНα-2b, вводимого в виде суппозиториев per rectum, свидетельствуют о том, что пик концентрации ИФН в сыворотке отмечается через 2 часа после введения препарата, а снижение до первоначальных цифр наступает через 8 часов. Однако в литературе отсутствуют данные о распределении препарата в органах малого таза и, что особенно важно, об особенностях фармакокинетики препаратов интерферона, вводимых вагинально.
Следует отметить, что исследование фармакокинетики ИФН связано с определенными трудностями, связанными, прежде всего с необходимостью дифференцировать эндогенный интерферон и вводимый извне препарат интерферона. Вместе с тем известно, что введение экзогенного интерферона способно индуцировать выработку эндогенного цитокина, что может привести к неправильной интерпретации результатов фармакокинетического исследования. Поэтому в данном исследовании был использован рекомбинантный ИФНα-2b, помеченный радиоактивным изотопом йод-131, что позволило получить достоверные данные о его распределении в организме лабораторных животных после введения.
Данное исследование стало первым, продемонстрировавшим хорошую всасываемость ИФНα-2b при его вагинальном введении. Эти данные представляют значительный интерес как для клиницистов, так и для фармакологов.
Целью настоящего исследования стало сравнительное изучение фармакокинетики радиоиодированного рекомбинантного ИФНα-2b при различных способах его введения в организм.
Материалы и методы
Препарат ИФН
Препарат рекомбинантного человеческого ИФНα-2b, использованный в исследовании, идентичен субстанции ИФНα-2b используемой в производстве суппозиториев Генферон (ЗАО »Биокад», Россия).
Методика радиоиодирования
К 0,3 мл раствора интерферона (0,25 мг/мл) в 25 М ацетатном буфере добавляли 0,1 мл 0,2 М фосфатного буфера рН 7,4 и 0,05 мл раствора Na131I в том же буфере. К этой смеси добавляли 0,02 мл раствора Хлорамина Б (1 мг/мл) в дистиллированной воде и реакционную смесь перемешивали в течение 3 мин. Реакцию останавливали добавлением 0,04 мл раствора тиосульфата натрия (2 мг/мл) в воде, после чего реакционную смесь пропускали через хроматографическую колонку NAP-5.
Приготовление лекарственных форм
Раствор для инъекций готовили путем элюирования йодированного ИФНα-2b с колонки NAP-5 стерильным изотоническим раствором хлорида натрия.
Для приготовления суппозиториев навеску суппозиторной массы расплавляли на водяной бане при температуре 41±0,3°С. В этот расплав добавляли очищенный йодированный интерферон в изотоническом растворе хлорида натрия, содержащем 2% декстрана 60000. Масса раствора составляла не более 1,8 % от веса суппозиторной массы. Смесь перемешивали в течение 5-10 мин. и фасовали в формы по 0,8-0,9 мл. После охлаждения, свечи до употребления, хранили в холодильнике при температуре +4°С. Состав суппозиторной массы, применявшейся в эксперименте, аналогичен составу основы суппозиториев Генферон (ЗАО «Биокад»). Основными компонентами препарата Генферон являются интерферон человеческий рекомбинантный альфа-2b типа, таурин и анестезин. Комбинация активных и вспомогательных веществ, входящих в состав Генферона, не только позволяет сохранить активность и физические свойства ИФН, но и расширяет спектр действия препарата, обладая аддитивным эффектом. Генферон обладает иммуномодулирующим, противомикробным, противовирусным, регенерирующим, репаративным, противовоспалительным, мембраннопротекторным, антиоксидантным, нормализующим метаболические процессы действием. Генферон высокоэффективен при генитальном герпесе, хламидиозе, остроконечных кондиломах, хроническом простатите и других инфекционно-воспалительных заболеваниях урогенитального тракта.
Биологический эксперимент
Исследование фармакокинетики радиоиодированного интерферона было проведено на 20 кроликах породы Шиншилла обоих полов весом 2200-3000 г. Препарат вводили внутримышечно самцам (контрольная группа), ректально самцам и интравагинально самкам. Через 1, 3, 5 и 24 часа после введения препарата животных подвергали эвтаназии. У всех животных выделяли следующие ткани и органы: кровь (1 мл), щитовидную железу, сердце, легкие, печень, селезенку, почки, прямую кишку, мочевой пузырь, семенники, мышечную ткань. При внутримышечном введении дополнительно забирали мышечную ткань в месте введения и интактную мышечную ткань, симметричную месту введения. При ректальном введении дополнительно выделяли нижний отдел прямой кишки (место введения), а при интравагинальном – нижнюю часть влагалища (место введения), яичники, матку с верхней частью влагалища. Все органы и пробы тканей взвешивали; из печени брали 3 навески из различных частей органа. Мочевой пузырь при вскрытии перевязывали лигатурой и извлекали с содержимым, затем взвешивали. Содержание радионуклида в органах и тканях определяли методом прямой радиометрии на автоматическом спектрометре NK-350 (Венгрия). По результатам радиометрии рассчитывали процентное соотношение накопленной активности в органе или ткани по отношению к введенной активности.
Результаты и обсуждение
Введение в молекулы белков и пептидов радиоизотопов йода (радиоиодирование) может осуществляться прямым или непрямым способом. В первом случае объектом йодирования являются ароматические ядра аминокислот, в первую очередь тирозина. Источником частицы I+ является раствор иодида натрия, на который воздействуют различные окислители – хлорамин Т, пероксидаза, йодоген, электрический ток и другие. Во втором случае к N-концу исходного полипептида либо присоединяют специально приготовленный аминокислотный остаток, который затем легко йодируется, либо присоединяют заранее меченый фрагмент. Литературные данные свидетельствуют о том, что для сохранения нативной конформации и биологической активности интерферона-альфа предпочтительно использование прямого метода радиоиодирования с использованием хлорамина в качестве окислителя. Хлораминовый метод радиоиодирования, разработанный и примененный нами, позволяет достичь выхода меченого белка не менее 70%. При этом его биологическая активность соответствует нативному интерферону, что свидетельствует о сохранности конформации белка и, следовательно, особенностей его фармакокинетики.
При проведении фармакокинетических исследований белков, меченных радиоактивной меткой, важно дифференцировать радиоактивность, источником которой является непосредственно меченый белок, и излучение свободных молекул радиоактивного йода, возникающих при распаде меченого белка. Поскольку свободные молекулы йода преимущественно накапливаются в щитовидной железе, тот факт, что в нашем исследовании активность препарата в этом органе составляла не более 2% от введенной дозы, свидетельствует о высокой стабильности меченого белка. Таким образом, полученные при измерении радиоактивности данные говорят о распределении в тканях и органах именно молекул интерферона.
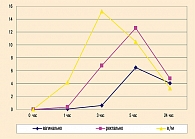
Анализ содержания препарата в крови после внутримышечного введения подтверждает литературные данные о быстром всасывании интерферона из мышечной ткани. Пик концентрации ИФН в крови при внутримышечном введении находился между 1 и 3 часом. При этом в месте введения через 3 часа оставалось менее 1% от начальной активности. При ректальном и, особенно вагинальном пути введения всасывание препарата замедлено (рисунок 1). Пик концентрации ИФНα-2b приходился на 5 часов после введения суппозитория. При этом абсолютный уровень активности в крови был ниже, чем при внутримышечном введении. Замедленное всасывание ИФН при его введении в форме суппозиториев позволяет поддерживать высокую концентрацию препарата в крови в течение длительного времени. Это дает возможность достигать максимального терапевтического эффекта при введении суппозиториев 1-2 раза в сутки. Вместе с тем более низкие пиковые концентрации ИФН не влекут за собой снижения терапевтической эффективности ИФН при инфекционно-воспалительных заболеваниях урогенитального тракта. Это связано с тем, что при данных заболеваниях терапевтический эффект достигается прежде всего за счет локального противовирусного действия и системного иммуностимулирующего эффекта. При этом выраженность иммуностимуляции больше именно при воздействии низких доз ИФНα-2b. В этом состоит коренное отличие принципов интерферонотерапии урогенитальных инфекций от, например, интерферонотерапии вирусных гепатитов, при которых основное значение имеет именно системный противовирусный эффект, достигаемый за счет высокой концентрации экзогенного интерферона в сыворотке крови.
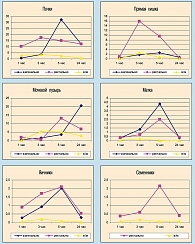
Исследование распределения препарата в отдельных органах выявило значительные его отличия в зависимости от пути введения. Так, при внутримышечном введении меченого белка он практически не определялся в семенниках, тогда как через 5 часов после ректального введения суппозиториев с ИФНα-2b в семенниках обнаруживалось до 2% от введенной дозы препарата. Высокие концентрации меченого ИФНα-2b определялись после интравагинального введения в яичниках и матке (рисунок 2). При этом концентрации препарата в других органах, независимо от пути введения, не превышали 1%. Таким образом, отмечено избирательное накопление ИФНα-2b в органах малого таза после введения в виде суппозиториев. Следует отметить также, что при данном пути введения достигается очень высокая локальная концентрация препарата – так, через 1 час после интравагинального введения суппозиториев во влагалище самок сохранялось свыше 90% введенного ИФН, а через 3 часа – около 10%. Клиническое значение этих данных очевидно – именно суппозиторное введение ИФН пациентам с урогенитальными инфекциями позволяет достичь высокой концентрации препарата в очаге патологического процесса, что является необходимым условием оказания противовирусного и бактериостатического эффекта.
Таким образом, особенности фармакокинетики ИФН при его применении в виде ректальных и вагинальных суппозиториев делают эти пути введения оптимальными для лечения урогенитальных инфекций. Высокая концентрация ИФН в месте введения и в органах малого таза обеспечивает выраженное этиотропное действие препарата, в то время как пролонгированное поступление ИФН в кровь оказывает мощный и продолжительный иммуностимулирующий эффект. Эти выводы подкрепляются клиническими данными о высокой эффективности применения препарата Генферон в составе комплексной терапии инфекционно-воспалительных заболеваний урогенитального тракта.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.