Расчетный индекс нейтрофильных гранулоцитов в дифференциальной диагностике степени тяжести бактериальных инфекционно-воспалительных заболеваний
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить диагностическую эффективность разработанного метода дифференциальной диагностики степени тяжести гнойно-воспалительных заболеваний бактериальной этиологии.
Материал и методы. Проведено клинико-иммунологическое исследование 170 детей с гнойно-воспалительными заболеваниями различной степени тяжести и 73 условно здоровых детей. Оно включало определение в периферической крови количества субпопуляций нейтрофильных гранулоцитов (НГ), экспрессирующих поверхностные мембранные рецепторы CD64, CD16, CD32, CD11b, с оценкой содержания субпопуляций CD64-CD16+CD32+CD11b+ НГ, CD64+CD16+CD32+CD11b+ НГ методом последовательного гейтирования с помощью проточного цитометра Сytomics FC-500 и индекса дифференциальной диагностики – расчетного индекса нейтрофильных гранулоцитов (РИНГ).
Результаты. Для дифференциальной диагностики степени тяжести бактериальных ИВЗ предложен РИНГ, который определяется по соотношению содержания двух функционально значимых субпопуляций НГ, ответственных за реализацию эффекторных функций НГ (фагоцитоз, образование активных форм кислорода, антителозависимую клеточную цитотоксичность, запуск образования нейтрофильных экстрацеллюлярных сетей): РИНГ = К1 : К2, где К1 – СD64-CD16+CD32+CD11b+ НГ%, К2 – СD64+CD16+CD32+CD11b+ НГ%. При РИНГ, равном 0,1–18,9, определяют бактериальные ИВЗ, причем при РИНГ в интервале от 0,1 до 2,9 диагностируют тяжелое течение бактериальной инфекции, при РИНГ в интервале от 3,0 до 5,8 – среднетяжелое течение, а при РИНГ в интервале от 5,9 до 18,9 – легкое течение.
Заключение. Предложенный нами подход к использованию лабораторных показателей, оценивающих динамику соотношения диагностически значимых субпопуляций НГ с расчетом РИНГ, позволил расширить возможности ранней дифференциальной диагностики степени тяжести бактериальных ИВЗ, что оптимизирует диагностический процесс и будет способствовать своевременному и адекватному назначению этиопатогенетического лечебного комплекса при различных бактериальных ИВЗ с достижением более быстрой позитивной клинической эффективности.
Цель исследования – оценить диагностическую эффективность разработанного метода дифференциальной диагностики степени тяжести гнойно-воспалительных заболеваний бактериальной этиологии.
Материал и методы. Проведено клинико-иммунологическое исследование 170 детей с гнойно-воспалительными заболеваниями различной степени тяжести и 73 условно здоровых детей. Оно включало определение в периферической крови количества субпопуляций нейтрофильных гранулоцитов (НГ), экспрессирующих поверхностные мембранные рецепторы CD64, CD16, CD32, CD11b, с оценкой содержания субпопуляций CD64-CD16+CD32+CD11b+ НГ, CD64+CD16+CD32+CD11b+ НГ методом последовательного гейтирования с помощью проточного цитометра Сytomics FC-500 и индекса дифференциальной диагностики – расчетного индекса нейтрофильных гранулоцитов (РИНГ).
Результаты. Для дифференциальной диагностики степени тяжести бактериальных ИВЗ предложен РИНГ, который определяется по соотношению содержания двух функционально значимых субпопуляций НГ, ответственных за реализацию эффекторных функций НГ (фагоцитоз, образование активных форм кислорода, антителозависимую клеточную цитотоксичность, запуск образования нейтрофильных экстрацеллюлярных сетей): РИНГ = К1 : К2, где К1 – СD64-CD16+CD32+CD11b+ НГ%, К2 – СD64+CD16+CD32+CD11b+ НГ%. При РИНГ, равном 0,1–18,9, определяют бактериальные ИВЗ, причем при РИНГ в интервале от 0,1 до 2,9 диагностируют тяжелое течение бактериальной инфекции, при РИНГ в интервале от 3,0 до 5,8 – среднетяжелое течение, а при РИНГ в интервале от 5,9 до 18,9 – легкое течение.
Заключение. Предложенный нами подход к использованию лабораторных показателей, оценивающих динамику соотношения диагностически значимых субпопуляций НГ с расчетом РИНГ, позволил расширить возможности ранней дифференциальной диагностики степени тяжести бактериальных ИВЗ, что оптимизирует диагностический процесс и будет способствовать своевременному и адекватному назначению этиопатогенетического лечебного комплекса при различных бактериальных ИВЗ с достижением более быстрой позитивной клинической эффективности.



Введение
Проблема диагностики и лечения различных инфекций признается одной из наиболее злободневных в современном мире, поскольку смертность от этих заболеваний высока и составляет треть от общего ежегодного количества смертей [1, 2].
Большинство людей с повторными острыми и рецидивирующими хроническими респираторными инфекциями являются носителями коинфекции, что в значительной мере может изменять клиническую картину, свойственную каждой инфекции в отдельности, и приводить к более тяжелому течению заболеваний, дополнительной нагрузке на иммунную систему с формированием или прогрессированием иммунной недостаточности [2]. Самым грозным и тяжелым проявлением инфекционно-воспалительных заболеваний (ИВЗ) в разные возрастные периоды является гнойно-септическая патология. Согласно результатам мультицентровых исследований, смертность при сепсисе колеблется от 18 до 33%, при тяжелом сепсисе – от 35 до 55%, при септическом шоке – от 50 до 80% [3–6]. К сожалению, данные официальной статистики, регистрирующей различные нозологии, не отражают реальность существующей проблемы, поскольку данные о распространенности тяжелых и генерализованных форм гнойно-септических заболеваний в России практически отсутствуют [3].
Повышение риска развития инфекционных осложнений при гнойно-воспалительных заболеваниях (ГВЗ) обусловлено расширением объема инвазивных процедур, применением наркоза, назначением длительной антибактериальной терапии, обладающей иммуносупрессивным эффектом, длительной катетеризацией сосудов, искусственной вентиляцией легких, хирургическими вмешательствами с высокой травматизацией тканей. Острый перитонит остается хирургической, общеклинической и общепатологической проблемой. При остром перитоните средние показатели смертности сохраняются на уровне 20–30%, а при наиболее тяжелых его формах – на уровне 40–50% [7]. Острая внебольничная пневмония считается одной из главных причин детской смертности в мире. В 15% случаев внебольничных пневмоний встречаются деструктивные формы пневмонии, а на долю легочно-плевральных форм острой деструктивной пневмонии приходится от 26,5 до 60,0% случаев [8, 9]. Растет и заболеваемость острым гематогенным остеомиелитом (ОГО), частота встречаемости которого составляет 15,4 случая на 100 тыс. населения, при этом на осложнения ОГО приходится от 8,6 до 12,0% [10].
При верификации тяжести гнойно-воспалительного процесса часто возникают определенные сложности, мешающие правильному выбору этиотропной терапии. Имеющиеся на сегодняшний день способы исследования, выявляющие этиологический фактор (иммуноферментный анализ, полимеразная цепная реакция, микробиологические методы), требуют больших временных затрат. В ряде крупных исследований продемонстрировано, что ни клиническая картина, ни уровень маркеров воспаления не обладают достаточной чувствительностью и специфичностью для оценки тяжести течения инфекционного процесса бактериальной природы. Полагаться на классические маркеры воспаления (количество лейкоцитов, тромбоцитов, лейкоцитарная формула, лейкоцитарный индекс интоксикации, скорость оседания эритроцитов (СОЭ), уровень С-реактивного белка (СРБ) и прокальцитонина (ПКТ) и др.) не всегда продуктивно. Так, повышение плазменных уровней, традиционно применяемых для диагностики воспалений белков острой фазы воспаления, таких как СРБ, интерлейкин 6, фактор некроза опухоли α, происходит не только в случаях инфекций, но и в случаях, не связанных с инфекциями. Например, при некрозах тканей (ожог, травма) и при некоторых злокачественных опухолях [11, 12]. Установлено, что ПКТ синтезируется по несептическому пути и у некоторых гематологических пациентов. Было также выявлено, что в большинстве неинфекционных эпизодов повышение сывороточных уровней ПКТ и СРБ статистически неотличимо от такового при грамотрицательном сепсисе. Все это не позволяет считать ПКТ стопроцентным маркером инфекции [13].
Существует большое разнообразие расчетных индексов, при помощи которых осуществляются попытки оценки степени интоксикации, неспецифической реактивности и активности воспаления.
В 2007 г. Т.В. Овсянникова предложила классифицировать интегральные лейкоцитарные индексы в следующем порядке [14].
- Индексы интоксикации – интегральный показатель тяжести по М.М. Соловьеву, Т.М. Алехиной [15], лейкоцитарный индекс интоксикации по Л.Я. Кальф-Калифу [16], лейкоцитарный индекс интоксикации В.К. Островского [17], ядерный индекс интоксикации Г.А. Даштоянца [16], общий индекс эндогенной интоксикации, индекс сдвига лейкоцитов крови.
- Индексы неспецифической реактивности – индекс соотношения нейтрофилов и лейкоцитов В.М. Угрюмова [14], индекс соотношения нейтрофилов и моноцитов, индекс соотношения лимфоцитов и моноцитов, индекс соотношения лимфоцитов и эозинофилов.
- Индексы активности воспаления – индекс соотношения лейкоцитов и СОЭ, лимфоцитарно-гранулоцитарный индекс.
И.О. Походенько-Чудакова и Ю.М. Казакова (2007 г.) сделали вывод, что индекс соотношения лимфоцитов и моноцитов не информативен у больных с гнойно-воспалительными процессами челюстно-лицевой области, а лейкоцитарный индекс интоксикации по Л.Я. Кальф-Калифу, лейкоцитарный индекс интоксикации В.К. Островского, ядерный индекс интоксикации Г.А. Даштоянца, индекс сдвига лейкоцитов крови, индекс соотношения нейтрофилов и лейкоцитов В.М. Угрюмова, индекс соотношения нейтрофилов и моноцитов не отражают распространенность процесса [18]. И.В. Гребенникова и соавт. (2022 г.) пришли к заключению, что гематологические лейкоцитарные и тромбоцитарные биомаркеры COVID-19 ориентировочно можно использовать как альтернативу сложным и дорогостоящим методам [19]. В работе Я.Н. Шойхет и В.Г. Устинова (2011 г.) у пациентов с инфекционными деструкциями легких была отмечена разнонаправленность многих лейкоцитарных индексов [20]. Для оценки уровня эндогенной интоксикации при бактериальной инфекции М.И. Громов и соавт. (2023 г.) выбрали упрощенный вариант лейкоцитарного индекса интоксикации В.К. Островского – без учета плазматических клеток [21]. Все вышеописанные индексы позволяют лишь ориентировочно оценить тяжесть протекающего ИВЗ – во всех случаях отсутствует четкая верификация степени тяжести течения бактериальных ИВЗ (легкая, средняя, тяжелая).
В настоящее время назрела острая необходимость поиска новых способов дифференциальной диагностики ИВЗ бактериальной природы, при этом определение степени тяжести бактериального процесса очень важно для своевременной оптимизации дальнейшего лечения.
Во многих работах показано, что нейтрофильные гранулоциты (НГ) играют решающую и предопределяющую роль в антибактериальной защите при ГВЗ, которые, как правило, протекают на фоне различных иммунодефицитных состояний [22–26]. Под воздействием внутри- и внеклеточных факторов НГ способны динамично перестраивать свое рецепторное оснащение, что в свою очередь отражается на их способности оказывать как позитивное эффекторное и регуляторное влияние на течение инфекционного процесса, так и супрессорный эффект или гиперергическое повреждающее воздействие, приводящее к развитию рецидивирующих или тяжело протекающих гнойных инфекций, не отвечающих на традиционную терапию [2, 25, 26]. Определение относительного количества НГ с учетом характера представленности тех или иных мембранных рецепторов (CD62L, CD63, CD11b/CD18, CD16, CD64 и т.д.), являющихся высокочувствительными индикаторами происходящих клеточных реакций, позволяет оценить не только связь НГ с экстрацеллюлярным окружением, их фагоцитарный и микробицидный потенциал, но и адекватность включенности НГ в иммунный ответ [27].
Выявление отдельных фенотипических профилей субпопуляций НГ у пациентов с ГВЗ представляется информативным с диагностической точки зрения и диктует необходимость изучения функций НГ с различной рецепторной оснащенностью. Для дифференциальной диагностики степени тяжести бактериальных ИВЗ нами была выбрана диагностически значимая субпопуляция НГ, экспрессирующая рецепторы CD64, CD16, CD32, CD11b, отвечающие за распознавание инфекционного агента, активацию НГ и запуск эффекторных функций.
CD64 (FcγRI) – высокоаффинный рецептор, способный связывать иммуноглобулины (Ig) IgG1, IgG3 и IgG4 человека в мономерной форме. В условиях «физиологического покоя» у здоровых людей на мембранной поверхности неактивных НГ FcγRI экспрессируется на очень небольшом количестве НГ периферической крови и в малом количестве на мембране – ~1400 рецепторов на клетку. Однако в присутствии компонентов микробной стенки (LPS), продуктов расщепления комплемента и некоторых провоспалительных цитокинов, таких как IFN-γ и G-CSF, CD64 быстро мобилизуется из цитоплазмы на поверхностную мембрану НГ. Появление большого количества НГ, экспрессирующих данный рецептор, рядом авторов оценивается как ранний диагностический маркер бактериальной инфекции при ГВЗ. CD64 активирует NADPH-оксидазу, образование активных форм кислорода, в том числе кислородный взрыв, что приводит к повышению фагоцитарной активности и запуску антителозависимой клеточной цитотоксичности НГ [23, 28].
CD32 (FcγRIIa) и CD16 (FcγRIIIb) – два низкоаффинных рецептора для связывания IgG1 и IgG3 в комплексной или агрегированной форме конститутивно экспрессируются на поверхностной мембране НГ в 100% случаев. Эти рецепторы важны для клиренса и прикрепления НГ к иммобилизованным иммунным комплексам на эндотелиальных поверхностях [29, 30]. Среди всех Fcγ только FcγRII способен связывать IgG2 человека.
CD32-рецептор имеет более низкое сродство с IgG в состоянии покоя, чем у активированных НГ. При эффективном сшивании FcγRIIa запускаются эффекторные и иммунорегуляторные функции НГ, такие как дегрануляция, продукция медиаторов воспаления и активных форм кислорода, запуск образования нейтрофильных экстрацеллюлярных сетей (NET) [23].
CD16 – низкоаффинный рецептор FcγRIIIb, который является одним из наиболее распространенных белков на поверхности НГ, причем каждая клетка экспрессирует от 100 тыс. до 200 тыс. его копий. Описан также пул внутрицитоплазматического накопления CD16 на мембранах секреторных везикул НГ, которые обеспечивают быструю мобилизацию FcγRIIIb на поверхность клетки при взаимодействии с рецептором [31]. Повышенная экспрессия CD16 на поверхностной мембране НГ свидетельствует о гиперактивации клетки, при этом сниженная экспрессия или полное отсутствие CD16 характеризуют незрелость НГ и/или обратную дифференцировку клетки, которая наблюдается при тяжелых бактериальных инфекциях или некрозах тканей. Слущивание CD16 с поверхностной цитоплазматической мембраны свойственно апоптотическим НГ. Сшивание FcγRIIa с FcγRIIIb инициирует Ca2+ и активирует сигнальные каскады, которые запускают фагоцитоз, дегрануляцию, кислородный взрыв и антителозависимую клеточную цитотоксичность, ассоциированные с CD11b/CD18-зависимым механизмом [32].
CD11b (Mac-1) – α-субъединица молекулы адгезии β2-интегрина, трансмембранный рецептор НГ для C3b-компонента комплемента. Он экспрессируется в низких количествах на мембранной поверхности НГ. Данный рецептор хранится во внутриклеточных гранулах и транслоцируется на поверхность в течение пяти минут после воздействия бактериальных антигенов, достигая пика экспрессии в течение 30 минут [33]. CD11b способствует прочному прикреплению НГ к эндотелию, что обеспечивает трансэндотелиальную миграцию в очаг воспаления. При активации НГ CD11b, связанный с сигнальными белками и цитоскелетом НГ, запускает и регулирует сигналинг, хемотаксис, адгезию, фагоцитоз, кислородный взрыв и дегрануляцию НГ. Снижение экспрессии на поверхностной цитоплазматической мембране НГ или блокада CD11b вызывают дефекты активации Fcγ-рецепторов и нарушение эффекторной и микробицидной активности НГ [23, 34].
В настоящее время назрела острая необходимость поиска новых методов ранней иммунодиагностики степени тяжести течения ГВЗ. Это должно способствовать оптимизации традиционных методов лечения с последующим уменьшением тяжести проявлений нетипично протекающих гнойно-воспалительных и гнойно-септических заболеваний, частоты послеоперационных осложнений и показателей смертности.
Цель исследования – оценить диагностическую эффективность разработанного метода дифференциальной диагностики степени тяжести гнойно-воспалительных заболеваний бактериальной этиологии.
Материал и методы
Проведены сравнительные исследования образцов периферической крови детей разного возраста с различными ГВЗ и условно здоровых детей соответствующих возрастных групп (табл. 1).
Определяли процент НГ (%НГ), одномоментно экспрессирующих рецепторы CD64, CD32, CD16, CD11b – диагностически значимых субпопуляций СD64-CD16+CD32+CD11b+ НГ и СD64+CD16+CD32+CD11b+ НГ, с использованием метода проточной цитометрии (проточный цитометр Сytomics FC-500, Веckman Coulter, США) и приема последовательного гейтирования, позволяющего на гистограммах проточного цитометра на основании наличия или отсутствия исследуемых рецепторов детектировать относительное количество субпопуляций с дальнейшим определением расчетного индекса нейтрофильных гранулоцитов (РИНГ).
Схема постановки следующая.
- В лунки плоскодонного планшета помещают по 1 мкл моноклональных антител CD64-FITC, CD32-PE, СD16-ЕCD, CD11b-PC5 и добавляют по 30 мкл крови.
- Инкубируют 12–15 минут в темноте, на шейкере, RPM – 400 оборотов в минуту, температура – 24–25 ºС.
- Проводят лизис эритроцитов и фиксацию лейкоцитов, добавляют в лунку 50 мкл OptiLyse C (Beckman Coulter, США), выдерживают 12–15 минут в темноте, температура – 24–25 ºС, затем добавляют 150 мкл дистиллированной воды на 10–15 минут для завершения лизиса эритроцитов.
- Переносят образцы в пробирки размером 12 × 75 мм, добавляют 400–500 мкл дистиллированной воды.
- Готовый образец анализируют на Cytomics FC-500 (Beckam Coulter, США) с использованием метода последовательного гейтирования.
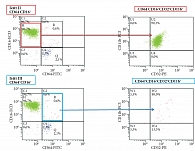
На гистограмме – прямое/боковое светорассеяние (FSC/SSC), выделяют Гейт I, который основан на морфологических характеристиках клеток и в котором локализуются гранулоциты (GRA-NG).
- Гейт I GRA-NG, в котором расположены гранулоциты.
- Из Гейта GRA-NG на двухпараметрической гистограмме CD16-ECD/CD64-FITC, загейтированной по GRA-NG, определяют %НГ, экспрессирующих только маркерные CD16-рецепторы (CD64-CD16+), и %НГ, экспрессирующих одновременно CD16- и CD64-рецепторы (CD64+CD16+). Для корректного анализа образца используют контроли: отрицательный (неокрашенные клетки) и изотипический контроль, по которым выставляют шкалы для каждого образца.
- Из Гейтов CD64-CD16+ НГ и CD64+CD16+ НГ на двухпараметрических гистограммах CD32-PE/CD11b-PC5, загейтированных по GRA-NG и CD64-CD16+ (Гейт II) и по GRA-NG и CD64+CD16+ (Гейт III), определяют количество НГ, экспрессирующих рецепторы CD32, CD11b, выявляя субпопуляции СD64-CD16+СD32+СD11b+ НГ и СD64+CD16+СD32+СD11b+ НГ (рисунок).
- Оценивают количество НГ каждой субпопуляции: % субпопуляции СD64-CD16+СD32+СD11b+ НГ и % субпопуляции СD64+CD16+СD32+СD11b+ НГ, одновременно экспрессирующих исследуемые рецепторы.
- Определяют расчетный индекс НГ – РИНГ, учитывающий величину соотношения обеих субпопуляций: % СD64-CD16+СD32+СD11b+ НГ : % СD64+CD16+СD32+СD11b+ НГ.
Патент на изобретение № 2825251 «Способ дифференциальной диагностики бактериальных и вирусных инфекционно-воспалительных заболеваний» от 22 августа 2024 г.
Помимо определения количества НГ каждой субпопуляции имеется возможность регистрации уровня экспрессии каждого мембранного рецептора НГ по значению индекса интенсивности флюоресценции.
Проведенное исследование было одобрено независимым этическим комитетом ФГБОУ ВО «Кубанский государственный медицинский университет» Минздрава России.
Статистическую обработку результатов проводили с использованием компьютерных программ Microsoft Excel 2016 и StatPlus 2010. Использовали методы непараметрической статистики: Me (Q1; Q3), U-критерий Манна – Уитни и Вилкоксона.
Различия определяли статистически значимыми при p < 0,05.
Результаты и их обсуждение
На основании многолетнего опыта нами накоплена доказательная база, свидетельствующая о том, что мембранная экспрессия НГ не только отражает процессы, происходящие в течение жизненного цикла клетки, но и позволяет оценить по организации поверхностной цитоплазматической мембраны НГ их функциональное праймирование для реализации эффекторных функций.
У условно здоровых людей в периферической крови присутствуют основная мажорная субпопуляция CD64-CD32+CD16+CD11b+ НГ (К1) и минорная субпопуляция CD64+CD32+CD16+CD11b+ НГ (К2) (табл. 2).
При ИВЗ бактериальной природы в зависимости от тяжести процесса значительно повышается содержание субпопуляции К2 на фоне снижения основной субпопуляции К1, что имеет дифференциально диагностическое значение не только для выявления бактериальных ИВЗ, но и для оценки степени тяжести инфекционного процесса (см. табл. 2).
При исследовании периферической крови у условно здоровых детей и детей с различными ГВЗ установлены общие закономерности изменения соотношения и количества изучаемых субпопуляций НГ. Было показано в разной степени снижение количества основной «сторожевой» субпопуляции НГ СD64-CD16+СD32+СD11b+ и увеличение уровня «незрелой» субпопуляции с пониженной функциональной активностью НГ СD64+CD16+СD32+СD11b+, зависящее от тяжести гнойно-воспалительного процесса.
На основании проведенных исследований и сравнительного анализа данных при бактериальных ИВЗ (сепсис, перитонит, острая деструктивная пневмония, острый гематогенный остеомиелит, гнойные заболевания мягких тканей, врожденная пневмония, неонатальный сепсис) нами был разработан новый дифференциальный диагностический маркер – расчетный индекс нейтрофильных гранулоцитов (РИНГ) (патент № 2825251 от 22 августа 2024 г.).
Цитометрически произведенная регистрация относительного содержания двух субпопуляций – % СD64-CD16+CD32+CD11b+ НГ (К1) и % СD64+CD16+CD32+CD11b+ НГ (К2) при бактериальных ИВЗ позволяет вычислить РИНГ по соотношению К1 к К2: РИНГ = К1 : К2.
Предложенный коэффициент РИНГ позволил дифференцировать наличие бактериального ИВЗ и оценить характер его течения (легкая, средняя или тяжелая степень).
При клиническом проявлении ИВЗ и значении РИНГ в интервале от 0,1 до 18,9 устанавливалась бактериальная инфекция. Если значения РИНГ находились в интервале от 0,1 до 2,9, определялось тяжелое течение бактериальной инфекции. Показатели РИНГ в интервале от 3,0 до 5,8 свидетельствовали о среднетяжелом течении бактериальной инфекции. Если значения РИНГ находились в интервале от 5,9 до 18,9, течение бактериальной инфекции характеризовалось как легкое (табл. 2 и 3).
Снижение значений РИНГ в диапазоне с 18,9 до 0,1 свидетельствует об утяжелении бактериального процесса.
Наглядно иллюстрируют информативность и диагностическую значимость РИНГ, позволяющего в короткие сроки определить степень тяжести течения бактериального процесса, следующие клинические примеры.
Клинический случай 1. Пациент В. трех лет находился на стационарном лечении в хирургическом отделении № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края.
Диагноз: острый гнойный лимфаденит в подчелюстной области слева.
Клинические проявления ИВЗ: увеличение подчелюстного лимфоузла слева до 2,5 см в диаметре с гиперемией кожи над лимфоузлом, лимфоузел болезненный при пальпации, эластичный, не спаянный с кожей, боли в шее при повороте головы влево, гипертермия до 38,2 °С, снижение аппетита, слабость, ребенок капризничает, часто плачет.
Проводилась дифференциальная диагностика инфекционно-воспалительного заболевания с клиническими проявлениями левостороннего подчелюстного лимфаденита для уточнения вирусной или бактериальной этиологии заболевания по алгоритму, описанному выше. Так, К1 – 96,4%, К2 – 5,1%. Был определен РИНГ: 96,4 : 5,1 = 18,9.
Полученное значение РИНГ находилось на верхней границе интервала 0,1–18,9, определяющего наличие бактериальной инфекции. При этом оно служит пороговым показателем в интервале 5,9–18,9 (легкое течение бактериальной инфекции). Таким образом, вычисление РИНГ позволило определить бактериальную инфекцию легкого течения.
Было проведено хирургическое лечение и назначена антибактериальная терапия. Послеоперационный период протекал без осложнений. Пациент выписан с выздоровлением. Значение РИНГ при выписке составило 74,1 и вошло в референсный интервал для здоровых детей этого возраста.
Клинический случай 2. Пациент Г. двух лет находился на стационарном лечении в хирургическом отделении № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края.
Диагноз: острый гнойный (абсцедирующий) лимфаденит подмышечной области справа.
Клиническая картина ИВЗ: пальпируется увеличенный до 3 см в диаметре и болезненный лимфоузел в подмышечной области справа, гипертермия до 38,5 °С, наличие признаков интоксикации (головная боль, вялость, слабость, снижение аппетита).
Проводилась дифференциальная диагностика инфекционно-воспалительного заболевания с клиническими проявлениями правостороннего подмышечного лимфаденита для уточнения вирусной или бактериальной этиологии заболевания по алгоритму, описанному выше. Так, К1 – 86,5%, К2 – 14,5%. Определен РИНГ: 86,5 : 14,5 = 5,9.
Значение РИНГ 5,9 попало в диапазон 0,1–18,9, определенный для диагностики бактериальной инфекции. При этом оно соответствовало нижнему порогу в интервале 5,9–18,9 (легкое течение бактериальной инфекции). Таким образом, было выявлено ИВЗ бактериальной природы легкого течения.
Ребенок получал комбинированную терапию: хирургическое лечение, антибактериальную терапию, дезинтоксикационную терапию, иммунокорригирующую терапию с использованием иммуномодулирующего препарата Имунофан®, основной действующей субстанцией которого является синтетический тимический гексапептид – аналог активного центра гормона тимуса тимопоэтина, по разработанной программе: 45 мкг/мл 1 мл внутримышечно ежедневно в течение пяти дней, на курс – пять инъекций. В послеоперационном периоде осложнений не наблюдалось.
Ребенок выписан с выздоровлением. Значение РИНГ при выписке составило 69,4, то есть находилось в референсном интервале для здоровых детей этого возраста.
Клинический случай 3. Пациентка Д. восьми лет находилась на стационарном лечении в хирургическом отделении № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края.
Диагноз: острый гематогенный остеомиелит дистального метадиафиза правой бедренной кости.
Клинические проявления ИВЗ: при поступлении в стационар на четвертый день от начала заболевания у пациентки наблюдалось острое начало после короткого продромального периода, гипертермия до 39,7–40,0 °С, нарастающий интоксикационный синдром, боли распирающего характера в пораженной нижней конечности, максимально выраженные над очагом воспаления, и вынужденное положение конечности. Лабораторно отмечался высокий уровень СРБ – 60 мг/л. Гнойно-воспалительный процесс локализовался в дистальном метадиафизе правой бедренной кости.
Проводилась дифференциальная диагностика инфекционно-воспалительного заболевания с клиническими проявлениями ОГО по степени тяжести заболевания по алгоритму, описанному выше. Так, К1 – 87,6%, К2 – 15,1%. Значение РИНГ составило 5,8 (87,6 : 15,1).
Следует отметить, что значение РИНГ 5,8 вписывалось в диапазон 0,1–18,9, характерный для бактериальной инфекции, и явилось пороговым в интервале 3,0–5,8 (среднетяжелое течение бактериальной инфекции).
У пациентки была верифицирована бактериальная инфекция среднетяжелого течения.
Ребенок получал хирургическое пособие, комбинированную антибактериальную терапию, дезинтоксикационную терапию. Кроме того, он получал иммуномодулирующую терапию с использованием препарата Имунофан® по следующей программе: 45 мкг/мл 1 мл внутримышечно ежедневно в течение трех дней, далее – три инъекции через каждые 48 часов, далее – ежедневно в течение четырех дней, на курс – десять инъекций. Комплексное лечение сопровождалось позитивными клиническими эффектами и восстановлением иммунологических показателей. Местный гнойно-воспалительный процесс купировался на шестые сутки. Восстановление функции в пораженной конечности произошло на 14-е сутки. Отсутствовали ранние послеоперационные осложнения. Значение РИНГ при выписке составило 75,8, то есть находилось в референсном интервале для условно здоровых детей этой возрастной группы.
Клинический случай 4. Пациент К. десяти лет находился на лечении в хирургическом отделении № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края.
Диагноз: острый гематогенный остеомиелит костей, составляющих левый тазобедренный сустав.
Клинические проявления ИВЗ: на 14-й день от начала заболевания наблюдались гипертермия 38,0–38,5 °С, умеренный интоксикационный сидром, боль и ограничение движений в левом тазобедренном суставе. Уровень СРБ был резко повышен – 174 мг/л.
Проводилась дифференциальная диагностика инфекционно-воспалительного заболевания с клиническими проявлениями ОГО по степени тяжести по алгоритму, описанному выше.
При проведении исследования значение К1 составило 75,0%, К2 – 25,0%. Определен РИНГ: 75,0 : 25,0 = 3,0.
Полученный результат вошел в диапазон РИНГ 0,1–18,9, определенный для диагностики бактериальной инфекции. При этом он находился в интервале 3,0–5,8 (среднетяжелое течение бактериальной инфекции), что позволило верифицировать бактериальную инфекцию среднетяжелого течения.
Ребенок получал комплексное лечение: хирургическое пособие, комбинированную антибактериальную терапию, дезинтоксикационную терапию, препараты, влияющие на систему гемостаза, иммуномодулирующую терапию, включавшую применение препарата Имунофан® по следующей схеме: 45 мкг/мл 1 мл внутримышечно ежедневно в течение трех дней, далее – три инъекции через каждые 48 часов, далее – ежедневно в течение четырех дней, на курс – десять инъекций. Наблюдался позитивный клинический эффект и восстановление иммунологических показателей. Местный гнойно-воспалительный процесс (отек, гиперемия, отделяемое из послеоперационной раны) купировался на 21-е сутки. Отсутствовали ранние послеоперационные осложнения. Показатель РИНГ при выписке составил 61,3, что не вошло в референсный интервал, характерный для условно здоровых детей этой возрастной группы (84,8–99,0).
В дальнейшем после выписки из стационара пациент проходил восстановительное лечение на амбулаторном этапе. Восстановление функции тазобедренного сустава произошло на 40-е сутки.
Клинический случай 5. Пациентка М. двух лет находилась на стационарном лечении в хирургическом отделении № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края.
Диагноз: острая левосторонняя деструктивная полисегментарная пневмония, дыхательная недостаточность второй степени.
Клинические проявления ИВЗ: в течение пяти дней отмечались повышение температуры до 38,7 °С, кашель малопродуктивный, одышка, слабость. Рентгенографически – признаки левосторонней деструктивной полисегментарной пневмонии.
Проводилась дифференциальная диагностика инфекционно-воспалительного заболевания с клиническими проявлениями острой деструктивной пневмонии по степени тяжести бактериального процесса по алгоритму, описанному выше. Получены значения: К1 – 76,0%, К2 – 26,0%. При этом значение РИНГ составило 2,9 (76,0 : 26,0). Оно попало в диапазон 0,1–18,9, характерный для наличия бактериальной инфекции, и соответствовало тяжелому течению бактериальной инфекции, для которого принят интервал РИНГ от 0,1 до 2,9. Лабораторно также была верифицирована бактериальная инфекция тяжелого течения.
Ребенок получал хирургическое пособие (дренирование очагов деструкции легочной ткани), комбинированную антибактериальную терапию, дезинтоксикационную терапию, коррекцию гемостаза, симптоматическую терапию, иммуномодулирующую терапию иммунотропным препаратом Имунофан®: 45 мкг/мл 1 мл внутримышечно ежедневно в течение пяти дней, далее – три инъекции через каждые 48 часов, на курс – восемь инъекций. На фоне комплексного лечения отмечались регресс гнойно-воспалительного очага в легких, санация респираторного тракта с улучшением эвакуации мокроты, купирование дыхательной недостаточности и интоксикационного синдрома. Исход заболевания – выздоровление. Показатель РИНГ при выписке – 58,3, что вошло в референсный интервал, характерный для условно здоровых детей этой возрастной группы.
Клинический случай 6. Пациент К. четырех лет находился на лечении в хирургическом отделении № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края.
Диагноз: абдоминальный сепсис, острый гангренозно-перфоративный аппендицит, периаппендикулярный абсцесс, отграниченный гнойный перитонит, септическая пневмония.
Клинические проявления ИВЗ: болен в течение одной недели, когда появились интенсивные боли в правой подвздошной области, сопровождающиеся тошнотой и неоднократной рвотой, не приносящей облегчения, гипертермия до 39,0–39,5 °С, проявления интоксикации (мраморность кожных покровов, слабость, адинамия), кашель, нарастающие симптомы дыхательной недостаточности до второй степени.
Дифференциальная диагностика инфекционно-воспалительного заболевания с оценкой степени тяжести бактериального процесса проводилась по алгоритму, описанному выше. Так, К1 – 10,0%, К2 – 90,0%. РИНГ оказался равным 0,1 (10,0 : 90,0), то есть его значения вошли в диапазон 0,1–18,9, что характерно для бактериальной инфекции. При этом показатель находился в интервале 0,1–2,9, что свидетельствовало о тяжелом течении бактериальной инфекции. Это позволило верифицировать бактериальную инфекцию крайне тяжелого течения, более тяжелого, чем в примере 5.
Ребенок получал хирургическое лечение, проведена коррекция антибактериальной терапии с применением трех антибиотиков из группы резерва, использовалась также дезинтоксикационная терапия, коррекция электролитного баланса, гемостаза, гемодинамических нарушений, противогрибковая терапия, симптоматическая терапия. С учетом выявленных при исследовании комбинированных нарушений иммунной системы пациенту была проведена комбинированная иммунокорригирующая терапия, включавшая три инфузии внутривенных иммуноглобулинов препарата Габриглобин® из расчета 0,8 г/кг массы тела, через три дня был введен препарат Имунофан® в режиме: 45 мкг/мл 1 мл внутримышечно ежедневно в течение пяти дней, далее – пять инъекций через каждые 48 часов, на курс – десять инъекций. На фоне комплексного лечения отмечались клиническое улучшение, регресс септического процесса, нормализация лабораторных и иммунологических показателей. Ребенок выписан из стационара на 50-е сутки с выздоровлением и рекомендациями дальнейшего наблюдения у педиатра, детского хирурга и иммунолога в поликлинике по месту жительства.
Следует отметить, что при выписке пациента значение РИНГ составило 70,8, что соответствовало референсным значениям, характерным для условно здоровых детей двух – четырех лет.
Заключение
Нами изучена и продемонстрирована, в том числе на клинических примерах, диагностическая значимость разработанного нами метода дифференциальной диагностики тяжести течения гнойно-воспалительных заболеваний у детей, основанного на определении количества (%) функционально значимых субпопуляций СD64-CD16+СD32+СD11b+ НГ и СD64+CD16+СD32+СD11b+ НГ с дальнейшей оценкой РИНГ. Определены референсные интервалы индекса, характерные для условно здоровых детей разных возрастных групп. Показано значимое различие значений РИНГ при оценке разных ГВЗ бактериальной этиологии разной степени тяжести у детей. Разработаны референсные интервалы, характерные для бактериальной инфекции легкого, среднетяжелого и тяжелого течения у детей разных возрастных групп. Определение количества (%) функционально значимых субпопуляций СD64-CD16+СD32+СD11b+ НГ и СD64+CD16+СD32+СD11b+ НГ с оценкой РИНГ также может быть использовано для мониторирования течения ГВЗ с оценкой не только тяжести состояния пациента, но и прогнозирования исхода заболевания.
Следует подчеркнуть, что предложенный нами подход к анализу лабораторных показателей, оценивающих динамику соотношения диагностически значимых субпопуляций НГ с расчетом РИНГ, может быть использован при проведении ранней дифференциальной диагностики бактериальных и вирусных инфекций с дальнейшей оценкой степени тяжести бактериальных инфекционно-воспалительных процессов (патент на изобретение № 2825251 «Способ дифференциальной диагностики бактериальных и вирусных инфекционно-воспалительных заболеваний» от 22 августа 2024 г.). В первую очередь это необходимо для своевременной оптимизации лечения пациентов с ИВЗ, особенно при тяжелых ГВЗ, заключающейся в раннем назначении адекватного этиопатогенетического лечебного комплекса. Кроме того, проведение ранней дифференциальной диагностики будет способствовать достижению более быстрой клинической эффективности на фоне своевременной оптимизации лечения различных по тяжести ГВЗ.
Финансирование
Исследование выполнено в рамках гранта
«Приоритет 2030 – КубГМУ» № 1240022900096-3.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
I.V. Nesterova, MD, PhD, Prof., G.A. Chudilova, DBS, L.V. Lomtatidze, PhD, S.V. Kovaleva, MD, PhD, V.N. Chapurina, PhD, Yu.V. Teterin
Kuban State Medical University
Peoples' Friendship University named after Patrice Lumumba
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
Currently, in order to optimize traditional treatment methods, there is an urgent need to search for new methods of early immunodiagnostics of the severity of bacterial infectious and inflammatory diseases (IID).
Aim studies – to evaluate the diagnostic effectiveness of the developed method of differential diagnosis of the severity of purulent inflammatory diseases of bacterial etiology.
Material and methods. A clinical and immunological study of 170 children with purulent inflammatory diseases of varying severity and 73 healthy children was conducted. The examination included determination in peripheral blood the number of subsets of neutrophil granulocytes (NG) expressing surface membrane receptors CD64, CD16, CD32, CD11b, with a content rating of subsets of CD64-CD16+CD32+CD11b+NG, CD64+CD16+CD32+CD11b+NG by sequential gating using a Cytomics FC-500 flow cytometer and calculating the index of differential diagnosis – the calculated index of neutrophilic granulocytes (CING).
Results. For the differential diagnosis of the severity of bacterial IID, a CING is proposed, which is calculated by the ratio of the content of two functionally significant subsets of NG responsible for the implementation of the effector functions of NG (phagocytosis, formation of reactive oxygen species, antibody-dependent cellular cytotoxicity, triggering the formation of neutrophil extracellular traps): CING = K1 : K2, where K1 is CD64-CD16+CD32+CD11b+ NG% and K2 is CD64+CD16+CD32+CD11b+ NG%. With a CING equal to 0,1–18,9 bacterial IID is determined, and with a CING value in the range of 0,1–2,9, a severe course of bacterial infections is diagnosed, with a CING in the range of 3,0–5,8 – moderate, and with a CING in the range of 5,9–18,9 – a mild course of bacterial IID.
Conclusion. Our approach to the use of laboratory indicators evaluating the dynamics of the ratio of diagnostically significant subsets of NG allowed us to expand the possibilities of early differential diagnosis according to the severity of bacterial IID, which optimizes the diagnostic process and, in turn, will contribute to the timely and adequate appointment of an etiopathogenetic treatment complex for various bacterial IID with faster positive clinical efficacy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.