Streptococcus pneumoniae: оценка количественных и качественных свойств в трехлетней динамике с учетом ответа возбудителя на спирамицин
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Исследование проводилось на базе многопрофильного стационара неотложной помощи Омска с дополнительным анализом данных, полученных из Новосибирска. Дизайн исследования включал ретроспективный анализ структуры респираторных патогенов за период 2004–2024 гг. и проспективную оценку чувствительности S. pneumoniae к антимикробным препаратам. Основными объектами исследования стали 169 изолятов S. pneumoniae, выделенных из мокроты пациентов в 2024 г. Чувствительность оценивалась диско-диффузионным методом. Полученные показатели сравнивали с данными мультицентрового исследования Status praesens, охватившего 16 городов России.
Результаты. Доля S. pneumoniae в структуре респираторных патогенов составила 14,10% в 2022 г., 10,50% в 2023 г. и 8,68% в 2024 г., что соответствовало прогнозным значениям с погрешностью ±2,38%. Чувствительность к бета-лактамам (цефтриаксон, карбапенемы), фторхинолонам и анти-MRSA-препаратам (ванкомицин, линезолид) оставалась высокой. Для спирамицина медиана диаметра зоны торможения в Омске составила 24 мм (n = 75), в Новосибирске – 29,5 мм (n = 52), что свидетельствует о высокой потенциальной эффективности препарата. Данные согласуются с результатами исследования Status praesens.
Выводы. Исследование подтверждает целесообразность использования бета-лактамных антибиотиков (цефтриаксон, карбапенемы) в качестве терапии первой линии при внебольничной пневмонии, фторхинолонов – при аллергии или подозрении на наличие атипичных возбудителей. Продемонстрирована высокая эффективность спирамицина. Препарат безопасен для беременных и детей, не вызывает нефро- и хондротоксичности. Полученные данные расширяют возможности выбора антимикробной терапии с учетом профиля безопасности и антибиотикорезистентности.
Материал и методы. Исследование проводилось на базе многопрофильного стационара неотложной помощи Омска с дополнительным анализом данных, полученных из Новосибирска. Дизайн исследования включал ретроспективный анализ структуры респираторных патогенов за период 2004–2024 гг. и проспективную оценку чувствительности S. pneumoniae к антимикробным препаратам. Основными объектами исследования стали 169 изолятов S. pneumoniae, выделенных из мокроты пациентов в 2024 г. Чувствительность оценивалась диско-диффузионным методом. Полученные показатели сравнивали с данными мультицентрового исследования Status praesens, охватившего 16 городов России.
Результаты. Доля S. pneumoniae в структуре респираторных патогенов составила 14,10% в 2022 г., 10,50% в 2023 г. и 8,68% в 2024 г., что соответствовало прогнозным значениям с погрешностью ±2,38%. Чувствительность к бета-лактамам (цефтриаксон, карбапенемы), фторхинолонам и анти-MRSA-препаратам (ванкомицин, линезолид) оставалась высокой. Для спирамицина медиана диаметра зоны торможения в Омске составила 24 мм (n = 75), в Новосибирске – 29,5 мм (n = 52), что свидетельствует о высокой потенциальной эффективности препарата. Данные согласуются с результатами исследования Status praesens.
Выводы. Исследование подтверждает целесообразность использования бета-лактамных антибиотиков (цефтриаксон, карбапенемы) в качестве терапии первой линии при внебольничной пневмонии, фторхинолонов – при аллергии или подозрении на наличие атипичных возбудителей. Продемонстрирована высокая эффективность спирамицина. Препарат безопасен для беременных и детей, не вызывает нефро- и хондротоксичности. Полученные данные расширяют возможности выбора антимикробной терапии с учетом профиля безопасности и антибиотикорезистентности.


Введение
Основным возбудителем внебольничной пневмонии является Streptococcus pneumoniae [1], чувствительность которого к противомикробным средствам, применяемым эмпирически в качестве препаратов первой линии, во многом определяет течение и исход заболевания. Широкое использование противомикробных препаратов во время пандемии новой коронавирусной инфекции 2019–2022 гг. могло существенно повлиять на качественные свойства S. pneumoniae [2–5], особенно в отношении бета-лактамных антибиотиков, макролидов и респираторных фторхинолонов. Эти противомикробные средства чаще всего назначают при внебольничной пневмонии. Сказанное в большей степени касается препаратов двух последних групп с учетом их влияния на внутриклеточных возбудителей, доля которых в структуре возбудителей внебольничной пневмонии может достигать 40% [6]. Особый интерес представляют исследования чувствительности S. pneumoniae к 16-членному макролиду спирамицину. Это связано с частым и не всегда обоснованным применением 15-членного макролида азитромицина [7], отсутствием рутинной практики исследования чувствительности S. pneumoniae к макролидам в многопрофильных стационарах, работающих в режиме неотложной помощи, а также необходимостью актуализировать сведения о противомикробном потенциале спирамицина на текущий момент на территории РФ. Результаты применения стандартного диско-диффузионного метода для оценки качественных свойств S. pneumoniae важно сравнить с данными исследования, полученными методом серийных разведений в лаборатории МАКМАХ Смоленска [8].
Цель – оценить количественные и качественные свойства S. pneumoniae в трехлетней динамике с учетом ответа возбудителя на спирамицин.
Задачи исследования:
- сравнить реальную долю S. pneumoniae в структуре респираторных патогенов за последние три года с расчетными величинами его долей по данным интервального прогнозирования;
- оценить качественные свойства S. pneumoniae в динамике (с 2022 по 2024 г.) с демонстрацией его чувствительности к спирамицину по данным 2024 г.;
- сравнить данные, полученные в ходе оценки качественных свойств S. pneumoniae в отношении спирамицина, в медицинских организациях Омска и Новосибирска на основании результатов настоящего исследования и опубликованных данных российского исследования Status praesens in vitro.
Материал и методы
Исследование проведено на базе больницы скорой медицинской помощи, рассчитанной на 660 коек, оказывающей неотложную медицинскую помощь жителям Омска. Дополнительно качественные свойства S. pneumoniae в отношении спирамицина изучали за аналогичный период (2024) в Новосибирске. Бактериологическое исследование мокроты осуществляли стандартным диско-диффузионным методом [9]. Эпидемиологический контроль над респираторными патогенами выполняли пассивным способом на среднем уровне, предполагающим исследование мокроты у госпитализированных пациентов в определенный промежуток времени (за год) на протяжении 2004–2024 гг. Для оценки качественных свойств микроорганизмов использовали метод построения гистограмм с использованием прикладного пакета компьютерных программ Statistica 10 [1]. Для удобства сравнения результатов акцент делали на среднем значении диаметра зоны торможения роста тестируемых колоний микроорганизма (d) под воздействием исследуемого препарата, а также медиане (М), нижнем (V25) и верхнем квартилях (V75), свидетельствующих о 50%-ной частоте встречаемости признака, 25 и 75% соответственно. Результаты чувствительности интерпретировали в соответствии с российскими рекомендациями «Определение чувствительности микроорганизмов к антимикробным препаратам», версия 2024-02 [10]. Статистическим методом строили интервальный прогноз доли S. pneumoniae в этиологической структуре респираторных патогенов на основании непрерывного 14-летнего наблюдения. Для построения интервального прогноза качественных свойств S. pneumoniae из совокупности статистических параметров выбирали среднее значение диаметра зоны торможения роста колоний цефтриаксоном, рифампицином, ванкомицином, линезолидом, левофлоксацином, моксифлоксацином, имипенемом/циластатином, меропенемом, в 2024 г. – спирамицином как наиболее часто применяемыми у госпитализированных пациентов с пневмонией средствами этиотропной терапии.
Результаты
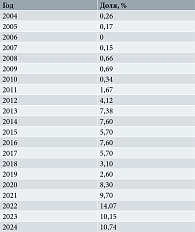
На основании изучения структуры респираторных патогенов на базе БУЗОО «Городская клиническая больница скорой медицинской помощи № 1» на протяжении длительного периода времени (2004–2021 гг.) стало возможным построение интервального прогноза с выявлением потенциальной доли S. pneumoniae на ближайшие три года (табл. 1, рисунок).
Согласно результатам прогнозирования, в 2022 г. потенциальная доля S. pneumoniae составила 14,07%, в 2023 г. – 10,15%, в 2024 г. – 10,74% с ошибкой прогноза ±2,38%. Важным доказательством эффективности применения интервального прогнозирования для создания больничного формуляра противомикробных средств и протоколов стартовой эмпирической антибактериальной терапии является соотношение прогнозных долей возбудителей и реально полученных впоследствии значений. Так, в 2022 г. прогнозное значение доли S. pneumoniae составило 14,07 ± 2,38%, реальное – 14,10%, в 2023 г. – 10,15 ± 2,38 и 10,50% соответственно, в 2024 г. – 10,74 ± 2,38 и 8,68% соответственно (табл. 2).
В структуре респираторных патогенов многопрофильного стационара, оказывающего преимущественно неотложную хирургическую помощь и не располагающего пульмонологическим отделением, а значит, не имеющего большого потока пациентов с внебольничной пневмонией, лидирующее положение занимает Klebsiella pneumoniae. На ее долю в 2024 г. пришлось 42,27%. При этом наименьшей доля лидера была в 2016 г. – 25,2%. Показатель 2014 г. (42%) практически совпал со значением 2024 г. (табл. 2).
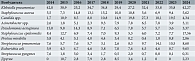
С учетом цели исследования проанализированы качественные свойства S. pneumoniae относительно зон торможения роста в 2024 г. методом построения гистограмм [1]. Установлено, что цефтриаксон, несмотря на широчайшее использование в эмпирической терапии внебольничной пневмонии, особенно в период пандемии новой коронавирусной инфекции [5, 8, 11], сохранил высокую потенциальную эффективность в отношении S. pneumoniae. Так, в 2024 г. на основании изучения 169 образцов мокроты получены следующие показатели: d = 23,91 мм, M = 24 мм, V25 = 23 мм, V75 = 26 мм при контрольном значении 20 мм (табл. 3).
Еще более убедительны в плане потенциальной эффективности карбапенемы, вызывающие интерес в аспекте старта лечения внебольничной пневмонии тяжелого течения. Показатели гистограммы в отношении имипенема/циластатина, изученного 28 раз, оказались равными: d = 24,29 мм, M = 24 мм, V25 = 23 мм, V75 = 25,5 мм при контрольном значении 20 мм. По меропенему при количестве исследований 31 получены следующие показатели: d = 23,65 мм, M = 24 мм, V25 = 23 мм, V75 = 26 мм при том же контрольном значении (табл. 3). При этом в трехлетней динамике значимого снижения чувствительности S. pneumoniae к бета-лактамным антибиотикам не наблюдалось. В 2022 г. по отношению к цефтриаксону (239 исследованных случаев) показатели составили: d = 24,22 мм, M = 24 мм, V25 = 23 мм, V75 = 26 мм (табл. 3).
Традиционно в рутинной клинической практике изучается чувствительность представителей грамположительной флоры к респираторным фторхинолонам. Это важно для пациентов с непереносимостью бета-лактамных антибиотиков или при подозрении на наличие в качестве возбудителя заболевания внутриклеточных, атипичных возбудителей [5, 7]. В настоящем исследовании показатели чувствительности S. pneumoniae в отношении левофлоксацина, изученного 94 раза, составили: d = 23,15 мм, M = 25,5 мм, V25 = 23 мм, V75 = 27 мм при контрольном значении чувствительности 50 мм и чувствительности при увеличенной экспозиции ≥ 16 мм. В отношении моксифлоксацина, протестированного 67 раз, показатели гистограммы выглядели так: d = 24,99 мм, M = 25 мм, V25 = 23 мм, V75 = 27 мм при контрольном значении 22 мм (табл. 3). В нашем исследовании не выявлено существенного изменения чувствительности изолятов S. pneumoniae к респираторному фторхинолону левофлоксацину и респираторному фторхинолону с антианаэробной активностью моксифлоксацину. При оценке чувствительности к левофлоксацину, протестированному 104 раза, в 2022 г. установлено, что d = 23,97 мм, M = 24 мм, V25 = 23 мм, V75 = 25 мм. Аналогичные показатели к моксифлоксацину, исследованному 109 раз, составили: d = 24,68 мм, M = 25 мм, V25 = 24 мм, V75 = 26 мм (табл. 3).
Кроме того, колонии S. pneumoniae изучали на чувствительность к препаратам, стратегически важным в отношении MRSA. Так, в 73 случаях показатели гистограммы по линезолиду были такими: d = 28,70 мм, M = 30 мм, V25 = 28 мм, V75 = 30 мм при контрольном значении 22 мм. По ванкомицину (19 случаев) определены следующие значения: d = 23,53 мм, M = 24 мм, V25 = 20 мм, V75 = 25 мм при контрольном значении 16 мм. По рифампицину, исследованному 87 раз, данные составили: d = 26,02 мм, M = 25 мм, V25 = 24 мм, V75 = 30 мм при контрольном значении 22 мм (табл. 3). Такими же чувствительными к MRSA-активным препаратам были колонии S. pneumoniae в 2022 г. Например, показатели чувствительности к ванкомицину анализировали 42 раза: d = 21,86 мм, M = 20 мм, V25 = 20 мм, V75 = 24 мм при контрольном значении 16 мм. Линезолид анализировали в 42 случаях: d = 27,60 мм, M = 27,50 мм, V25 = 26 мм, V75 = 30 мм при контрольном значении 22 мм, рифампицин – в 239 случаях: d = 21 мм, M = 25 мм, V25 = 24 мм, V75 = 27 мм при контрольном значении 22 мм (табл. 3).
Из-за противопоказаний к применению фторхинолонов у беременных и детей до 18 лет, потенциальной токсичности [7] важно помнить о возможности назначения макролидных антибиотиков пациентам с внебольничной пневмонией.
Особый интерес вызывает определение чувствительности S. pneumoniae к спирамицину, 16-членному макролиду. Последняя информация о его чувствительности датирована концом 1990-х гг. [12]. В настоящем исследовании установлено, что в 2024 г. на 75 изолятах S. pneumoniae показатели гистограммы составили: d = 23,26 мм, M = 24 мм, V25 = 23 мм, V75 = 27 мм. В аналогичном исследовании 52 образцов мокроты, проведенном в Новосибирске, получены следующие значения: d = 25,5 мм, M = 29,5 мм, V25 = 19 мм, V75 = 32 мм (табл. 3). Мы столкнулись с трудностями интерпретации результатов исследования чувствительности S. pneumoniae к спирамицину, поскольку в данный момент официально критерии интерпретации отсутствуют [8]. Для оценки эффективности спирамицина к S. pneumoniae мы руководствовались критериями чувствительности Французского общества микробиологов 2013 г. (Ч ≥ 24 мм, Р < 19 мм) [13]. Исходя из этого, и омские, и новосибирские результаты свидетельствуют о высокой потенциальной эффективности спирамицина в случае его выбора в качестве этиотропного средства при внебольничной пневмонии.
Данные чувствительности S. pneumoniae, полученные в ходе всероссийского мультицентрового исследования Status praesens (2024), продемонстрировали высокую, хотя и меньшую чувствительность S. pneumoniae к спирамицину. Важно, что 200 изолятов колоний в исследовании Status praesens получены в 16 городах России, но Омск и Новосибирск в этом исследовании не были задействованы. Образцы включали материал, полученный из мокроты, среднего уха и синусов (в нашем исследовании – только мокроты). Кроме того, во всероссийском исследовании чувствительность к спирамицину уточняли дополнительно по оценке изолятов S. pneumoniae, устойчивых к эритромицину, полученных за период с 2010 по 2022 г. И самое главное: исследования проводили методом серийных микроразведений в бульоне в соответствии с рекомендациями EUCAST-2024 и стандартом ИСО 20776-1 [14, 15]. Несмотря на дефиниции формата исследований, в обоих случаях диапазон потенциальной чувствительности S. pneumoniae к спирамицину находится в пределах 75,5–100%.
Обсуждение
Крайне важно микробиологическое подтверждение высокой потенциальной эффективности спирамицина. Спектр действия макролидных антибиотиков в отличие от респираторных фторхинолонов не распространяется на грамотрицательные возбудители, представителей кишечной индигенной микрофлоры человека, что исключает возникновение антибиотик-ассоциированной диареи, гипомагниемии (в отличие от моксифлоксацина) и предопределяет большую безопасность спирамицина в отношении негативного влияния на интервал QT [12, 16]. Кроме того, спирамицин, как и другие макролиды, безопасен в отношении суставов и связочного аппарата. Спирамицин не обладает какой-либо значимой гепатотоксичностью. В отличие от антибиотиков цефалоспоринового ряда, особенно третьего поколения, спирамицин не демонстрирует нефротоксичности, так как характеризуется преимущественно печеночной элиминацией. Важно, что макролиды, согласно клиническим рекомендациям Минздрава России [7], назначаются пациентам с внебольничной пневмонией не только вместо бета-лактамных антибиотиков, в случае аллергической реакции на них, но и вместе с ними, если предполагается, что возможные возбудители респираторной инфекции относятся к атипичным, внутриклеточно локализованным бактериям (Chlamydia pneumoniae, C. trachomatis, Mycoplasma pneumoniae, Legionella spp.). В крупных населенных пунктах (свыше 1 млн жителей) доля респираторных патогенов атипичной локализации может достигать 40% [6].
Следует подчеркнуть, что показания к применению спирамицина не ограничиваются внебольничной пневмонией. Спирамицин может назначаться и при других стрептококковых процессах, включая острый синусит, острый и хронический фарингит, острый и хронический тонзиллит, рожистое воспаление [12].
Cпирамицин активен в отношении стафилококка, включая пенициллинорезистентный (PRSA), гемофильной палочки, что позволяет рекомендовать препарат больным острым бронхитом после перенесенных острых респираторных вирусных инфекций, при обострении хронического бронхита, для профилактики генерализованной инфекции при заболеваниях периодонта и инфекциях костно-мышечной системы [12]. При идентификации индуцибельных метилаз как детерминантов резистентности S. aureus к 14-членным макролидам (эритромицин, кларитромицин) сохраняется эффективность 16-членных препаратов, к которым относится и спирамицин [8].
Безусловно, имеет значение постантибиотическое действие спирамицина и его проникновение в фагоциты, что активизирует хемотаксическую функцию полиморфноядерных лейкоцитов и опосредует иммуномодулирующее влияние [12].
Спирамицин можно назначать беременным, в том числе для лечения токсоплазмоза [17].
В структуре респираторных патогенов больных, находящихся на лечении в стационаре неотложной медицинской помощи, в 2022, 2023 и 2024 гг. на долю S. pneumoniae приходилось 14,10, 10,50 и 8,68% соответственно, что совпадает с прогнозными значениями в пределах допустимой статистической погрешности.
Оценка качественных свойств S. pneumoniae показала высокую, сохранившуюся неизменной в период 2022–2024 гг. чувствительность в отношении цефтриаксона, имипенема/циластатина, меропенема, ванкомицина, линезолида, рифампицина, левофлоксацина (при увеличенной экспозиции) и моксифлоксацина. По результатам оценки чувствительности изолятов S. pneumoniae, полученных из мокроты рутинным диско-диффузионным методом в условиях реальной клинической практики Омска и Новосибирска, к спирамицину установлена его высокая потенциальная эффективность в лечении пациентов с внебольничной пневмонией. Полученные данные не противоречат результатам многоцентрового российского исследования Status praesens по оценке качественных свойств S. pneumoniae [8], а расширяют их за счет еще двух регионов России.
Заключение
Результаты изучения качественных свойств S. pneumoniae подтверждают целесообразность назначения бета-лактамных антибиотиков в качестве средства первого выбора эмпирической терапии при внебольничной пневмонии, цефтриаксона – при средней степени тяжести и карбапенемов – при тяжелом течении заболевания. При необходимости дополнительного назначения противомикробных средств, воздействующих на атипичных возбудителей, и/или при наличии аллергической реакции на бета-лактамные антибиотики с высокой вероятностью эффективности может применяться респираторный фторхинолон левофлоксацин или респираторный фторхинолон с антианаэробной активностью моксифлоксацин. Впервые за последние 25 лет показана высокая потенциальная эффективность 16-членного макролида спирамицина, который в отличие от фторхинолонов можно назначать беременным и детям. Спирамицин характеризуется лучшим профилем безопасности в отношении потенциального удлинения интервала QT, отсутствием риска нефро-, гепато-, хондро- и артротоксичности. Следует отметить, что с 2021 г. на российском фармацевтическом рынке доступен спирамицин под торговым названием Дорамитцин ВМ (3 000 000 МЕ), что повышает доступность данного класса антибиотиков при необходимости клинического применения.
Авторы заявляют об отсутствии конфликтов интересов.
S.G. Fominykh, PhD, Assoc. Prof., L.Ye. Krainova, A.V. Lokhmacheva, PhD, Assoc. Prof.
Omsk State Medical University
Municipal Clinical Hospital of Emergency Medical Care No. 1, Omsk
Novosibirsk State Regional Clinical Hospital
Contact person: Alena V. Lokhmacheva, asaltuk@mail.ru
The aim is to evaluate the quantitative and qualitative properties of Streptococcus pneumoniae over a three-year period, taking into account the response of the pathogen to spiramycin.
Material and methods. The study was conducted in a multidisciplinary hospital in Omsk, with additional analysis of data from Novosibirsk. A retrospective analysis of respiratory pathogen structure from 2004 to 2024 was performed, as well as a prospective assessment of S. pneumoniae sensitivity to antimicrobial drugs. The main objects of the study were 169 S. pneumoniae isolates from patient sputum in 2024. Sensitivity was assessed using the disc diffusion method and compared with data from the multicenter ‘Status praesens’ study, which covered 16 cities of Russia.
Results. The share of S. pneumoniae in the respiratory pathogens structure was 14.10% in 2022, 10.50% in 2023, and 8.68% in 2024, corresponding to the forecast values within ±2.38% error. Sensitivity to β-lactams (ceftriaxone, carbapenems), fluoroquinolones and anti-MRSA agents (vancomycin, linezolid) remained high. For spiramycin, the median diameter of the zone of of inhibition zone in Omsk amounted to 24 mm (n = 75), in Novosibirsk – 29.5 mm (n = 52), which indicates a high potential efficiency. The data are consistent with results of the study ‘Status praesens’.
Conclusions. The study confirms the usefulness of beta-lactam antibiotics (ceftriaxone and carbapenems) for the initial treatment of community-acquired pneumonia and fluoroquinolones in cases of allergies or suspected atypical pathogens. Spiramycin has shown high efficacy and is safe for use in pregnant women and children, without causing nephrotoxicity or chondrotoxicity. These findings expand the options for antimicrobial therapy, considering both safety and antibiotic resistance profiles.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.