Световая гигиена, биологические ритмы и нарушения сна
- Аннотация
- Статья
- Ссылки
- English
Циркадная световая гигиена и световое загрязнение: значение и масштаб проблемы
Свет является ключевым фактором для поддержания соответствия циркадных биологических часов условиям окружающей среды и адаптации к естественным сезонным изменениям [1, 2]. 24-часовой цикл «свет – темнота» – ключевой фактор, обеспечивающий синхронный ход биологических часов и достаточно высокую циркадную амплитуду физиологических процессов.
Недавние исследования, в том числе проспективные с использованием многотысячных баз данных актиграфии, убедительно показали, что не столько средние величины, сколько главным образом амплитуда и фаза циркадных ритмов служат маркерами ключевых аспектов здоровья, в частности заболеваемости, смертности и продолжительности жизни [3–5]. Таким образом, подтвержден обоснованный нами ранее тезис о циркадной амплитуде как универсальном маркере количества здоровья [6, 7].
Циркадная световая гигиена (ЦСГ) позволяет регулировать воздействие света на организм человека для поддержания естественного цикла «сон – бодрствование» и циркадных ритмов и имеет определяющее значение для здоровья. К нарушениям ЦСГ, влекущим за собой последствия для здоровья человека в целом и сна в частности, относятся:
- световое загрязнение, или избыточное воздействие света в вечернее и ночное время;
- дефицит дневного света;
- нерегулярность световых условий.
Чтобы полностью понять роль этих нарушений, их следует рассматривать во взаимосвязи.
В современном обществе широко распространены и, как правило, взаимосвязаны ключевые проблемы ЦСГ – световое загрязнение (СЗ, избыточное воздействие вечернего искусственного света) [1, 8] и дефицит солнечного света в утренние и дневные часы [2]. Обе проблемы вносят существенный вклад в снижение циркадной амплитуды, фазовые нарушения биологических часов, способствуют развитию десинхроноза и не утрачивают актуальности сегодня [1, 2, 9]. Эти проблемы усугубляются в условиях высоких широт, где ярко выражены сезонные особенности фотопериодизма [10], и в странах, где сохранена активно критикуемая практика сезонного перевода времени [11].
Влияние циркадной световой гигиены и светового загрязнения на биологические ритмы и здоровье человека
Естественный цикл смены света и темноты был доминирующим стимулом существования биологических часов и драйвером генетической обусловленности циркадных ритмов на протяжении эволюции человека. Естественные фотопериодические условия и сегодня влияют на способность к адаптации, синхронную работу биологических часов, качество сна и состояние здоровья, что особенно заметно в условиях высоких широт, где уровень освещения и соотношение световой и темновой фаз в течение 24 часов резко меняются в зависимости от сезона [10].
Однако искусственный свет коренным образом перестроил деятельность человека. В результате увеличилась освещенность в ночное время на фоне резкого снижения воздействия естественного дневного света прежде всего у городских жителей – офисных работников. Таким образом, за последние десятилетия произошло резкое уменьшение динамического диапазона освещения между дневным и ночным временем, что повлекло за собой комплекс негативных последствий для здоровья человека [1, 2, 8].
Исследования также показали различие в значении для здоровья таких свойств света, как интенсивность, регулярность и спектральный состав. Воздействие света тесно связано с регуляцией режима сна и бодрствования, активностью и режимом питания, температурой тела, энергетическим обменом и динамическим балансом гормонов. Польза света для здоровья в значительной степени зависит от фазы циркадного ритма и снижается с раннего утра до позднего вечера [2]. В определенные часы преимущества дневного света сменяются опасным для здоровья воздействием ночного освещения (LAN) [1, 2, 8, 10]. Местоположение такого поворотного момента в течение суток может зависеть от генетических факторов биологических часов, которые отчасти определяют хронотип и привычную фазу сна человека. Роль играют также количество и временные рамки воздействия солнечного света, которые меняются в течение года.
Принципиальное значение для понимания противоположных (в зависимости от фазы суток) биологических эффектов света имеют кривые фазового ответа (КФО). В зависимости от физических свойств (интенсивность и спектр) свет в разное время суток оказывает разнонаправленное воздействие на внутренние биологические часы организма, изменяя фазу циркадных ритмов [12, 13]. Воздействие света утром помогает проснуться раньше и легче, чувствовать себя бодрее в течение дня, что также способствует переводу внутренних часов на более раннее время. Воздействие света в вечернее время, напротив, сдвигает внутренние часы на более позднее время, вызывая желание ложиться спать и пробуждаться позднее. Дневное освещение в середине дня в меньшей степени влияет на ход внутренних циркадных часов, но может повышать бдительность и когнитивные функции. Кроме того, естественный свет, содержащий ультрафиолетовое излучение, способствует продукции витамина D, который, вероятно, также имеет отношение к синхронизации биологических часов. Достаточное количество дневного света, например, в летних лагерях ускоряет циркадную фазу, тогда как ночное уличное освещение, даже за окнами, коррелирует со склонностью к вечернему хронотипу. Более выраженным в плане силы воздействия на фазу и амплитуду циркадных часов может быть сочетание дневного света с регулярной по времени физической активностью [1]. Понимание КФО важно для регулирования времени сна и бодрствования. Сказанное в большей степени касается людей, страдающих от смены часовых поясов или работающих посменно. Контролируя время пребывания на свету, легче адаптировать график сна в соответствии с образом жизни. Время воздействия и физические свойства света имеют определяющее значение на сон и здоровье [1]. В целом утренний и дневной свет полезен, он усиливает синхронность работы биологических часов и амплитуды циркадных ритмов [13]. Ночной свет связан с циркадным рассогласованием и вреден для здоровья.
Значительная часть городского населения подвержена хроническому дефициту дневного света [1, 2]. Это влечет за собой последствия как для сна, так и для психического и соматического здоровья. Хорошо известна польза дневного света для психического здоровья [1, 2]. Свет влияет на настроение и процесс обучения преимущественно через специфические меланопсиновые ганглиозные клетки сетчатки. При этом одна часть светочувствительных клеток, будучи связанной с внутренними часами мозга, помогает в обучении, другая, имея проекцию в недавно открытую область мозга, отвечающую за контроль настроения, регулирует его [14]. Неудивительно, что уровень депрессии, например, при оценке по шкале Бека связан как с дефицитом дневного света, так и с более поздним хронотипом с учетом того, что дефицит дневного и избыток вечернего света ассоциируются с вечерним хронотипом. Более того, утрата воспринимающих свет ганглиозных клеток сетчатки при развитии глаукомы тесно взаимосвязана с ростом уровня депрессии по шкале Бека [15].
Воздействие дневного света увеличивает продолжительность сна, вероятно, за счет сдвига засыпания на более ранние часы [1, 12, 13].
Экспериментальные исследования показывают, что дневной свет влияет на соотношение продолжительности фаз сна и бодрствования, что опосредовано воздействием на циркадные ритмы [16]. Исследователи, использовавшие носимые датчики света в комплексе со смартфоном, обнаружили, что изменения в освещенности влияют на скорость и время засыпания. Более высокая освещенность перед сном увеличивала задержку наступления сна, в то время как более яркий свет после пробуждения уменьшал утреннюю сонливость. Кроме того, воздействие естественного и динамического искусственного синего света повышало бдительность, концентрацию внимания и когнитивные способности.
Свет важен не только для биологических часов, настроения и качества сна, но и для регулирования метаболических процессов в организме, таких как баланс глюкозы и выработка тепла. Исходя из результатов недавних исследований, было высказано предположение, что свет влияет на эти процессы не только через сон и циркадные ритмы [17]. Свет влияет на обмен веществ различными путями, включая мозговые цепи и прямую стимуляцию тканей, участвующих в обмене веществ. Сбои в работе этой системы, часто из-за нерегулярного воздействия света, например при ночной смене или искусственном освещении, могут способствовать нарушению обмена веществ [17]. Утреннее воздействие яркого света приводит к уменьшению жировых отложений и снижает аппетит у женщин с избыточным весом [18]. Освещенность, превышающая порог 500 люкс в дневное время, приводит к снижению массы тела независимо от времени сна, его продолжительности и общей активности у взрослых. Примечательно, что существуют значительные индивидуальные различия в метаболических реакциях на свет и рассогласовании циркадных ритмов в зависимости от времени его воздействия на организм и светочувствительности, модулируемой генетическими факторами, полом и возрастом. Чувствительность к свету у людей может отличаться в 50 раз. Это связано с комплексом малоизученных генетических факторов, отличных от тех, которые определяют хронотип, циркадную фазу и внутренний период биологических часов. Утрата воспринимающих свет ганглиозных клеток сетчатки также сопряжена с нарушениями суточной динамики метаболизма липидов [19].
Дневной свет играет важную роль в обеспечении адекватного статуса витамина D. В свою очередь витамин D прямо или косвенно участвует как в регуляции сна, так и в метаболизме. Рецепторы витамина D и ферменты, которые контролируют их активацию и расщепление, экспрессируются в нескольких областях мозга, участвующих в регуляции сна [20]. Обладая множеством сходных с мелатонином свойств, витамин D опосредованно влияет на выработку мелатонина и, вероятно, синхронизацию циркадных ритмов. Рецепторы витамина D присутствуют в областях мозга, участвующих в регуляции сна, и влияют на экспрессию генов, вовлеченных в регуляцию сна, и циркадных ритмов. В частности, витамин D помогает поддерживать гомеостаз кальция, который важен для синтеза нейромедиаторов, участвующих в процессе сна. Регулируя иммунные реакции, витамин D может уменьшать воспаление, что косвенно влияет на качество сна и выработку мелатонина. Достаточный уровень витамина D способен поднимать настроение и уменьшать симптомы депрессии, что способствует улучшению сна и регуляции выработки мелатонина [20].
Масштабное американское исследование (n = 25 534) показало, что уровень витамина D ассоциируется с избыточной продолжительностью сна, но не напрямую, а при условии недостаточного пребывания на солнце. Сочетание данного фактора со снижением уровня витамина D связано с чрезмерной продолжительностью сна (≥ 10 часов), что подчеркивает важность дневного света для взаимосвязи между уровнем витамина D и здоровым сном [21]. К схожим выводам пришли исследователи из Бразилии: в исследовании с участием 1709 человек сочетание дефицита дневного света и витамина D сопровождалось снижением качества сна по данным Питтсбургского опросника [22].
Факторы нарушения сна при неадекватной световой гигиене и световом загрязнении
Биологическая роль вечернего и ночного света, в том числе влияние на сон, тесно связана с его физическими свойствами (интенсивность, спектр), продолжительностью и регулярностью воздействия [1, 2]. Результаты метаанализа семи научных работ (данные 577 932 пациентов) позволили сделать вывод, что ночной свет приводит к дозозависимому увеличению проблем со сном в среднем на 22%, причем воздействие света от источников в помещении оказывает более негативное воздействие, чем свет, поступающий с улицы. Проблемы со сном усиливаются при освещенности выше 5,8 нВТ/см2/ср [23]. Более высокие уровни коротковолнового света в ночное время связаны с усугублением нарушений сна преимущественно за счет снижения уровня мелатонина. Несмотря на низкий общий уровень освещенности, распространенность нарушений сна составляет 34,7%. При этом в группах, подвергающихся более высокому воздействию, значительно чаще возникают проблемы со сном, а уровень мелатонина снижается [24]. Высокая освещенность во время сна связана с более поздним пробуждением, более низкой эффективностью сна и более фрагментарным сном. Однако воздействие света не влияет на продолжительность сна, возможно, из-за компенсации за счет более позднего пробуждения. У молодых лиц сдвиг биологических часов на более поздние часы (склонность к хронотипу совы) наблюдается при меньшей амплитуде цикла «свет – темнота», при этом дневное освещение меньше, а ночное – больше. Наблюдается и более поздняя циркадная фаза, измеряемая по выработке мелатонина при слабом освещении (DLMO).
В ходе исследования, проведенного среди одних и тех же жителей Арктики в разные сезоны, установлено, что изменения параметров фазы сна тесно связаны с изменениями амплитуды и фазы ритма мелатонина и следуют за амплитудно-фазовыми особенностями фотопериодических условий того или иного времени года. Во время зимнего солнцестояния люди ложились спать и просыпались позже, чем в дни весеннего равноденствия, но общая продолжительность сна оставалась неизменной. В дни летнего солнцестояния время отхода ко сну сдвигалось на более поздние часы. Кроме того, у жителей Арктики на фоне более низкой световой гигиены отмечались неблагоприятные изменения метаболических показателей (прежде всего триглицеридов, липопротеинов высокой плотности и их соотношения) как посезонно, так и при перекрестном сравнении лиц с разными условиями световой гигиены [10].
Примечательно, что некоторые люди чувствительны и к очень тусклому синему свету. Это позволяет предположить, что даже слабое излучение синего света имеет последствия для циркадной системы и здоровья. В частности, выраженная реакция на ночной свет зафиксирована у носителей аллеля G гена мелатониновых рецепторов MTNR1B rs10830963 [10]. Влияние времени воздействия света на метаболическое здоровье в течение 24 часов может быть эффективно смоделировано синусоидальной функцией, поскольку наряду с КФО для света и мелатонина описаны также КФО для липидов и печеночных белков [25].
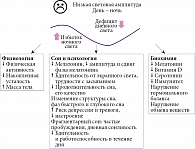
Факторы нарушения сна при неадекватной световой гигиене представлены на рис. 1. Принципиальным фактором воздействия ночного света на сон, циркадные ритмы, гормональный баланс и метаболическое здоровье является подавление секреции мелатонина. При снижении ночного уровня мелатонина естественный сигнал организма к подготовке ко сну ослабевает, что приводит к задержке наступления сна. Свет в неподходящее время сдвигает фазу биологических часов, провоцируя дальнейшие нарушения естественного цикла смены дня и ночи, поскольку изменяются привычки самоуправления временем использования источников искусственного света. Воздействие света ночью может привести к задержке циркадной фазы: внутренние часы переключаются на более поздний режим в соответствии с КФО. Такое смещение приводит к трудностям при засыпании, поддержании сна, ночным пробуждениям и неэффективности сна. Нерегулярное воздействие света ассоциируется с утратой синхронизации внутренних часов организма с внешней средой, десинхронозом. Способность света, особенно синего, источниками которого, в частности, являются экраны гаджетов, к повышению бдительности и когнитивной активности противодействует естественному стремлению ко сну. При нарушении циркадных, а также специфических для процесса сна ультрадианных ритмов изменяется соотношение фаз быстрого и глубокого сна, что приводит к снижению восстановительного эффекта сна. Воздействие света ночью может способствовать более частым пробуждениям, снижать общее качество сна и вызывать его фрагментацию [26]. Длительные нарушения и хроническое недосыпание негативно сказываются на физическом и психическом здоровье, приводя к расстройствам настроения, например депрессии и тревожности, а также когнитивным нарушениям, таким как проблемы с памятью и снижение концентрации внимания.
Световое загрязнение и риск хронических заболеваний
Нарушенный сон влияет на обмен веществ, увеличивая риск ожирения, диабета и сердечно-сосудистых заболеваний. Ночной свет ассоциируется с неблагоприятными метаболическими изменениями, увеличением веса, риском диабета и гипертензии [10, 27, 28].
В ходе восьмилетнего проспективного исследования с участием 84 790 пациентов установлено, что более высокая освещенность в ночное время повышает риск развития диабета, причем риск возрастает и у тех, у кого амплитуда циркадного ритма смоделированного светового воздействия ниже или его фаза нерегулярна [28]. Лица с определенным генотипом, например носители полиморфизма гена рецептора мелатонина MTNR1B, могут быть более восприимчивы к воздействию света в течение определенного вечернего временного окна [10]. Свет непосредственно, независимо от уровня активности, увеличивает артериальное давление в ночные часы [29]. Воздействие света во время сна приводит к нерегулярному началу сна и демонстрирует двунаправленную связь с избытком ночного света в последующие дни и отклонениями во времени сна в будущем [26]. Кроме того, свет в ночное время – фактор риска ряда онкологических заболеваний [8].
Принципиальным фактором, который важен для здоровья, качества сна и хорошего самочувствия, является амплитуда световой сигнализации в течение 24 часов, или динамический диапазон между дневным и ночным освещением [2, 28]. Принципиально, что утренний и дневной свет способствует достижению достаточно высоких амплитуд циркадных ритмов, тогда как ночной снижает циркадные амплитуды, нивелируя, в частности, хронобиотические эффекты мелатонина. Анализ больших баз, включая данные Британского биобанка и данные Национального обследования состояния здоровья и питания NHANES США, показал, что циркадная амплитуда служит предиктором долголетия [4], тогда как ее снижение – маркером заболеваемости и смертности от большинства ведущих нозологий [3, 5]. Таким образом, очевидно значение амплитуды световой среды для здоровья человека.
Регулярность светового воздействия. Менее регулярные с позиций циркадных биологических часов условия световой гигиены сопряжены со снижением настроения [14] и нерегулярностью сна. В свою очередь нерегулярный режим сна и бодрствования коррелирует с более высоким риском смертности [30]. Вероятно, это объясняется тем, что нерегулярный световой сигнал также ослабляет амплитуду циркадных ритмов, способствуя снижению устойчивости циркадной системы к десинхронозу.
В целом последствия неудовлетворительного циркадного режима световой гигиены сопряжены с комплексом неблагоприятных для здоровья последствий (рис. 1).
Говоря о значении и интерпретации информации о суточной динамике полученного света, тесно связанного с динамикой мелатонина и уровня физической активности, принципиально подчеркнуть, что для каждого из этих показателей наиболее информативны и клинически значимы положение фазы и величина амплитуды, но не средний уровень или сопоставление с условной «нормой» в отдельно взятый момент времени.
Как оптимизировать циркадную световую гигиену и бороться с негативными эффектами светового загрязнения
Стратегии смягчения последствий СЗ должны быть нацелены на управление вечерним освещением с минимизацией синего света в вечерние и ночные часы [2, 10]. В отличие от физической активности отрезки времени, представляющие особый интерес с точки зрения физиологических эффектов света, могут находиться за пределами периодов максимальных и минимальных значений (например, M10/L5, которые широко используются при анализе суточных ритмов двигательной активности), скорее в переходных точках, которые находятся в некотором промежутке между ними. Именно поэтому для оценки световой нагрузки могут быть использованы специальные, более информативные методы расчета вечерней световой нагрузки [10].
Целесообразно использовать приглушенный свет теплых тонов, чтобы свести к минимуму воздействие синего света. Создание полностью темной, прохладной и тихой обстановки в спальне способствует улучшению качества сна и облегчает естественный процесс засыпания. При необходимости использования экрана рекомендуется фильтрация синего света на устройствах либо применение очков, блокирующих синий свет. В старших возрастных группах и у лиц с возрастными патологиями оправданно применение малых доз мелатонина [31] в определенное время [9], которые в зависимости от индивидуальных особенностей и сути проблемы рассчитывает специалист в области хронобиологии.
Не менее важно, особенно для лиц старше 40 лет, соблюдать режим дня, отходить ко сну в одно и то же время ежедневно, в том числе в выходные. Поддержание регулярного времени сна и бодрствования помогает обеспечить стабильность циркадного ритма. Предположительно наиболее эффективной стратегией профилактики десинхроноза и обеспечения здоровья биологических часов является оптимизация ЦСГ, которая сама по себе может способствовать подстройке хода биологических часов, фазы циркадных ритмов, а также режима и качества сна. Стратегия оптимизации ЦСГ предполагает регулярное, достаточно продолжительное (> 90 минут) пребывание при естественном дневном солнечном свете, регулярную физическую активность на свежем воздухе, обеспечение оптимальных с точки зрения интенсивности и цветовой температуры источников искусственного света в домашних условиях и на рабочих местах. В регионах, где сезонные особенности фотопериодизма не могут обеспечить адекватный дневной свет, особенно актуально внедрение систем «умного света» – биодинамического, или антропоцентрического, освещения [32]. В перспективе экономически оправдан индивидуальный подбор световых режимов и графиков труда в зависимости от возраста, генов риска, хронотипа и световой чувствительности (рис. 2).
Фармакологические подходы к коррекции нарушений сна
Циркадианный десинхроноз считается одной из потенциальных причин развития нарушений сна. Другие причины связаны с воздействием острого или хронического стресса. До 30% людей в общей популяции в течение года испытывают расстройства, подпадающие под критерии острой инсомнии [33]. Диагноз этого заболевания устанавливают при нарушении собственно сна (трудности засыпания, частые пробуждения, ранние утренние пробуждения), дневного бодрствования и достаточных условий (адекватные время и место) для сна. Частота «плохих» ночей должна составлять три и более в неделю, а продолжительность этого состояния не превышать трех месяцев.
Нарушения сна при острой инсомнии часто развиваются на фоне избыточной церебральной гиперактивации (hyperarousal), вызванной воздействием стрессового фактора. До 10% случаев такого состояния в дальнейшем переходят в постоянную форму, создавая картину хронической инсомнии продолжительностью более трех месяцев. В качестве основных патогенетических факторов развития хронической инсомнии рассматриваются неадаптивное поведение и дисфункциональные убеждения в отношении сна, которые поддерживают избыточное внимание пациента к проблемам сна.
В лечении острой инсомнии приоритет имеют поведенческие техники совладания со стрессом и снотворные препараты различной природы. ГАМКергические средства повышают сродство ГАМК-А-рецептора к ГАМК посредством его модификации. Подобный эффект оказывают бензодиазепиновые производные, такие как диазепам, клоназепам, бромдигидрохлорфенилбензодиазепин, и небензодиазепиновые аналоги (так называемые Z-препараты зопиклон, золпидем, залеплон). Другим подходом считается применение блокаторов мощных активирующих мозговых систем – гистаминергической и орексинергической. Антагонисты центральных H1-рецепторов дифенгидрамин и доксиламин активно применяют для достижения снотворного и седативного эффектов при нарушении сна.
Одним из доступных в РФ препаратов доксиламина является Валокордин®-Доксиламин («Кревель Мойзельбах ГмбХ», Германия). Активное вещество в данной лекарственной форме находится в жидком виде, что позволяет гибко дозировать препарат в зависимости от возраста и ожидаемого клинического эффекта. Валокордин®-Доксиламин назначается для симптоматической терапии нарушений сна пациентам старше 18 лет на срок до 14 дней. Возможность гибкого дозирования также позволяет использовать эту лекарственную форму при зависимости от приема снотворных с помощью замены этим препаратом с его постепенной отменой. Особенностью применения доксиламина является также возможность назначения при нарушениях сна во время беременности [34]. Другой блокатор активирующей системы – антагонист орексиновых рецепторов суворексант одобрен к применению в качестве снотворного в 2014 г., однако в РФ в настоящее время не зарегистрирован.
В лечении хронической инсомнии преимущество имеют психологические и поведенческие техники. Методом выбора является когнитивно-поведенческая терапия инсомнии (КПТ-И). В рамках программы КПТ-И, проводимой в течение 6–8 недель, формируются правильные поведенческие привычки, связанные со сном, и меняются негативные ассоциации (дисфункциональные убеждения). Лекарственная терапия при хронической инсомнии применяется для коррекции коморбидных нарушений (тревоги и депрессии). Допустима практика периодического приема снотворных препаратов по потребности в периоды утяжеления нарушений сна.
Заключение
Учитывая важность поддержания естественных биологических ритмов для обеспечения здорового сна человека, соблюдение световой гигиены должно рассматриваться как одно из важнейших составляющих правил гигиены сна. Коррекция развившихся нарушений сна проводится с использованием как медикаментозных (агонисты рецепторов ГАМК или антагонисты гистаминовых рецепторов), так и немедикаментозных методов.
Публикация подготовлена при поддержке «Кревель Мойзельбах ГмбХ» (Krewel-Meuselbach GmbH, Германия).
D.G. Gubin, MD, Prof., M.G. Poluektov, PhD, Assoc. Prof.
Tyumen State Medical University
I.M. Sechenov First Moscow State Medical University
Contact person: Denis G. Gubin, dgubin@mail.ru
This review underscores the vital importance of the dynamic range of light exposure in sleep physiology, emphasizing the critical role of circadian light hygiene in human health. The paper demonstrates how light hygiene optimizes sleep, wakefulness, and circadian biological clock function, while also influencing metabolic health. Furthermore, it examines the factors that contribute to sleep disturbances and circadian disruption when light hygiene is inadequate and hazards of LAN (Light-At-Night). The review also explores non-pharmacological approaches to correct circadian disruptions as a consequence of compromised light hygiene, as well as pharmacological methods for addressing sleep disorders.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.