Атопический дерматит (АтД) – хроническое рецидивирующее воспалительное заболевание кожи различной степени тяжести, сопровождающееся постоянным, часто мучительным, зудом, снижением качества жизни. Кроме того, заболевание опасно своими социально-психологическими последствиями.
АтД развивается на фоне генетически детерминированных нарушений барьерной функции кожи и особенностей врожденного и адаптивного иммунитета под воздействием многочисленных неспецифических триггерных факторов. Существует большое разнообразие клинических форм АтД: лихеноидный, эритематозно-сквамозный, пруригинозный, экссудативный и т.д. Кроме того, в зависимости от наличия или отсутствия повышения уровня иммуноглобулина E (IgE) в крови выделяют экзогенный (IgE+) и эндогенный (IgE-) АтД. В зависимости от возраста пациента АтД подразделяют на младенческий (от 2 месяцев до 2 лет), детский (от 2 лет до полового созревания) и подростковый/взрослый (после полового созревания). «Внутренние механизмы АтД настолько сложны, что заболевание тяжело поддается излечению, при отсутствии специфической терапии требует новых патогенетических лечебных подходов», – отметил д.м.н., профессор Николай Георгиевич КОЧЕРГИН (кафедра кожных и венерических болезней Первого Московского государственного медицинского университета им. И.М. Сеченова).
Основная клинически значимая проблема при АтД – зуд. Степень выраженности зуда при АтД по 100%-ной шкале достигает 62–79%. В очагах поражения он наиболее мучительный: 84% больных не могут уснуть, а 80% просыпаются от него. Жара и пот усиливают зуд1–5. В силу особенностей задействованных при АтД гистаминовых рецепторов (H4) и других механизмов зуд не отвечает на антигистаминную терапию традиционными H1-ингибиторами рецепторов гистамина, за что получил определение «неподатливый». Зудящий характер дерматоза и другие симптомы воздействуют на психику больного, нарушая социальную адаптацию, семейную жизнь и даже вызывая суицидальные мысли. Они возникают у больных АтД при тяжелых обострениях в 20% случаев6.
Несмотря на значительное снижение качества жизни, более 50% больных АтД имеют плохую приверженность лечению, что приводит к отказам от него, особенно при длительной проактивной терапии7. Одна из существенных причин – наличие у пациентов стероидной фобии, связанной с боязнью побочных эффектов. Согласно результатам исследований, 81% больных испытывают беспокойство по поводу глюкокортикостероидной терапии, 36% от нее отказываются вовсе8. Плохая приверженность объясняется также отсутствием доверия к врачу, недостаточной эффективностью лечения, высокой стоимостью и сложностью терапевтических мероприятий. Решением подобных проблем могут стать более частые визиты пациентов к врачу, более четкие терапевтические инструкции, беседы о заболевании9.
В лечении атопического дерматита высоконадежными (уровни доказательности А и В) считаются фототерапия, терапия циклоспорином А, наружными ГКС и ингибиторами кальциневрина – такролимусом и пимекролимусом, а также увлажняющими и ожиряющими средствами10.
Перспективным средством, по мнению профессора Н.Г. Кочергина, представляется такролимус, нестероидный противовоспалительный препарат для наружной терапии среднетяжелого и тяжелого АтД, относящийся к группе природных макролидов. Препарат оказывает избирательное иммуносупрессивное действие. Впервые он был выделен в Японии в 1984 г. из почвенных бактерий Streptomyces tsukubaensis. Такролимус подавляет активацию Т-лимфоцитов, транскрипцию генов интерлейкина 2 (ИЛ-2) и экспрессию рецепторов к ИЛ-2, ингибирует транскрипцию генов провоспалительных цитокинов (ИЛ-3, ИЛ-4, ИЛ-13, гранулоцитарно-макрофагальный колониестимулирующий фактор, фактор некроза опухоли альфа), активирует экспрессию гена трансформирующего фактора роста бета-1, уменьшает экспрессию высокоаффинных рецепторов IgE на профессиональных антиген-презентирующих клетках, снижает активность клеток Лангерганса, предупреждает дегрануляцию тучных клеток и базофилов.
В международной клинической практике такролимус для топического применения используется свыше десяти лет, на отечественном фармацевтическом рынке появился более двух лет назад под торговым названием Протопик. Препарат выпускается в виде мази в двух концентрациях – 0,03% (для детей с 2 лет и взрослых) и 0,1% (только для взрослых старше 16 лет).
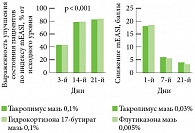
В ходе многочисленных клинических исследований с участием взрослых и детей11, 12 показано, что эффективность Протопика (оценивали с помощью mEASI, modied Eczema Area and Severity Index – индекс распространенности и тяжести экземы) эквивалентна таковой сильных топических ГКС (рис. 1).
При сопоставимой эффективности с ГКС Протопик не обладает побочными эффектами, характерными для ГКС; он не только не вызывает атрофию кожи, но, напротив, приводит к восстановлению синтеза коллагена и эпидермального барьера13. Мазь такролимус не влияет на синтез коллагена. После лечения такролимусом средние показатели маркеров экспрессии коллагена приближались к 100% (не отличались от плацебо), тогда как при использовании сильного фторированного стероида (бетаметазона валерата) эти показатели уменьшались до 5 раз относительно нормальных значений14. В отличие от ГКС Протопик можно наносить на кожу век и периорбитальную область.
Такролимус (Протопик) может применяться с профилактической целью: назначение препарата 2 раза в неделю предупреждает обострение АтД у пациентов разного возраста15, 16. Плацебоконтролируемое исследование CONTROL по эффективности и безопасности поддерживающей терапии АтД мазью Протопик 0,1% (взрослые)17 и 0,03% (дети)16 по схеме 2 раза в неделю в течение 12 месяцев показало достоверно значимое снижение количества обострений на фоне терапии Протопиком (рис. 2).
Как показало многоцентровое рандомизированное исследование CONTROL, при проведении поддерживающей (проактивной) терапии Протопиком по схеме 2 раза в неделю количество пациентов без обострений в течение года возрастает в 3 раза. Среднее время до наступления очередного обострения в группе поддерживающей терапии Протопиком составило 142 дня, в то время как в группе контроля – 15 дней (р < 0,001 при нанесении 2 раза в неделю в течение 12 месяцев по сравнению с лечением только в период обострений)18. «Благодаря такому действию при длительном применении препарата мы можем предупреждать или держать субклиническое воспаление на таком уровне, при котором не будет развиваться обострение», – заметил профессор Н.Г. Кочергин. В этой связи, согласно данным Европейского агентства лекарственных средств (European Medicines Agency), Протопик показан в качестве поддерживающей терапии среднетяжелого и тяжелого АтД для предупреждения обострений и пролонгирования ремиссий у больных с частыми обострениями (более 4 раз в год) в случае, если его применение у данных пациентов по схеме два раза в день было успешным (для достижения успеха терапии потребовалось не более шести недель19).
Данные исследований также подтверждают хороший профиль безопасности мази такролимус при ее использовании на протяжении 4 лет20, 21.
Такролимус способен оказывать опосредованное антимикробное действие: восстанавливая барьерную функцию кожных покровов, он уменьшает их обсемененность золотистым стафилококком.
Крайне низкая системная абсорбция не позволяет препарату проникать в кровоток в значимых количествах. Это происходит из-за того, что молекула такролимуса в 2 раза больше молекулы стероида. В самом начале терапии такролимус за счет купирования воспаления восстанавливает нарушенную барьерную функцию, после чего его способность к пенетрации уменьшается сообразно улучшению барьерной функции.
Накоплена достаточно большая отечественная доказательная база по эффективности и безопасности мази Протопик при лечении АтД. Эффективность Протопика в профилактике и лечении АтД была доказана в ходе российских исследований22–25. В частности, исследование А.В. Самцова и соавт.26 показало, что Протопик высокоэффективен в лечении среднетяжелого и тяжелого АтД. На фоне терапии 0,1%-ной мазью Протопик 2 раза в день в течение 28 дней клиническое выздоровление и значительное улучшение отмечались у 86% больных АтД. Уже на 7-й день лечения регистрировалось выраженное и быстрое снижение индекса SCORAD (SCORing Atopic Dermatitis, комплексная оценка симптомов и проявлений атопического дерматита) – к 14-му дню в 2 раза, а к 28-му дню – в 5 раз. Переносимость и косметическую приемлемость Протопика 76% пациентов оценили как отличные, 17% – как хорошие.
Результаты исследования А.Л. Бакулева и соавт.27 продемонстрировали, что такролимус (Протопик), как и метилпреднизолона ацепонат (МПА), эффективно устраняет острые симптомы атопического дерматита, но в отличие от МПА не вызывает нарастания явлений атрофии кожи.
Профессор Н.Г. Кочергин представил данные собственного исследования эффективности мази такролимус (Протопик) 0,1% у 42 больных АтД средней и тяжелой степени. Мазь Протопик применяли как в виде монотерапии, так и в комбинации с другими средствами. Протопик наносили на очаги поражения 2 раза в день до исчезновения симптомов АтД. Терапию проводили при тщательном динамическом контроле ее эффективности и безопасности с применением индексов SCORAD, ДИШС (дерматологический индекс шкалы симптомов) и ДИКЖ (дерматологический индекс качества жизни). Оценка динамики клинических индексов к концу трехнедельного курса лечения показала, что у подавляющего большинства больных были достигнуты клиническая ремиссия и значительное улучшение – общая редукция показателей от исходного уровня превысила 75% (рис. 3).
В настоящее время в большинстве исследований не обнаружено взаимосвязи между применением топических ингибиторов кальциневрина и повышением риска развития новообразований у больных с АтД, в том числе лимфом. В частности, отсутствие подобной взаимосвязи продемонстрировано по данным крупного международного исследования «случай – контроль», в котором участвовало свыше 293 тыс. пациентов с АтД28.
В первые 2–3 дня применения мази такролимус могут возникнуть незначительные нежелательные явления – жжение и гиперемия, которые постепенно регрессируют в течение первых дней терапии. Не рекомендуется смешивать мазь такролимус (Протопик) с другой мазью, особенно содержащей воду.
«Терапия мазью Протопик считается новым подходом к длительному контролю атопического дерматита у взрослых и детей с двухлетнего возраста», – констатировал профессор Н.Г. Кочергин. В заключение он представил схемы лечения больных АтД мазью Протопик:
- лечение обострений:
- у детей: 0,03%-ная мазь 2 раза в день в течение 3 недель, затем 1 раз в день до полного исчезновения симптомов;
- у взрослых: 0,1%-ная мазь 2 раза в день до полного очищения кожи и исчезновения симптомов обострения, по мере улучшения состояния уменьшить кратность приема до 1 раза в день;
- поддерживающая терапия у пациентов с частыми обострениями (свыше 4 эпизодов в год):
- у детей: 0,03%-ная мазь 2 раза в неделю (например, понедельник и четверг) 1 раз вечером в течение года;
- у взрослых: 0,1%-ная мазь 2 раза в неделю (например, понедельник и четверг) 1 раз вечером в течение года.
Такролимус в лечении дерматозов
Как отметила в начале выступления д.м.н., профессор Ольга Юрьевна ОЛИСОВА (кафедра кожных и венерических болезней Первого Московского государственного медицинского университета им. И.М. Сеченова), такролимус занимает высокие позиции в клинической практике врачей-дерматологов. Хотя единственным официально зарегистрированным показанием к терапии мазью такролимус является АтД, накоплен значительный массив клинических данных по ее применению при таких дерматозах, как псориаз, себорейный дерматит, витилиго, красный плоский лишай, актиническое пруриго, розацеа, гангренозная пиодермия, контактный дерматит.
Псориаз, которым в России болеют 3,5 млн человек, – одна из самых распространенных причин обращения к дерматологу. Достаточно проанализировать «псориатический спектр эмоций» больных, чтобы понять, что, несмотря на разнообразие лечебных методов, 90% пациентов испытывают разочарование в лечении и хотели бы использовать новые методы, а 87% живут в постоянном ожидании ухудшения состояния. Большинство пациентов, страдающих псориазом, испытывают ощущение общего дискомфорта (81%) и собственной непривлекательности (75%), а более половины страдают от депрессии. Но больше всего тревожит тот факт, что 10% больных псориазом предпринимают попытки суицида.
Препаратами первой линии терапии псориаза с высоким уровнем доказательности считаются наружные ГКС. Стероидная фобия, отмечаемая у больных псориазом, мешает врачу проводить полноценное лечение. 75% пациентов или их родителей испытывают беспокойство в отношении ГКС. Наиболее частой причиной их тревоги являются боязнь истончения кожи (35%), отдаленных побочных эффектов (24%), нарушение роста и развития у детей из-за системной абсорбции (10%). Подобные опасения приводят к нарушению пациентами режима применения ГКС. В такой ситуации могут помочь новые препараты с эффективностью, сопоставимой с эффективностью ГКС, но без присущих последним побочных эффектов, например такролимус29–31.
«У нас в клинике ведется большая научно-исследовательская работа по оценке применения такролимуса при ограниченных формах псориаза. С ее результатами скоро можно будет ознакомиться. Вместе с тем уже имеющиеся данные ряда зарубежных и отечественных исследований эффективности препарата позволяют рекомендовать такролимус (Протопик) мазь 0,1% в качестве местной терапии при ограниченных формах псориаза, особенно при поражении лица и интертригинозных зон», – констатировала профессор О.Ю. Олисова.
Не менее актуальной проблемой современной дерматологии является розацеа. Это заболевание по распространенности занимает 7-е место среди кожных заболеваний и отмечается у 8–9% жителей нашей страны, причем у женщин несколько чаще, чем у мужчин. По статистике, дебют заболевания приходится на возраст 40–50 лет. Однако в последнее время специалисты все чаще сталкиваются с заболеваемостью розацеа у подростков и даже у детей. Розацеа считается полиэтиологическим заболеванием, развитию которого способствует множество факторов. Наиболее значимый из них – фактор роста сосудистого эндотелия (VEGF, vascular endothelial growth factor). Этот цитокин обладает выраженными вазодилатирующими свойствами, в 50 тыс. раз активнее гистамина. Он выступает в роли мощного провокатора повышения проницаемости и вазодилатации сосудов. VEGF увеличивает продукцию фермента матричной металлопротеазы, что приводит к деградации волокон, поддерживающих кровеносные сосуды, к атонии стенок и повышению хрупкости сосудов. Применение глюкокортикостероидных мазей, особенно фторированных, в случаях, когда у пациента имеет место поверхностное расположение обширной сети артериальных сосудов, наличие достаточно широких устьев фолликулов сальных желез, способно привести к трансформации обычной формы розацеа в так называемую стероидную форму, сложно поддающуюся лечению. В подобной ситуации выраженный клинический эффект дает терапия ингибиторами кальциневрина, в частности такролимусом (Протопиком)32, 33.
Длительное применение такролимуса у больных розацеа способствует активному снижению уровня фактора роста сосудистого эндотелия до нормы, что подтверждают результаты собственного исследования О.Ю. Олисовой: «Мы изучали уровень VEGF в сыворотке крови у больных розацеа на фоне терапии такролимусом. Если изначально у основной группы больных уровень VEGF был существенно повышен, то после лечения мазью такролимус в течение месяца практически приблизился к норме. Это очень хорошие результаты, и мы можем смело рекомендовать данный препарат тем пациентам, которые устойчивы к различным видам терапии».
Еще одно сложное для лечения заболевание – витилиго. По данным Всемирной организации здравоохранения, число больных витилиго в мире составляет 2% от численности всего населения, а в южных странах и регионах достигает 4%. Часто заболевание начинается в раннем детском возрасте и приводит к серьезным психоэмоциональным нарушениям. Дерматологический индекс качества жизни низкий – 4,95, что значительно меньше ДИКЖ даже при распространенном вульгарном псориазе (6,26). Больные витилиго зачастую вынуждены вести уединенный образ жизни, особенно если высыпания локализуются на открытых участках тела и на лице. При этом заболевании применяют фототерапию, системную и местную терапию, хирургические методы. Одними из самых эффективных методов лечения витилиго считаются хирургические методы, узкополосная УФО-терапия и местная терапия сильными ГКС или такролимусом (Протопиком) либо сочетание этих методов. С учетом того что витилиго обычно требует длительной терапии, мазь такролимус обладает неоспоримым преимуществом перед ГКС, поскольку не компрометирует безопасность пациентов.
Существенно повысить эффективность лечения витилиго помогает комбинация фототерапии с местным лечением, особенно комбинированная терапия с использованием UVB (ультрафиолетовые лучи типа В), узкополосной фототерапии 311 нм или 308 нм эксимерным лазером и 0,1%-ной мази такролимус. Согласно данным исследований, после проведения подобной комбинированной терапии частота репигментации превышает 75%34, 35. Как правило, комбинацию «эксимерный лазер + такролимус» применяют курсами: первый курс длится до 3 месяцев, процедуры выполняются два раза в неделю, затем следует трехмесячный перерыв. После этого проводятся еще несколько курсов. Лечение длительное, не менее года.
Терапия эксимерным лазером в комбинации с 0,1%-ной мазью такролимус позволяет добиться хороших результатов и при лечении очаговой алопеции. В целом такролимус (Протопик) продемонстрировал клиническую эффективность при лечении себорейного дерматита, а также ряда других дерматозов, поскольку по эффективности препарат сопоставим с сильными ГКС, но обладает более высоким профилем безопасности. Он является препаратом первого выбора при локализации вызванных АтД поражений на лице, шее и других чувствительных участках кожи. На сегодняшний день Протопик – единственный наружный ингибитор кальциневрина, официально разрешенный в европейских странах, США, Японии, России и странах СНГ для длительного применения (в течение года и более) в лечении атопического дерматита по схеме 2 раза в неделю с целью предотвращения обострений и удлинения периода ремиссии в течение 12 месяцев и более. Его необходимо как можно шире применять в клинической практике, подчеркнула профессор О.Ю. Олисова, завершая выступление.