Таксотер в адъювантной и неоадъювантной терапии рака молочной железы: итоги клинических исследований
- Аннотация
- Статья
- Ссылки







К моменту установления диагноза заболевание, как правило, уже носит системный характер за счет ранней гематогенной диссеминации и наличия микрометастазов. В большинстве случаев даже раннего РМЖ проведение одного оперативного лечения является недостаточным и требует дополнительной системной лекарственной (химио- и/или гормоно-) терапии, которая может быть предоперационной (неоадъювантной или индукционной) и адъювантной.
Предоперационная химиотерапия проводится как при первично-операбельном РМЖ (неоадъювантная ХТ), так и при местнораспространенном РМЖ (индукционная ХТ). Предоперационная ХТ более эффективна при: высокой степени злокачественности; отрицательных рецепторах стероидных гормонов; высокой пролиферативной активности опухоли (1). Основной задачей неоадъювантной ХТ первично-операбельного РМЖ является увеличение частоты выполнения органосохранных операций. К дополнительным задачам относится воздействие на микрометастазы и оценка чувствительности опухоли к проводимому лечению (степень лечебного патоморфоза). Неоадъювантная ХТ операбельного РМЖ сопоставима по эффективности с адъювантной: показатели общей и безрецидивной выживаемости одинаковы, однако при достижении полной патоморфологической регрессии опухоли (рCR или 4 степень лечебного патоморфоза) выживаемость достоверно увеличивается (2, 3). Не показано проведение неоадъювантной ХТ, если не планируется изменение характера локального лечения (сохранная операция), или если необходимость проведения системной ХТ сомнительна (малые размеры опухоли, N0, наличие сопутствующей патологии в пожилом возрасте, высокий уровень рецепторов стероидных гормонов в опухоли). В целом стандартом лечения больных операбельным РМЖ на сегодняшний день остается адъювантная системная (химио- и/или гормоно-) терапия (4).
Основной задачей индукционной ХТ местнораспространенного (условно-операбельного – IIIа стадия и неоперабельного – IIIb, IIIc стадии) РМЖ является уменьшение объема поражения и выполнение радикального оперативного вмешательства, а основной целью – излечение, которое, в отличие от диссеминированного РМЖ, считается возможным. Общая тактика проведения индукционной ХТ соответствует таковой при неоадъювантной ХТ, при отсутствии эффекта от первой линии лечения переходят на вторую.
Таксотер (доцетаксел) был одобрен для применения при метастатическом раке молочной железы (РМЖ) в 1996 г., а первое большое клиническое исследование по этому показанию началось в 1993 г. С этого момента около 59 000 пациенток было включено в 77 исследований III фазы, изучающих Таксотер при РМЖ. В результате полученных фундаментальных данных препарат прочно занял место в ряду основных высокоактивных лекарственных агентов, используемых для терапии данного заболевания, и более 1 500 000 больных РМЖ за это время получили Таксотер в рутинной практике. В представленном обзоре рассмотрен ряд важных клинических исследований по применению Таксотера в неоадъювантной и адъювантной терапии РМЖ. Периодический анализ и переосмысление полученных данных имеют большое значение для ежедневной деятельности онкологов, а также задают стандарты лечения РМЖ в будущем. Необходимо заметить, что все приведенные далее результаты получены при изучении оригинального препарата и не могут быть напрямую экстраполированы на его дженерики или другие таксаны. Именно поэтому в статье используется оригинальное название лекарства – Таксотер®.
Таксотер в неоадъювантной терапии РМЖ
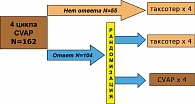
Эффективность Таксотера в неоадъювантной терапии РМЖ изучена в целом ряде исследований. В одно из первых – Абердинское – включены 162 больных с впервые установленным диагнозом, опухолями Т2 более 3 см или местнораспространенной формой заболевания (Т3, Т4, ТхN2) без отдаленных метастазов. На первом этапе всем проведено 4 цикла стандартной антрациклинсодержащей ХТ (использована схема CVAP: циклофосфан, винкристин, доксорубицин, преднизолон). На втором этапе 55 пациенток, не ответивших на начальную терапию, получали 4 курса Таксотера (рисунок 1). Пациентки, ответившие на терапию (n = 104), были рандомизированы на две группы: в первой продолжали химиотерапию по схеме CVAP (еще 4 курса), вторую переводили на Таксотер (4 курса по 100 мг/м2 1 раз в 3 нед.), после чего всем больным выполнялась радикальная операция. Основной целью исследования было сравнение эффективности Таксотера с антрациклинсодержащим режимом.
В группе пациенток, ответивших на начальную химиотерапию по схеме CVAP, общая эффективность лечения, а также частота полных морфологически подтвержденных ответов (pCR) была достоверно выше у больных, переведенных на Таксотер, по сравнению с продолжением терапии CVAP. Кроме того, Таксотер ассоциировался с достоверным улучшением не только безрецидивной, но и общей выживаемости и увеличением частоты выполнения органосохранных операций (таблица 1).
В группе пациенток, не ответивших на антрациклинсодержащую ХТ, перевод на Таксотер позволил добиться 55% полных и частичных регрессий и 2% полных патоморфологически подтвержденных ответов (5). Кроме того, частота нейтропении 3-4 степени была достоверно ниже у больных, получавших лечение с включением Таксотера (4 курса CVAP→4 Таксотера) по сравнению с 8 курсами CVAP (60% и 69% соответственно, р = 0,006).
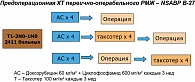
Оптимальная стратегия периоперационного применения Таксотера при первично-операбельном РМЖ (T1c-3N0-1M0) была оценена в исследовании NSABP B-27, включавшем 2411 пациенток, которые были рандомизированы на 3 группы (рисунок 2). На первом этапе все больные получили 4 курса химиотерапии по схеме АС. Затем первая группа оперировалась без последующего адъювантного лечения; вторая группа получала еще 4 курса неоадъювантной терапии Таксотером по 100 мг/м2 1 раз в 3 нед. и затем оперировалась; третья группа подвергалась оперативному лечению после 4 курсов АС, но получала 4 курса Таксотера адъювантно. Всем больным с гормоночувствительными опухолями с первого дня назначали тамоксифен по 20 мг в день, после органосохранных операций проводили лучевую терапию. Основной целью была оценка общей и безрецидивной выживаемости.
Показано, что включение Таксотера в режим неоадъювантной химиотерапии приводит к достоверному увеличению в два раза частоты полных патоморфологически подтвержденных регрессий (таблица 2), к увеличению клинически зарегистрированных полных эффектов с 40 до 64% (p < 0,001) и к уменьшению частоты выявления метастазов в регионарных лимфоузлах с 58,2 до 50,8% (p < 0,001) по сравнению со схемой АС (6).
Анализ отдаленных результатов лечения (таблица 2) показал тенденцию к улучшению показателей DFS и RFS у больных, получавших Таксотер пред- или послеоперационно в сравнении со схемой АС, однако различия были недостоверными. При выделении подгруппы с частичной регрессией после 4 курсов АС оказалось, что дополнительное проведение 4 курсов лечения Таксотером приводило к достоверному улучшению БРВ. Существенных различий в профиле безопасности отмечено не было, за исключением проявлений нейротоксичности, а также фебрильной нейтропении, которая чаще ассоциировалась с Таксотером (21,2%) по сравнению с АС (7,3%).
В англо-кельтском рандомизированном исследовании III фазы сравнили эффективность 6 циклов неоадъювантной химиотерапии по схеме АТ (доксорубицин 50 мг/м2 + Таксотер 75 мг/м2 каждые 3 нед., n = 183) и по схеме АС (доксорубицин 50 мг/м2 + циклофосфамид 600 мг/м2 каждые 3 нед., n = 180) у больных с местнораспространенным или отечно-инфильтративным РМЖ. Отмечена тенденция к улучшению результатов лечения при использовании Таксотер-содержащего режима в сравнении с АС: общая клиническая эффективность составила 71% и 61% (р = 0,06), патоморфологически подтвержденный полный ответ – 20% и 17% (р = 0,42), 5-летняя безрецидивная выживаемость (БРВ) – 58% и 53% (р = 0,28), 5-летняя общая выживаемость (ОВ) – 71% и 67% (р = 0,74). Анализ безопасности показал, что фебрильная нейтропения чаще регистрировалась группе АТ (24% против 12%, р = 0,02), тошнота и рвота – в группе АС (7).
Вопрос об оптимальном числе курсов предоперационной химиотерапии решался в исследовании Reitsamer и соавт. (2005). Показано, что при проведении 6 циклов лечения по схеме ЕТ ( эпирубицин 75 мг/м2 + Таксотер 75 мг/м2 1 раз в 3 нед.) полный патоморфологический ответ регистрировался в 3 раза чаще, чем после 3 аналогичных курсов (36% и 10%, р = 0,045) (8). Такие же данные получены в исследовании ABCSG-14 (9), сравнивавшем 6 и 3 цикла неоадъювантной химиотерапии по схеме ЕТ (включено 292 пациентки с I-III стадиями заболевания). Показано, что полные морфологически подтвержденные эффекты в группе 6ЕТ регистрировались достоверно чаще, чем в группе 3ЕТ: 18,6% против 7,7%, р = 0,0045 (как мы уже говорили ранее, pCR коррелирует с достоверным улучшением выживаемости, именно поэтому данный показатель считается одним из наиболее важных в исследованиях по неоадъювантной терапии).
Вопрос о целесообразности применения Таксотера в режиме «плотных доз» изучен в немецком исследовании GEPAR-duo. Включено 913 больных операбельным РМЖ, рандомизированных на две группы: первая группа получила 4 курса химиотерапии по схеме AТ (доксорубицин + Таксотер) каждые 2 недели с поддержкой колониестимулирующими факторами, вторая группа получала последовательно 4 курса стандартной трехнедельной терапии по схеме АС (доксорубицин + циклофосфамид) и далее 4 курса Таксотера. Результаты исследования показали, что полные патоморфологические регрессии в 2 раза чаще наблюдались в группе последовательного применения Таксотера со стандартными интервалами (14% pCR при 4AC→4Т) в сравнении с комбинированным применением в режиме большей плотности (7% pCR при 4AТ dose-dense) (таблица 3). Причиной выявленных различий может быть не только последовательное использование препаратов, но и значительно большее число циклов и большая длительность терапии в группе 4АС→4Т.
Важно, что полные морфологически подтвержденные ответы достоверно чаще регистрировались у больных с 3 степенью злокачественности по сравнению с 1-2 степенью (21,4% против 5,5%) и с отрицательными рецепторами эстрогенов по сравнению с положительными (22,8% против 6,2%) (10).
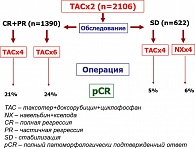
Несмотря на высокую эффективность неоадъювантной химиотерапии с включением Таксотера, у определенной части пациенток не удается быстро добиться клинического ответа. Вопрос о целесообразности перевода на другую схему лечения при недостаточной эффективности режима ТАС (Таксотер + доксорубицин + циклофосфамид) решался в исследовании GERPARTRIO (рисунок 3). Включено 2106 больных первично-операбельным РМЖ, которые на первом этапе получили 2 курса ХТ по схеме ТАС с последующей клинической оценкой эффекта. Больные с полными и частичными регрессиями (n=1390) продолжали лечение в прежнем режиме и рандомизировались на 2 группы по количеству циклов ХТ: еще 4 цикла ТАС (суммарно 6) и еще 6 циклов ТАС (суммарно 8). Пациентки со стабилизацией процесса (n = 622) также рандомизировались на 2 группы: первая продолжала лечение в прежнем режиме (еще 4 курса ТАС), вторая переводилась на химиотерапию по схеме навельбин + кселода (еще 4 курса NX). По окончании плана лечения всех больных оперировали и оценивали частоту pCR.
Оказалось, что у больных с полными и частичными регрессиями увеличение числа курсов предоперационной ХТ с 6 до 8 приводит к незначительному возрастанию частоты полных патоморфологических эффектов с 21 до 24%, p > 0,05 (рисунок 3). В случае недостаточного эффекта от первого режима неоадъювантной ХТ (стабилизация после 2-х циклов ТАС) перевод на другие схемы не улучшает результаты лечения: у пациенток со стабилизацией частота pCR при продолжении ХТ по схеме ТАС составила 5%, при переводе на комбинацию NX (навельбин + кселода) – 6% (рисунок 3) (11).
Последовательное использование 3 циклов FEC100 (5-фторурацил 500 мг/м2 + эпирубицин 100 мг/м2 + циклофосфамид 500 мг/м2 каждые 3 нед.) – 3 циклов Таксотера по 100 мг/м2 является стандартом адъювантной ХТ во Франции после опубликования результатов исследования PACS 01. В 2009 г. были доложены результаты применения этого режима в качестве неоадъювантного у 101 пациентки с II-III стадиями РМЖ (12). Основной целью лечения было выполнение органосохраняющих операций. После проведения 3 циклов ХТ по схеме FEC100 общий объективный ответ составил только 15%, а после еще 3 курсов Таксотера увеличился до 62,5%! Органосохранные операции удалось выполнить 76 пациенткам (75,2%), полные патоморфологические ответы установлены в 14,8% случаев, 5-летняя выживаемость без возврата заболевания (RFS) составила 88,5%, 5-летняя ОВ – 92,7%. Использованный последовательный режим характеризовался хорошей переносимостью и управляемой токсичностью.
Определенным итогом исследований неоадъювантной ХТ стал представленный von Minckwitz и соавт. (13) метаанализ, объединивший результаты предоперационного лечения 6402 больных, включенных в 7 исследований (GeparDo, GeparDuo, GeparTrio, GeparQuattro, AG01, TECHNO, Prepare). Лечебные режимы содержали антрациклины (доксорубицин или эпирубицин) и таксаны (Таксотер или паклитаксел) +/- трастузумаб. Общая частота полных патоморфологических эффектов (pCR) составила 19,3%. Вариант использования таксанов (последовательно или конкурентно) не влиял на частоту pCR (16,5% и 17,5%, р = 0,329), которые чаще регистрировались при использовании стандартных режимов по сравнению с дозоинтенсивными (p < 0,001). Кроме того, были выделены факторы, способные предсказать высокую вероятность достижения полной патоморфологической регрессии: молодой возраст, небольшие размеры опухоли, отсутствие метастазов в лимфоузлах, отрицательные гормональные рецепторы, HER2-позитивный статус, 3 степень злокачественности.
Таксотер в адъювантной терапии РМЖ
Метастазы являются основной причиной смерти больных РМЖ, а применение адъювантного системного лечения (химио- и/или гормонотерапии) после радикального оперативного вмешательства достоверно снижает риск рецидива и смерти от прогрессирования. Метаанализ EBCTCG подтвердил эффективность различных режимов адъювантной ХТ в отношении уменьшения риска рецидива и смерти больных РМЖ: доказано снижение 10-летнего риска смерти при использовании режима CMF по сравнению с контролем на 4,3% (p < 0,00001); антрациклинов по сравнению с CMF – на 4,3% (p < 0,00003) и таксанов по сравнению с антрациклинами – на 5,1% (p < 0,00001) (14, 15).
В настоящее время в пятьдесят рандомизированных исследований III фазы по оценке роли Таксотера в адъювантной терапии РМЖ включено 54 572 пациентки, по большинству из них доступны данные, касающиеся отдаленных результатов (4 крупные программы в настоящее время продолжаются). Проводилось сравнение эффективности Таксотера с антрациклинами, изучались оптимальные режимы применения препарата (с антрациклинами – одновременно или последовательно, в безантрациклиновых комбинациях, в сочетании с трастузумабом при гиперэкспрессии HER2 и т.д.).
В большом клиническом исследовании III фазы BCIRG 001 (16, 17) сравнили эффективность 6 курсов адъювантной ХТ по схеме ТАС (Таксотер 75 мг/м2 + доксорубицин 50 мг/м2 + циклофосфамид 500 мг/м2 каждые 3 нед.) и по схеме FAC (5-фторурацил 500 мг/м2 + доксорубицин 50 мг/м2 + циклофосфамид 500 мг/м2 каждые 3 нед.) у больных с метастазами в регионарные лимфоузлы. Включались пациентки после радикальной операции (n = 1491) со стадиями Т1-3, N1, M0; проводилась стратификация по количеству пораженных лимфоузлов (1-3 против 4+) и центру.
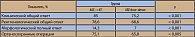
Пятилетняя БРВ равнялась 75% для TAC и 68% для FAC (р = 0,001), общая 5-летняя выживаемость составила в группе TAC 87% и в группе FAC 81%, при этом Таксотер снижал риск развития рецидива на 28%, риск смерти – на 30% (таблица 4). Выигрыш от Таксотера не зависел от рецепторного статуса и регистрировался и в рецептороположительной, и в рецептороотрицательной группе. Таким образом, включение Таксотера в режим адъювантной ХТ достоверно улучшало как безрецидивную, так и, что особенно важно, общую выживаемость больных РМЖ с метастазами в регионарные лимфоузлы.
Необходимо отметить, что режим ТАС по сравнению с FAC ассоциировался с достоверно более высокой частотой токсичности 3-4 степени, включая анемию (4,3% против 1,6%), нейтропению (65,5% против 49,3%), фебрильную нейтропению (28,8% против 4,4%), нейтропенические инфекции (20,4% против 10,8%), астению (11,2% против 5,6%), стоматит (7,1% против 2,0%). Тошнота и рвота 3-4 степени достоверно чаще регистрировались в группе FAC (9,5% и 7,3%) по сравнению с TAC (5,1% и 4,3%), p < 0,03. В исследовании GEICAM 9805 было показано, что профилактическое назначение колониестимулирующих факторов (GCSF) с первого цикла химиотерапии по схеме ТАС приводит к достоверному снижению частоты фебрильных нейтропений с 27,2 до 7,5% (р = 0,0001) (18).
Следующей важной проблемой является выбор оптимального режима адъювантного лечения у больных без метастазов в регионарные лимфоузлы. Этот вопрос изучался в том же исследовании GEICAM 9805 (18, 19), включавшем 1059 пациенток с Т1-3N0M0 стадией заболевания и наличием хотя бы одного из следующих неблагоприятных факторов прогноза: 2 или 3 степень злокачественности, опухоль > 2 см, возраст моложе 35 лет, отрицательные гормональные рецепторы. После выполнения радикальной операции больные рандомизировались на 2 группы: первая получала 6 курсов адъювантной ХТ по схеме ТАС, вторая – 6 курсов FAC (со стратификацией по менопаузальному статусу и центру). Набор в исследование начался в 1999 г., с 2000 г. пациентки, рандомизированные в группу ТАС, профилактически получали GCSF. Безрецидивная выживаемость была достоверно выше в группе ТАС по сравнению с FAC: 5-летняя БРВ составила 91% и 86%, при этом риск развития рецидива снижался на 34% (таблица 5). Таким образом, включение Таксотера в режим адъювантной ХТ у больных без метастазов в регионарные лимфоузлы (но с наличием неблагоприятных факторов прогноза) привело к достоверному улучшению безрецидивной выживаемости.
Еще одним важным направлением исследований является поиск эффективного безантрациклинового режима адъювантной ХТ. Особенно остро эта проблема стоит в отношении пациенток с сопутствующей сердечной патологией, а также при левосторонней локализации опухоли и органосохранной операции (показано, что лучевая терапия на левую половину грудной клетки в сочетании с антрациклинсодержащей адъювантной ХТ ассоциируется с развитием в отдаленные сроки клинически значимых осложнений со стороны сердечно-сосудистой системы). В рандомизированном исследовании III фазы USON 9735 (20) сравнили эффективность 4 курсов адъювантной химиотерапии по схеме ТС (Таксотер 75 мг/м2 + циклофосфамид 600 мг/м2 каждые 3 нед.) и 4 курсов АС (доксорубицин 60 мг/м2 + циклофосфамид 600 мг/м2 каждые 3 нед.). Включено 1016 пациенток с I-III стадией РМЖ после радикальной операции.
Показатели 7-летней безрецидивной и общей выживаемости в группе Таксотер + циклофосфамид составили 81% и 87% (таблица 6) и оказались достоверно выше, чем в группе стандартного лечения по схеме АС (75% и 82% соответственно) (21). Таксотер обеспечивал редукцию относительного риска рецидива на 26% (р = 0,033) и риска смерти на 31% (р = 0,032). Различия выявлялись в том числе и у женщин старше 65 лет (22).
В целом преимущества Таксотера не зависели от рецепторного статуса, наличия/отсутствия метастазов в регионарных лимфоузлах и возраста и реализовывались во всех перечисленных подгруппах (рисунок 4).
При оценке профиля безопасности частота фебрильных нейтропений (ФН) в обеих группах была невысока. Хотя ФН несколько чаще встречались в группе ТС (5%) по сравнению с АС (2,5%), различия были недостоверными (р = 0,07). Таким образом, по данным исследования USON 9735, проведение безантрациклиновой адъювантной ХТ на основе Таксотера обеспечивает достоверное улучшение показателей общей и безрецидивной выживаемости в сравнении со стандартным антрациклинсодержащим режимом. Преимущества Таксотера не зависят от возраста, рецепторного статуса и поражения регионарных лимфоузлов.
Значение последовательного адъювантного применения Таксотера после стандартного антрациклин (эпирубицин)-содержащего режима в сравнении только со стандартным режимом изучалось в исследовании PACS 01 (23). 1999 больных РМЖ с метастазами в регионарные лимфоузлы после радикальной операции рандомизировались на 2 группы: первая получала 3 курса FEC100→3 курса Таксотера, вторая – 6 курсов FEC100 (то есть общее число циклов в сравниваемых группах было одинаковым, в отличие от «классического» адъювантного исследования паклитаксела, где 4 курса АС сравнивали с 8 курсами последовательной ХТ (4 АС → 4 паклитаксела), и преимущества от добавления паклитаксела могли объясняться в том числе и увеличением общего числа циклов лечения в 2 раза). Кроме того, антрациклин-содержащий режим сравнения в исследовании PACS 01 характеризовался высокой дозой эпирубицина: FEC100 – 5-фторурацил 500 мг/м2+эпирубицин 100 мг/м2+ циклофосфамид 500 мг/м2 каждые 3 нед. Таксотер применялся в стандартной дозе – по 100 мг/м2 каждые 3 нед. Результаты исследования PACS 01 представлены в таблице 7.
Назначение Таксотера после 3 курсов ХТ по схеме FEC100 по сравнению 6 курсами FEC100 у больных с метастазами в регионарные лимфоузлы приводило к достоверному увеличению безрецидивной выживаемости (78,4% против 73,2%) и общей выживаемости (90,7% против 86,7%). Таким образом, Таксотер обеспечивал снижение риска рецидива на 18% (р = 0,012) и снижение риска смерти на 27% (р = 0,017). Важные данные были также получены в отношении токсичности: Таксотер ассоциировался с увеличением случаев фебрильной нейтропении по сравнению с FEC100 (11,2% против 8,4%, р = 0,03), однако частота нейтропении 3-4 степени на 21-й день цикла в группе Таксотера была достоверно меньше (28,1% против 33,6%, р = 0,008), что свидетельствует о кратковременности этого побочного явления и быстром восстановлении показателей крови. В группе Таксотера отмечено преобладание случаев отеков 3-4 степени (4,8% против 0,3%, р < 0,001), однако частота побочных кардиальных явлений, расцененных как серьезные, была достоверно ниже (0,4% против 1,3% при 6 FEC100, р = 0,03).
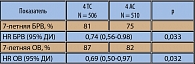
Интересным вопросом является выигрыш от проведения адъювантной ХТ в рецепторопозитивной группе (считается, что при наличии на опухолевых клетках рецепторов стероидных гормонов основу адъювантного лечения составляет гормонотерапия, а преимущества от добавления таксанов невелики). В анализ эффективности Таксотер-содержащих режимов при положительных эстрогеновых рецепторах (ЭР) были включены пациентки из исследований BCIRG001 и PACS01 (n = 3329, ЭР + статус определен у 2493) (24). Таксотер ассоциировался со снижением риска смерти на 30% в ЭР + группе (HR = 0,70; 95% ДИ 0,54-0,91) и на 31% в ЭР– группе (HR = 0,69; 95% ДИ 0,54-0,97). Экспрессия ЭР не являлась предиктором ответа на Таксотер. Вывод: эффективность Таксотера в отношении редукции риска рецидива и смерти у больных РМЖ не зависит от рецепторного статуса.
Задачу поиска оптимального режима интеграции Таксотера в адъювантную терапию РМЖ решало одно из наиболее представительных исследований NSABP B-30 (25), включавшее 5351 пациентку с метастазами в регионарные лимфоузлы (N+) после радикальной операции. Больные рандомизировались на 3 группы:
- 4АС (60/600 мг/м2)→4Т (100 мг/м2);
- 4АТ (75 /50 мг/м2);
- 4ТАС (75/50/500 мг/м2).
Пациенткам с положительными гормональными рецепторами назначалась адъювантная гормонотерапия тамоксифеном в течение 5 лет. Основным оцениваемым показателем была общая выживаемость (медиана времени наблюдения 73 мес.).
Последовательное назначение доксорубицина и Таксотера (4АС→4Т) превосходило по общей выживаемости оба одновременных режима (4АТ и 4ТАС), причем в отношении схемы АТ различия были достоверными: в группе 4АС→4Т относительный риск смерти снижался по сравнению с группой АТ на 17% (p = 0,034), и по сравнению с группой TAC на 14% (p = 0,086) (таблица 8). Существенных различий между схемами АТ и ТАС по общей выживаемости не отмечено (р = 0,76).
Аналогичные данные были получены и в отношении безрецидивной выживаемости: последовательный режим (4АС→4Т) достоверно превосходил оба одновременных (и АТ, и ТАС) по этому показателю (таблица 8). Различий между схемами АТ и ТАС по БРВ не выявлено.
Преимущества последовательного режима сохранялись независимо от возраста, рецепторного статуса, состояния подмышечных лимфоузлов, проведения гормонотерапии и менструального статуса. При анализе последнего фактора оказалось, что ОВ и БРВ были значительно выше в группе с индуцированной аменореей продолжительностью более 6 мес. Такая длительность индуцированной аменореи чаще достигалась при использовании последовательного режима (86% в группе 4АС→4Т) по сравнению с одновременными (82% при ТАС и 69% при АТ), поэтому последняя схема (АТ) может быть вариантом выбора у молодых пациенток, желающих сохранить фертильность (26, 27). Показатели качества жизни были одинаковыми во всех трех сравниваемых группах (26).
Результаты предыдущего исследования могут объясняться в том числе различным числом курсов в сравниваемых группах (8, 4 и 4), поэтому мы приводим данные еще одной международной рандомизированной программы по адъювантной терапии – BCIRG 005 (28), в которой сравнивалась эффективность и переносимость последовательного режима (4АС→4Т) с 6 курсами ТАС (75/50/500 мг/м2), то есть в группе сравнения проводили на 2 курса ТАС больше, чем в протоколе NSABP B-30. В исследование BCIRG 005 было включено 3298 больных HER2-негативным РМЖ с метастазами в лимфоузлы (N+), в случае гормонозависимой опухоли проводилась адъювантная гормонотерапия, по показаниям – лучевая терапия. Различий между последовательным и конкурентным режимами адъювантной ХТ на основе Таксотера в этом исследовании не выявлено: 5-летняя БРВ составила для группы 6ТАС 78,9%, для группы 4АС→4Т – 78,6% (HR = 1,002; p = 0,98), 5-летняя ОВ – 88,1% и 88,9% соответственно (HR = 0,91; p = 0,37). Профиль токсичности был типичным: в группе ТАС достоверно чаще регистрировались случаи тромбоцитопении 3-4 степени и фебрильной нейтропении, но это не сопровождалось повышением риска инфекционных осложнений, в группе 4АС→4Т преобладала сенсорная нейропатия; изменения со стороны ногтей и миалгии (p < 0,0001). Таким образом, 6 курсов адъювантной ХТ по схеме ТАС были равноэффективны 8 последовательным курсам лечения (4АС→4Т) при меньшей продолжительности терапии.
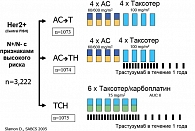
Еще одним важным направлением является поиск наиболее оптимального режима адъювантной химиотерапии при HER2-позитивном раке молочной железы (актуальность проблемы объясняется неприемлемой кардиотоксичностью при одновременном применения антрациклинов и трастузумаба). В исследование BCIRG 006 (TAX302) (29) было включено 3222 пациентки с HER2+ статусом, метастазами в лимфоузлах (N+) или без метастазов (N0), но с присутствием одного из факторов риска (опухоль более 2 см, отрицательные гормональные рецепторы, возраст моложе 35 лет, степень злокачественности 2 или 3). Больные были рандомизированы на 3 группы: первая получила 4 курса АС (60/600мг/м2), затем 4 курса Таксотера по 100 мг/м2 (АС→Т), вторая 4АС→4Таксотера и одновременно с Таксотером начинали трастузумаб, который продолжали в течение 1 года (АС→ТН), третья получила 6 курсов по схеме Таксотер100 мг/м2+ Карбоплатин AUC6+трастузумаб в течение 1 год (ТСН) (рисунок 5).
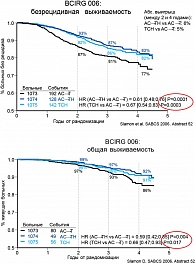
Существенных различий в показателях общей и безрецидивной выживаемости между двумя трастузумабсодержащими режимами (АС→ТН и ТСН) не выявлено, оба они имели достоверные преимущества по сравнению с группой без трастузумаба (АС→Т) при HER2+ РМЖ (рисунок 6).
Меньшее число курсов в группе ТСН может считаться определенным преимуществом, так как при более короткой продолжительности химиотерапии по сравнению с АС→ТН режим ТСН демонстрирует не меньшую эффективность. Таким образом, исследование показывает обоснованность выбора безантрациклиновой комбинации Таксотера и трастузумаба для адъювантной терапии РМЖ с гиперэкспрессией HER2.
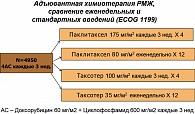
Наконец, одним из самых интересных вопросов, решаемых при планировании адъювантного лечения, является вопрос выбора таксана. В исследование ECOG 1199 было включено 4950 больных РМЖ (N+ или N0 с высоким риском рецидива), которым после операции проводили 4 курса АС (30). Затем больные рандомизировались на 4 группы: паклитаксел 175 мг/м2 каждые 3 нед. х 4 цикла, паклитаксел 80 мг/м2 еженедельно х 12 введений, Таксотер 100 мг/м2 каждые 3 нед. х 4 цикла, Таксотер 35 мг/м2 еженедельно х 12 введений (рисунок 7). Основной целью исследования была оценка БРВ при сравнении паклитаксела с доцетакселом и 3-недельных введений с еженедельными; вторичными – общая выживаемость и безопасность. При анализе 2х2 существенных различий между двумя таксанами или двумя режимами введений не отмечено, а вот сравнение по отдельным группам дало очень интересные результаты (таблица 9).
При медиане наблюдения 5 лет БРВ для больных, получавших стандартный паклитаксел 1 раз в 3 нед., была достоверно хуже по сравнению с Таксотером 1 раз в 3 нед. (HR = 1,23, р = 0,02) и с еженедельным паклитакселом (HR = 1,27, р = 0,006). По сравнению с еженедельным паклитакселом, Таксотер 1 раз в 3 нед. обеспечивал такие же показатели общей и безрецидивной выживаемости при несомненно более удобном режиме лечения и меньшем числе введений (30).
В исследование N-SAS BC02, также посвященном сравнению двух таксанов, включено 1044 больных, оперированных по поводу I-IIIA стадий РМЖ (31). Пациентки рандомизировались на 4 группы:
- 4АС (60/600 мг/м2)→4 паклитаксела 175 мг/м2 1 раз в 3 нед.
- 4АС (60/600 мг/м2)→4 Таксотера 75 мг/м2 1 раз в 3 нед.
- 8 курсов паклитаксела 175 мг/м2 1 раз в 3 нед.
- 8 курсов Таксотера 75 мг/м2 1 раз в 3 нед.
После органосохранных операций проводили лучевую терапию, при гормонозависимых опухолях на 5 лет назначали тамоксифен или ингибиторы ароматазы. Предварительный анализ результатов показал, что:
- Таксотер превосходит паклитаксел в отношении безрецидивной выживаемости, обеспечивая снижение риска возврата заболевания на 19% (HR = 0.81, 95% ДИ 0,57-1,14, р = 0,08) (рисунок 7);
- при анализе всей группы больных РМЖ 8 курсов монохимиотерапии таксанами продемонстрировали схожие показатели БРВ, что и 4 курса АС с последующими 4 курсами таксанов (HR=1,26, 99% ДИ 0,92-1,72, р = 0,67).
- в подгруппе с гиперэкспрессией HER2/neu отмечен выигрыш от антрациклинов (последовательные режимы 4АС + 4 таксана) по сравнению с монотерапией таксанами (HR=1,63, 95% ДИ 1,05-2,54). У больных HER2-негативной группы результаты лечения были одинаковыми;
- фебрильная нейтропения ассоциировалась с Таксотером, сенсорная нейропатия – с паклитакселом.
Еще в одном очень интересном исследовании – FinHER (31) сравнили эффективность адъювантного использования Таксотера с винорельбином и оценили значение короткого курса трастузумаба при HER2-позитивном РМЖ. 1010 больных были рандомизированы на 2 группы: 3 Таксотера 100 мг/м2 →3FE60C или 3 винорельбина 25 мг/м2 (1, 8, 15 дни каждые 3 нед.)→ 3FE60C, каждая из этих групп, в свою очередь, рандомизировалась на 2 подгруппы: с коротким 9-недельным циклом трастузумаба (еженедельно во время терапии Таксотером или винорельбином) или без трастузумаба. Показаны достоверные преимущества Таксотера перед винорельбином в отношении выживаемости без возврата заболевания (3-летняя RFS 91,3% и 86,4%, p < 0,005). Кроме того, короткий курс трастузумаба также обеспечивал достоверное улучшение показателей RFS и продемонстрировал тенденцию к улучшению ОВ.
Таким образом, проведенные клинические исследования показали, что Таксотер является важным компонентом адъювантной терапии больных РМЖ, особенно с высоким риском рецидива заболевания. Выигрыш от включения препарата в режимы лечения не зависит от возраста, состояния регионарных лимфоузлов, рецепторного и менструального статуса и реализуется во всех подгруппах пациенток. Таксотер одинаково эффективен в HER2-позитивной и негативной группах.
В адъювантном режиме Таксотер демонстрирует высокую эффективность как в антрациклинсодержащих схемах, так и в составе безантрациклиновых комбинаций, в том числе и одновременно с трастузумабом. В режиме стандартных введений с интервалом 3 нед. Таксотер по сравнению с паклитакселом имеет преимущества по безрецидивной выживаемости и практически не обладает нейротоксичностью, являющейся серьезной проблемой для паклитаксела.
В заключение необходимо сказать, что достигнутый за последние несколько лет прогресс в онкологии привел к необходимости индивидуализации лечения с одновременной интеграцией таргетных препаратов в рутинную практику. Стратегия комбинирования новых лекарств с классическими цитостатиками и поиск наилучшего химиотерапевтического партнера для таргетных агентов является фокусом ведущихся и будущих клинических исследований Таксотера.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.