Терапия идиопатической патоспермии
- Аннотация
- Статья
- Ссылки
- English

Актуальность
Бесплодный брак – не только медицинская, но и социальная проблема. По данным Г.Т. Сухих (2010), 16% пар в России бесплодны, что превышает критический уровень, создавая угрожающую демографическую ситуацию [1]. Доля мужского фактора среди всех случаев бесплодных браков достигает 50%, и тенденция к снижению этой цифры пока не наблюдается.
Среди причин мужской инфертильности чаще других называют иммунные факторы, инфекционно-воспалительные заболевания органов мужской мочеполовой системы, варикоцеле, аномалии развития семявыносящих путей, системные заболевания:
- эндокринопатии (сахарный диабет, андрогенодефицит, гипотиреоз, болезнь Иценко – Кушинга, гиперкортицизм);
- болезни почек (хроническая болезнь почек, в том числе терминальная стадия, когда требуется проведение гемодиализа);
- болезни печени (хронический гепатит, цирроз);
- болезни органов дыхания (хроническая пневмония, бронхиальная астма, эмфизема легких);
- болезни сердечно-сосудистой системы (гипертоническая болезнь, атеросклероз, пороки сердца) [2].
Немаловажное значение имеет инфертильность, обусловленная идиопатической патоспермией, то есть эссенциальной, самостоятельной, без видимых причин (причины, конечно, есть, но они пока не известны). За последние десять лет благодаря углубленному изучению иммунологического, генетического, эндокринологического и других аспектов инфертильности и выявления неизвестных ранее этиопатогенетических механизмов ее развития удалось снизить частоту встречаемости идиопатических форм мужского бесплодия с 70 до 35%.
Роль окислительного стресса в патогенезе бесплодия
Вероятно, в скором времени распространенность идиопатического бесплодия станет еще меньше в результате понимания других возможных факторов, негативно влияющих на сперматогенез. Одним из них является гиперпродукция сперматозоидами активных форм кислорода, вызывающих окислительный стресс.
Процессы нарушения окислительно-восстановительного равновесия клеток (так называемого редокс-статуса) описаны в свободнорадикальной теории старения, основные положения которой были сформулированы D. Harman в 1950-х гг. [3]. Согласно этой теории, клеточный редокс-статус поддерживается благодаря постоянному притоку энергии, а его нарушение приводит к повышению уровня токсичных реактивных форм кислорода, таких как пероксиды и свободные радикалы. В результате несостоятельности антиоксидантной системы организма (то есть преобладания окислительных реакций над восстановительными) клетки подвергаются воздействию чрезмерных концентраций молекулярного кислорода или его активных форм (свободных радикалов).
Свободными радикалами называют атомы или молекулы, у которых по каким-либо причинам на внешней электронной орбитали имеется один или несколько неспаренных электронов. Такой атом стремится восстановить парную структуру своих электронов и ведет себя агрессивно по отношению к соседним частицам. Вступая с ними в химические реакции, он отбирает у них электроны или отдает им непарный электрон. В результате этого соседние частицы превращаются в свободные радикалы и в свою очередь проделывают то же самое с другими атомами и молекулами, запуская цепную реакцию. В клетке накапливаются функциональные и органические нарушения, приводящие к ее неспособности выполнять свою роль и даже к гибели. «Бракованных» клеток становится все больше, что неизбежно ведет к старению организма. Такое повреждение клетки свободными радикалами и носит название окислительного стресса.
Образование свободных радикалов и их действие на клетки – физиологическое явление, имеющее место в процессе метаболизма (в том числе при перекисном окислении липидов) при приеме пищи, работе мышц, дыхании, то есть там, где проходят энергетические реакции, деление клеток, синтез биологически активных веществ. Но с течением времени этот процесс неизбежно приобретает патофизиологические черты. «Виновниками» образования свободных радикалов могут быть также действие ультрафиолетового излучения, загрязнение окружающей среды, стрессы, неправильное питание. Таким образом, причины окислительного стресса кроются как вне, так и внутри организма.
Первоначально повреждающее действие в результате окислительных реакций приписывали только свободным радикалам (супероксидам), затем в этот список были включены и другие активные формы кислорода: озон, пероксиды, в том числе перекись водорода (Н2О2), пероксинитрит (ONOO-), хлорноватистая кислота (НОСl) и др. Однако свободные радикалы приносят организму не только вред, они могут оказывать бактерицидное действие, а также выполнять функции нейромедиаторов.
Окислительный стресс затрагивает все основные органеллы и жизненно важные процессы эукариотической клетки. Несмотря на то что окисление используется клеткой для выработки энергии, при большом количестве оксидантов разрушаются митохондрии, ответственные за энергетическое снабжение, и клетка гибнет в результате истощения резервных мощностей. Идею роли митохондрий в образовании свободных радикалов выдвинул в 1970-х гг. автор свободнорадикальной теории D. Harman.
Вследствие окислительного стресса страдают эндоплазматический ретикулум и комплекс Гольджи, принимающие непосредственное участие в синтезе белка. Окислительный стресс может повреждать клеточные мембраны, затрудняя поступление питательных веществ и коммуникацию клетки, а также нарушает ее защитную функцию, что делает клетку восприимчивой к инфекционным агентам и другим негативным факторам. Наконец, чрезмерные окислительные реакции способны нанести урон ядерной ДНК, в результате чего поврежденная ДНК мутирует. Это приводит к гибели клетки [3] или ее неконтролируемому делению.
Таким образом, нарушаются разнообразные жизненно важные процессы в клетках различных органов и тканей (в первую очередь белков, липидов, нуклеиновых кислот). В этой связи окислительный стресс, помимо раннего старения, может приводить к заболеваниям и патологическим состояниям в организме человека: раку кожи, воспалительным процессам, остеоартрозу, деменции, закупорке коронарных шунтов и блокаде коронарных стентов. Кроме того, он может провоцировать возникновение сахарного диабета, бронхиальной астмы, оптической нейропатии, мышечной дистрофии Дюшена, неалкогольной жировой дистрофии печени, заболеваний пародонта, метаболического синдрома. Такие же окислительные реакции, приводящие к повреждению клеток, возможно, происходят и в сперматозоидах, вызывая нарушения фертильности у мужчин.
Антиоксиданты
В ответ на широкое распространение гипотезы о ведущей роли свободных радикалов в старении организма возникло предположение о том, что прием антиоксидантов может уменьшить или предотвратить развитие окислительного стресса и затормозить процесс разрушения клеток. Это позволит остановить прогрессирование многих заболеваний и продлить активные годы жизни человека, а в случае инфертильности – улучшить характеристики сперматозоидов и качество эякулята в целом.
Антиоксиданты уменьшают образование свободных радикалов за счет восполнения на орбитах атомов недостающих электронов (то есть являются донорами), не превращаясь при этом в такие же свободные радикалы. Применяются антиоксиданты не только в медицине, но и в пищевой (в качестве консервантов), химической и других отраслях промышленности. Некоторые продукты и напитки (ягоды, фрукты, орехи, красное вино, зеленый чай) содержат большое количество антиоксидантов.
Антиоксидантная активность одних и тех же веществ может различаться. A. Zini и соавт. [4] установили, что наибольшей антиоксидантной активностью обладают карнитин, ретинол (витамин А), аскорбиновая кислота (витамин С) и цинк. Другие авторы не столь категоричны и признают необходимость дальнейших исследований для выявления преимуществ одних антиоксидантов перед другими [5, 6].
В любом случае сочетание веществ, препятствующих окислительному стрессу, приводит к более выраженному положительному результату, чем их применение по отдельности. По этой причине в последнее время для терапии и профилактики мужской инфертильности применяются многочисленные многокомпонентные биопрепараты, состоящие, как правило, из витаминов, микроэлементов, аминокислот, а также энзимов, пробиотиков, натуральных липидов и экстрактов растений.
Антиоксидантный потенциал комплекса АндроДоз
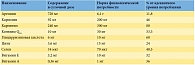
Одним из таких биопрепаратов является АндроДоз. В его состав входят девять веществ, каждое из которых известно своими свойствами, улучшающими качество спермы (табл. 1).
Аргинин (2-амино-5-гуанидинпентановая кислота) является условно заменимой аминокислотой. До 80% количества аргинина содержится в белках семенной жидкости, а его дефицит может быть причиной патозооспермии. Аргинин стимулирует синтез тестостерона у мужчин, а его комбинация с альфа-кетоглюкоратом значительно повышает уровень оксида азота и поэтому оказывает более выраженное действие.
Карнозин (бета-аланилгистидин) является дипептидом. Он участвует в поддержании на физиологическом уровне концентрации водородных ионов, ионов меди, цинка, железа, а также оказывает антиоксидантное действие.
Карнитин (витамин В11, или витамин Г) является особой витаминоподобной аминокислотой. Большие концентрации карнитина, находящегося в секрете предстательной железы, необходимы для нормального функционирования мужской репродуктивной системы. Карнитин играет важную роль в созревании сперматозоидов (концентрация данного вещества у мужчин с бесплодием достоверно ниже, чем у мужчин с нормальной фертильностью).
Коэнзим Q10 (убихинон) близок по своему строению к витаминам группы К и присутствует в большинстве тканей человеческого организма. Он обладает антиоксидантными свойствами и защищает клетки от негативного действия свободных радикалов, обеспечивает организм энергией и повышает выносливость при высоких физических нагрузках, способен замедлять процесс старения, поддерживая способность клеток вырабатывать энергию. Назначение коэнзима Q10 мужчинам с идиопатической патозооспермией приводит к увеличению количества подвижных сперматозоидов.
Глицирризиновая кислота содержится в корне солодки и по строению напоминает молекулы гормонов, вырабатываемых корковым слоем надпочечников (кортизона и др.). Оказывает антиоксидантное, антипролиферативное, антигистаминное и противовирусное действие, а также стимулирует регенерацию тканей.
Цинк служит кофактором более чем в 20 ферментативных реакциях организма, в частности ферментной системы супероксиддисмутазы, которая катализирует реакцию диспропорционирования свободных радикалов. Ионы цинка необходимы для проявления активности гидролаз (фосфатазы, пептидазы, киназы), которые участвуют в частности в переносе фосфат-иона и играют важную роль в метаболизме нуклеиновых кислот, белков, жиров, углеводов, жирных кислот и гормонов (в том числе половых).
Cеленметионин является активированной формой селена – жизненно необходимого микроэлемента, входящего в состав ряда гормонов и ферментов, связанных практически со всеми органами и системами организма человека. Ионы селена являются кофактором ферментной системы глутатионпероксидазы, которая разлагает перекись водорода за счет одновременного окисления восстановленного глутатиона. Селен важен для сосудов, зрения, иммунитета, сердца и для мужского здоровья (способствует профилактике бесплодия и рака простаты), способен защищать сперматогенез при острых и хронических интоксикациях.
Витамин Е (токоферол) – важнейшее природное соединение производных токола. Относится к внутриклеточным антиоксидантам, обеспечивает созревание половых клеток, активизирует сперматогенез. Токоферол обеспечивает защиту ненасыщенных жирных кислот в мембранах от явления липопероксидации, участвует в формировании межклеточного вещества, коллагеновых и эластичных волокон соединительной ткани, гладкой мускулатуры сосудов и пищеварительного тракта.
Название «витамин А» объединяет группу близких по химическому строению веществ, которая включает ретинол (витамин A1), дегидроретинол (витамин A2), ретиналь (альдегид витамина A1) и ретиноевую кислоту. Витамин А является важным элементом антиоксидантной системы, защищающим клеточные мембраны от окисления. Выявлена положительная взаимосвязь между уровнями витамина А в семенной жидкости и подвижностью сперматозоидов, между уровнем потребления с пищей каротиноидов и концентрацией сперматозоидов. Отмечена взаимосвязь витамина А с цинком, которые влияют друг на друга и значительно усиливают антиоксидантное действие.
Материал и методы
В 2013 г. в России проведено многоцентровое клиническое исследование с целью определения возможности использования АндроДоза для коррекции патоспермии и оценки его безопасности.
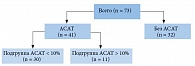
В исследовании, проходившем в девяти клинических центрах России, приняли участие 73 пациента в возрасте от 20 до 65 лет (в среднем 34,32 ± 7,9 года) с различными причинами и вариантами патоспермии, включая идиопатическую, и продолжительностью бесплодного брака от 14 месяцев до четырех лет (в среднем 22,27 ± 17,1 месяца).
Все пациенты были разделены на две группы в зависимости от наличия (n = 41) или отсутствия (n = 32) антиспермальных антител (АСАТ) в эякуляте. В свою очередь пациенты с наличием АСАТ были разделены на две подгруппы, в которые вошли соответственно пациенты с содержанием АСАТ не более 10% (n = 30) и более 10% (n = 11).
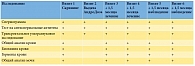
Исследование включало шесть визитов, в процессе которых пациентам проводились неоднократные исследования эякулята (спермограмма и тест на АСАТ), простаты (трансректальное ультразвуковое исследование), сыворотки крови (общий и биохимический анализы, гормоны) и мочи (общий анализ) (рис. 1, табл. 2).
Пациенты обеих групп принимали АндроДоз в течение трех месяцев, после чего три последующих месяца находились под наблюдением врача.
Результаты исследования
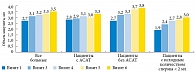
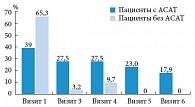
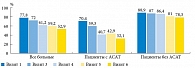
При анализе результатов исследования было выявлено улучшение всех характеристик сперматозоидов (и количественных, и качественных) и околоспермальной плазмы. Так, при исследовании эякулята отмечено прогрессивное статистически значимое увеличение объема эякулята начиная с третьего визита, который осуществлялся спустя полтора месяца приема АндроДоза (рис. 2). Это было особенно заметно у пациентов, имевших изначально объем эякулята менее 2 мл. Через полтора месяца терапии объем эякулята нормализовался у 66,66% пациентов в целом и у 29,49 и 95,12% пациентов с АСАТ и без АСАТ соответственно (рис. 3).
Через полтора месяца терапии вязкость эякулята нормализовалась у 18,4% пациентов с исходно измененным показателем (длина нити менее 20 мм) в целом и у 16,8 и 20,4% пациентов с АСАТ и без АСАТ соответственно (рис. 4). Наблюдалась положительная динамика и количественных характеристик сперматозоидов.
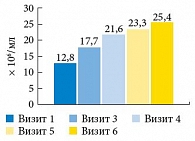
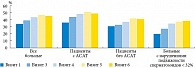
Cтатистически значимое повышение количества сперматозоидов в 1 мл эякулята было выявлено уже через полтора месяца после начала приема АндроДоза. Кроме того, выраженность эффекта усиливалась по мере продолжительности терапии до трех месяцев с сохранением достигнутых показателей в последующем периоде наблюдения (рис. 5).
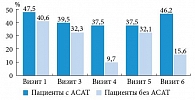
При последующем наблюдении за пациентами отмечен эффект последействия с дальнейшей положительной динамикой: через три месяца после окончания терапии концентрация сперматозоидов в эякуляте нормализовалась у 48,48 и 100% пациентов в группах с АСАТ и без АСАТ соответственно (рис. 6).
Положительная динамика наблюдалась и в качественных характеристиках сперматозоидов: подвижности, жизнеспособности и морфологии. К окончанию исследования количество пациентов с исходно сниженным количеством жизнеспособных сперматозоидов (< 58%) уменьшилось в 2,29 раза в группе пациентов без АСАТ и в 1,95 раза в группе пациентов с АСАТ (рис. 7).
Прогресс был отмечен и в подвижности сперматозоидов. Наиболее выраженная положительная динамика выявлена среди пациентов с исходно сниженным количеством сперматозоидов с прогрессивным движением (< 32%), где показатель увеличился в 1,74 раза по сравнению с исходным уровнем, причем эффект сохранялся и после окончания терапии (рис. 8).
При исследовании общего количества патологических форм сперматозоидов к моменту завершения терапии было выявлено статистически значимое снижение количества патологических форм в обеих подгруппах, сохраняющееся в течение всего периода наблюдения и наиболее выраженное (увеличение на 26,32%) через полтора месяца терапии среди пациентов с исходно повышенным содержанием патологических форм сперматозоидов (> 96%) (рис. 9).
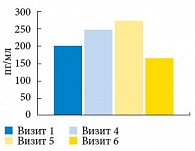
Достоверность положительных изменений количественных и качественных показателей сперматозоидов подтверждается повышением концентрации ингибина В в сыворотке крови. Ингибин В, гликопротеин, синтезируемый преимущественно клетками Сертоли, является более ранним и диагностически значимым маркером состояния сперматогенеза и нарушения фертильности у мужчин, чем фолликулостимулирующий гормон (маркером функции клеток Сертоли). Низкий уровень ингибина В и повышенный фолликулостимулирующий гормон всегда сопровождаются нарушением сперматогенеза. По этой причине рост концентрации ингибина В свидетельствует об улучшении сперматогенеза на фоне проводимой терапии.
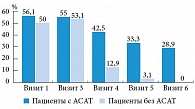
В группе пациентов с отсутствием АСАТ в эякуляте выявлено статистически достоверное повышение концентрации ингибина В, причем к моменту завершения курса лечения увеличение составило 21,7% (рис. 10).
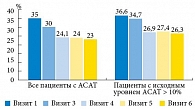
Имеются данные, что гиперпродукция активных форм кислорода в эякуляте сопровождается более выраженными аутоиммунными реакциями, то есть интенсивность окислительного стресса прямо пропорциональна образованию АСАТ. Если принять это утверждение за истину, то снижение уровня АСАТ в эякуляте может свидетельствовать об уменьшении силы окислительных реакций и, соответственно, об эффективности проводимой антиоксидантной терапии.
В обеих подгруппах (с наличием АСАТ более 10% и не более 10%) наблюдалось снижение уровня АСАТ. Изменения были статистически значимыми в группе пациентов с АСАТ более 10% (титр АСАТ в среднем снизился на 26,5%, р < 0,05) и сохранялись через три месяца терапии с удержанием достигнутого эффекта через полтора месяца наблюдения (рис. 11).
В процессе наблюдения за пациентами ни одного нежелательного явления или побочной реакции при приеме АндроДоза выявлено не было.
У восьми партнерш пациентов обеих групп в ходе исследования на фоне приема АндроДоза наступили беременности (10,9%), одна из которых завершилась выкидышем на сроке шести-семи недель. Семь других протекали нормально и были прослежены до срока пять месяцев.
Заключение
Курсовое назначение АндроДоза при различных вариантах патоспермии у мужчин положительно влияет на процессы сперматогенеза, за счет чего статистически значимо улучшаются количественные и качественные характеристики эякулята. Именно поэтому АндроДоз может быть рекомендован к применению в качестве средства первой линии терапии при идиопатической патоспермии (с наличием иммунологического фактора инфертильности и без, а также с тератозооспермией).
АндроДоз хорошо переносится пациентами и не сопровождается развитием нежелательных явлений, что позволяет применять его в течение длительного времени, а также проводить повторные курсы при наличии положительного клинического эффекта.
Therapy of Idiopathic Pathospermia
S.D. Dorofeyev, Ye.A. Yefremov, V.V. Simakov
Scientific Research Institute of Urology and Interventional Radiology named after N.A. Lopatkin of the National Medical Research Radiology Center
Contact person: Sergey Dmitriyevich Dorofeyev, konfandrology@rambler.ru
Efficacy and safety of AndroDoz as a complex additive in patients with idiopathic and other types of pathospermia with/without anti-sperm antibodies (ASA) in ejaculate were examined. All characteristics of spermatozoa (both quantitative and qualitative) and perisperm plasm were improved. Ejaculate volume was noted to progressively increase, especially in patients who had it lower than normal range at baseline. Concentration of spermatozoa was increased as early as 1.5 months after the onset of therapy with AndroDoz. Abundance of vital spermatozoa was increased as well. A marked positive dynamics of sperm motility was observed among patients having initially decreased amount of spermatozoa with progressive movement, so that such effect was sustained even after completing the therapy. A substantially increased amount of normal spermatozoa was also noted in patients with the baseline elevation of their pathological types. Patients having ASA were observed to have lower amount of spermatozoa. Significance of changes for quantitative and qualitative parameters of spermatozoa was confirmed by elevated concentration of inhibin B. In both groups, eight sexual partners of male patients were found to become pregnant including one miscarriage, whereas other females had a normal course of pregnancy, with a 5-month follow-up.
AndroDoz may be recommended for use as a first-aid therapeutic drug during idiopathic pathospermia (with/without immunologic infertility factor). AndroDoz is well tolerated by patients, has no side effects that let to use it for a long period of time.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.