Трудности диагностики и лечения аутоиммунного панкреатита: клиническое наблюдение
- Аннотация
- Статья
- Ссылки
- English

Введение
Аутоиммунный панкреатит (АИП) относят к редким заболеваниям поджелудочной железы (ПЖ). Реальная распространенность этого заболевания неизвестна. По некоторым данным, АИП составляет более 5–10% случаев панкреатита, а предполагаемая распространенность – примерно 1–2 на 100 тыс. человек [1, 2]. При этом приблизительно у 2% больных, оперированных по поводу опухоли ПЖ, диагностируют АИП [1]. Выделяют два типа АИП: 1) лимфоплазмоцитарно-склерозирующий и 2) идиопатический протоковый центральный [3]. АИП первого типа рассматривают как одно из проявлений IgG4-ассоциированной патологии, а АИП второго типа системным заболеванием не является. Однако в 15–30% случаев АИП второго типа бывает связан с воспалительными заболеваниями кишечника, чаще – язвенным колитом [4]. АИП второго типа встречается значительно реже АИП первого типа, при этом их практически невозможно различить по данным визуализации и они имеют схожие клинические проявления. Однако считается, что АИП первого типа обычно более агрессивен и имеет более высокую частоту рецидивов после стероидной терапии [1]. Выделяют пять основных признаков АИП, наиболее полно характеризующих АИП первого типа: гистологический, данные визуализации, серологический, поражение других органов и ответ на стероидную терапию [5].
Гистологические признаки АИП первого типа – картина лимфоплазмоцитарного склерозирующего панкреатита без гранулоцитарных эпителиальных поражений – муароформный фиброз, облитерирующий флебит и обильная инфильтрация IgG4-позитивными плазматическими клетками (более десяти в поле зрения при большом увеличении). АИП второго типа характеризуется гранулоцитарной инфильтрацией стенки протока и минимальной или отсутствующей инфильтрацией IgG4-позитивными клетками в ткани ПЖ [6].
По данным визуализации (ультразвуковое исследование (УЗИ), компьютерная томография, эндосонография, магнитно-резонансная холангиопанкреатография (МРХПГ) и др.) определяется «колбасообразное» увеличение ПЖ при диффузной форме АИП, причем характерным отличительным признаком АИП первого типа при компьютерной томографии является гипоэхогенный ободок, отражающий фиброзно-воспалительные изменения с вовлечением перипанкреатической жировой ткани [7]. При диффузной форме АИП главный панкреатический проток (ГПП) не расширен, он может не визуализироваться. Возможно очаговое поражение ПЖ при АИП, в этом случае необходимо проведение дифференциальной диагностики между АИП и раком ПЖ [8].
АИП первого типа считается проявлением IgG4-связанной склерозирующей болезни, и его серологическим признаком является повышение сывороточного иммуноглобулина G4 (IgG4). При этом повышение IgG4 выше нормы было выявлено также и при раке ПЖ, у больных хроническим панкреатитом, первичным билиарным циррозом, первичным склерозирующим холангитом или синдромом Шегрена [9]. Диагностически достоверным для АИП считается повышение уровня IgG4 более чем в два раза по сравнению с нормой. Однако описаны случаи АИП первого типа с типичными гистологическими признаками без повышения сывороточного IgG4. В связи с этим IgG4 нельзя считать абсолютным критерием для установления диагноза АИП [6].
Для АИП первого типа характерно вовлечение других органов, наиболее частые экстрапанкреатические поражения – склерозирующий холангит, грудная и брюшная лимфаденопатия, сиалоаденит, различные поражения легких, забрюшинный фиброз [10]. Воспалительные заболевания кишечника, как правило, не сопровождают АИП первого типа, тогда как АИП второго типа может иметь связь с язвенным колитом или болезнью Крона [11], а вовлечение других органов, как правило, не встречается.
Основным методом лечения АИП является применение кортикостероидов [12]. Глюкокортикоиды являются препаратами первой линии для индукции ремиссии, если нет противопоказаний к их применению [13]. Назначаются высокие дозы преднизолона: 30–40 мг/кг в сутки либо из расчета 0,6–1,0 мг/кг в сутки в течение двух – четырех недель с дальнейшим снижением по 5 мг каждые одну-две недели до поддерживающей дозы 5–7,5 мг/кг в сутки. Поддерживающая доза назначается, по данным различных авторов, от 12 недель до трех лет [6]. При этом единого мнения о продолжительности начальной и поддерживающей терапии у исследователей нет. Тем не менее у пациентов, успешно пролеченных стероидной индукционной терапией, может наблюдаться рецидив заболевания в 33% случаев. В этих условиях поддерживающая терапия низкими дозами стероидов в течение более одного года может снизить риск рецидива [14, 15].
Ремиссию АИП оценивают по ряду критериев: симптоматическая, серологическая ремиссия; нормализация размеров и структуры ПЖ; гистологическая и функциональная ремиссия [16, 17]. Окончательное разрешение серологических, рентгенологических, гистологических отклонений и клинических симптомов свидетельствует о полной ремиссии. Однако ввиду сложности выполнения биопсии ПЖ гистологическую ремиссию подтвердить достаточно сложно [18]. Поэтому на практике полной ремиссией считают клиническую, серологическую и восстановление размеров и структуры ПЖ по данным методик визуализации [16, 19].
У больных АИП в начале заболевания может развиться экзокринная и/или эндокринная недостаточность ПЖ, однако эти функции ПЖ могут улучшаться на фоне стероидной терапии [20, 21].
Клиническое наблюдение
В июне 2022 г. в отделение патологии ПЖ и желчевыводящих путей Московского клинического научного центра (МКНЦ) им. А.С. Логинова был госпитализирован мужчина 51 года. При поступлении он предъявлял жалобы на общую слабость, изжогу, спастические боли в эпигастральной области, усиливающиеся после еды, вздутие и урчание в животе, кашицеобразный стул до пяти-шести раз в сутки, снижение массы тела за год на 6 кг.
Из анамнеза известно, что в феврале 2021 г. после стрессовых ситуаций и перенесенной инфекции COVID-19 у пациента появились изжога, ощущение кома в горле. Мужчина обратился к гастроэнтерологу по месту жительства. Была проведена эзофагогастродуоденоскопия (ЭГДС), по данным которой был выявлен эрозивный рефлюкс-эзофагит. По данным рентгенологического исследования верхних отделов желудочно-кишечного тракта были выявлены признаки нефиксированной аксиальной кардиальной грыжи пищеводного отверстия диафрагмы, диффузный эзофагоспазм первой степени, дискинезия двенадцатиперстной кишки. Гастроэнтерологом была назначена терапия ингибиторами протонной помпы и анксиолитиками. На фоне лечения изжога и ощущение кома в горле у пациента прошли.
В июне 2022 г. пациент отметил появление общей слабости, изжоги, боли в эпигастральной области, усиливающейся после еды, вздутия и урчания в животе, кашицеобразного стула до пяти-шести раз в сутки. Также были предъявлены жалобы на снижение массы тела на 6 кг за последние несколько месяцев, в связи с чем обратился в клинико-диагностическое отделение МКНЦ. По данным биохимического анализа крови было выявлено наличие синдрома цитолиза: аланинаминотрансфераза (АЛТ) – 306,6 (норма – до 50,0) Ед/л, аспартатаминотрансфераза (АСТ) – 119,6 (норма – до 50,0) Ед/л и холестаза: гамма-глутамилтранспептидаза (ГГТП) – 841,4 (норма – до 55) Ед/л, щелочная фосфатаза (ЩФ) – 517,9 (норма 30,0–120,0) Ед/л, в связи с чем для дообследования и лечения пациент был госпитализирован.
По данным объективного осмотра обращала на себя внимание болезненность в эпигастральной области при глубокой пальпации.
Пациент не курит и не употребляет алкоголь. При поступлении в клиническом анализе крови значимых отклонений выявлено не было, а в биохимическом анализе крови обращало на себя внимание повышение уровня амилазы крови до 155,4 (норма – до 100) Ед/л, липазы крови до 316,2 (норма – 0–60) Ед/л и нарастание маркеров холестаза: ГГТП до 935,9 Ед/л, ЩФ – 562,7 Ед/л; уровень билирубина был в пределах референсных значений. Также было отмечено повышение диастазы мочи до 1014 (норма – до 490) Ед/л. Уровень глюкозы и гликозилированный гемоглобин – в пределах нормы: 5,3 ммоль/л и 5,9% соответственно. Также было выявлено снижение фекальной эластазы Е1 до 2,4 (норма – более 200) мкг/г. СА 19-9 – в пределах референсных значений.
При ЭГДС выявлен атрофический гастрит.
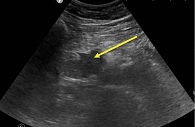
УЗИ органов брюшной полости: в брюшной полости и полости малого таза на момент осмотра свободной и осумкованной жидкости не выявлено. Печень в размерах увеличена: переднезадний размер правой доли – 158 мм, левой – 87 мм. Контуры ровные, четкие, края округлены, структура паренхимы диффузно неоднородная, неравномерно повышенной эхогенности. Сосудистый рисунок сохранен. Воротная вена – 11,7 мм. Внутрипеченочные желчные протоки незначительно подчеркнуты, местами расширены до 2–3 мм. Гепатикохоледох диаметром до 8 мм в ретродуоденальном отделе, на уровне интрапанкреатической части сужается по типу «писчего пера» до 3 мм, стенки уплотнены, подчеркнуто гиперэхогенные, толщиной до 2 мм, в просвете эхогенная взвесь. Желчный пузырь увеличен (89 × 26 мм), по форме «бумеранга», стенки неравномерно утолщены, гиперэхогенные, содержимое неоднородное вследствие наличия пристеночного «замазкообразного» осадка. ПЖ увеличена в размерах, в основном за счет головки, которая представлена гипоэхогенным образованием округленной формы с неровным четким контуром, деформирующим общий контур железы, размерами 36 × 33 × 32 мм, неоднородной солидной структуры. Данные изменения структуры в виде понижения эхогенности ткани представлены в дистальных отделах железы; тело – 21 мм, хвост – 27 мм. Контуры на данных участках ровные/четкие, структура диффузно неоднородная, ГПП не дифференцируется. Заключение: признаки очагового образования головки ПЖ. УЗ-картина соответствует опухолевому процессу, однако с учетом распространенного характера изменений железы, отсутствия выраженной панкреатической гипертензии следует дифференцировать аутоиммунный характер изменений. Незначительно выраженная билиарная гипертензия с блоком на уровне интрапанкреатической части гепатикохоледоха. Хронический холецистит, сладжеобразование. Спленомегалия. Регионарная лимфаденопатия (рис. 1).
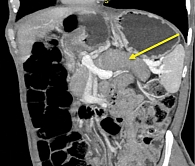
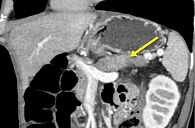
При мультиспиральной компьютерной томографии (МСКТ) брюшной полости с контрастным усилением выявлена картина сглаженности контуров ПЖ и пониженного накопления контрастного препарата хвостом и локально перешейком железы, вероятно, в рамках обострения панкреатита; признаки билиарной гипертензии, участка сужения холедоха в интрапанкреатической части (стриктура?), гепатомегалии. Также в перешейке ПЖ определялся участок пониженного контрастирования размерами около 22 × 23 мм (рис. 2).
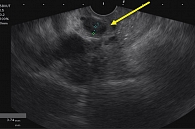
Для детальной оценки билиарного дерева выполнена МРХПГ, по данным которой выявлено фрагментарное прослеживание холедоха в интрапанкреатической части, диаметр в терминальном отделе холедоха до 5 мм, просвет однородный. На расстоянии до 26 мм от терминального отдела холедоха отмечалось локальное нитевидное сужение на протяжении 6,7 мм просвета (вероятно, стриктура). ГПП прослеживался фрагментарно, просвет неравномерный – в хвосте до 4 мм, на остальном протяжении не расширен, боковые ветви единичные до 2 мм (рис. 3).
С учетом данных УЗИ (подозрение на новообразование ПЖ) и МСКТ (утолщение ПЖ без признаков очагового образования и участок пониженного контрастирования в перешейке) следующим этапом в рамках дифференциально-диагностического поиска было решено провести эндоскопическую ультрасонографию.
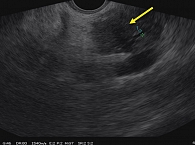
При исследовании были выявлены признаки воспалительных изменений паренхимы ПЖ (АИП); утолщение стенок гепатикохоледоха (признаки холангита); увеличение лимфатических узлов по ходу гепатодуоденальной связки (рис. 4, 5).
Получены результаты анализа крови: IgG4 – 10,8 (норма – 0,1–1,35) мг/мл.
Таким образом, по клиническим проявлениям, данным визуализации, вовлечению других органов и результатам определения уровня IgG4 пациенту был установлен диагноз: «IgG4-ассоциированное заболевание: хронический АИП, ассоциированный с IgG4. Хронический холангит, ассоциированный с IgG4. Внешнесекреторная недостаточность поджелудочной железы тяжелой степени».
Индукция ремиссии проведена метилпреднизолоном 26 мг в сутки в течение восьми недель с последующим снижением дозы по 4 мг в неделю. Дополнительно назначена терапия урсодезоксихолевой кислотой 750 мг в сутки, а также панкреатином в капсулах с минимикросферами в суточной дозе 150 000 Ед.
В сентябре 2022 г. пациент был повторно обследован в МКНЦ.
Боли в верхних отделах живота прошли, стул нормализовался, пациент прибавил в весе 3 кг.
В контрольных лабораторных исследованиях (клиническом и биохимическом анализах крови) – без клинически значимых отклонений. Фекальная эластаза составила 42 мкг/г при норме более 200.
Уровень IgG4 на фоне лечения снизился с 10,8 до 4,1 г/л (норма – 0,1–1,35).
При контрольной МСКТ брюшной полости с контрастным усилением отмечено уменьшение размеров ПЖ и выраженности инфильтрации парапанкреатической клетчатки. Дольчатость структуры железы с тенденцией к восстановлению (рис. 6).
По данным МРХПГ расширения ГПП не отмечалось.
На момент повторного обследования пациент получал метилпреднизолон в дозе 20 мг в сутки. Далее было рекомендовано продолжить снижение дозы на 4 мг каждые две недели до поддерживающей дозы 4 мг в сутки.
Пациент повторно обследован через четыре месяца. Жалоб не предъявлял. Отмечал хорошее самочувствие и прибавку в весе 7 кг. В клиническом и биохимическом анализах крови все показатели были в пределах референсных значений. С-пептид – 1,45 (норма – 1,1–4,4) нг/мл; IgG4 – 2,5 г/л.
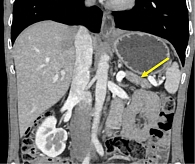
По данным МСКТ, отмечались нормализация размеров и выравнивание структуры ПЖ до более однородной, регресс гиподенсного участка в перешейке железы и уменьшение размеров гиподенсного участка в хвосте железы, отсутствие билиарной гипертензии (рис. 7).
Пациент выписан с рекомендациями продолжения приема поддерживающей дозы метилпреднизолона 4 мг в сутки в течение года.
Обсуждение
На первом этапе диагностики было заподозрено новообразование ПЖ вследствие схожих с опухолью проявлений, таких как общая слабость, боль в эпигастральной области, снижение массы тела при нарастании в крови маркеров холестаза [22]. По данным УЗИ было заподозрено наличие очагового образования головки ПЖ и незначительно выраженная билиарная гипертензия с блоком на уровне интрапанкреатической части гепатикохоледоха, что в сочетании с повышением маркеров холестаза свидетельствовало о наличии механического препятствия оттоку желчи.
Проводили диагностический поиск, в дифференциально-диагностический ряд были включены новообразование панкреатобилиарной зоны, псевдотуморозный панкреатит, АИП. Для установления диагноза потребовался весь спектр инструментальных исследований (МСКТ брюшной полости с контрастным усилением, МРХПГ, эндоУЗИ) и серологические исследования.
С учетом данных визуализации и диагностически значимого повышения уровня IgG4, гистологического подтверждения диагноза не потребовалось. Пациенту была назначена стандартная стероидная терапия [23] для индукции ремиссии. Согласно опыту некоторых японских и корейских ученых [24], а также отечественных авторов [25], длительность лечения составила восемь недель, после чего суточная доза постепенно снижалась. При контрольных обследованиях зафиксирован положительный ответ в виде уменьшения размеров ПЖ и нормализации размеров главного панкреатического протока по данным визуализации. Отмечено снижение уровня IgG4 с 10,8 до 2,5 г/л. Таким образом, ответ на стероидную терапию подтверждает диагноз АИП, согласно критериям HISORt [5].
У пациента на фоне лечения было отмечено повышение уровня панкреатической эластазы в кале с 2,4 до 42,2 мкг/г, что могло свидетельствовать о некотором улучшении функции ПЖ. Факт улучшения экзо- и эндокринной функций ПЖ на фоне стероидной терапии продемонстрирован проведенными ранее исследованиями T. Kamisawa и соавт. [22], L. Frulloni и соавт. [21] и др. Следует заметить, что у нашего пациента не было зафиксированного нарушения углеводного обмена, то есть эндокринная функция ПЖ не была нарушена.
В результате лечения была достигнута клиническая ремиссия (нормализация уровня маркеров холестаза, разрешение клинических симптомов), серологическая ремиссия (снижение уровня IgG4 ниже диагностического титра) и нормализация размеров ПЖ по данным УЗИ и МСКТ. В данном случае можно говорить о полной ремиссии [16]. В настоящее время пациент получает поддерживающую терапию 4 мг метилпреднизолона в сутки. С учетом хорошей переносимости, отсутствия побочных эффектов и данных о высокой вероятности рецидива [26] запланировано продолжить лечение поддерживающей дозой метилпреднизолона в течение трех лет.
Представленное наблюдение демонстрирует сложность дифференциальной диагностики АИП и новообразования ПЖ, имеющих сходную клиническую картину в виде слабости, снижения массы тела, явлений холестаза как признака обтурации желчных путей и характерные сонографические проявления. Диагноз был установлен на начальной стадии заболевания, а назначенное лечение подтвердило диагностическую концепцию и позволило быстро достигнуть ремиссии.
I.V. Savina, E.A. Dubtsova, PhD, M.A. Kiryukova, D.S. Bordin, PhD, Prof., T.V. Zhurenkova, E.V. Parfenchikova, PhD, L.V. Vinokurova, PhD
A.S. Loginov Moscow Clinical Scientific Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University
Contact person: Irina V. Savina, i.savina@mknc.ru
Diagnostics of pancreatic diseases represents a difficult task for doctors in multiple fields. Autoimmune pancreatitis is one of the hardest to diagnose among other pancreatic diseases, as it is a rare disease and can mimic groove pancreatitis or pancreatic cancer. Similar manifestation, laboratory changes pattern, and data of imaging methods become peculiarities of differential diagnosis. The article presents a clinical case of difficulties in diagnosing autoimmune pancreatitis at its early stages.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.