количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Трудности диагностики и терапии бронхиальной астмы у детей
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Пульмонология и оториноларингология" №1
- Аннотация
- Статья
- Ссылки
Диагностика бронхиальной астмы (БА) у детей, в особенности у детей первых пяти лет жизни, часто вызывает трудности. Эксперты Глобальной стратегии по лечению и профилактике бронхиальной астмы (Global Initiative for Asthma, GINA) связывают сложности в постановке диагноза с широкой распространенностью эпизодов свистящих хрипов в грудной клетке, преимущественно в возрасте младше 3 лет; ограниченной возможностью или невозможностью тестирования функции легких. Используемые терапевтические и профилактические методы также имеют возрастную специфичность.
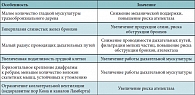
Таблица 1. Анатомо-физиологические особенности органов дыхания у детей по сравнению со взрослыми и их значение для развития бронхиальной обструкции*

Таблица 2. Фенотипы свистящих хрипов у детей младше 5 лет*
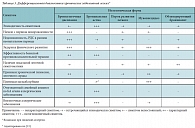
Таблица 3. Дифференциальная диагностика хронических заболеваний легких*
Бронхиальная астма (БА) является наиболее распространенным хроническим заболеванием детского возраста, представляя собой важную проблему здравоохранения. В целом БА страдают от 5 до 10% детского населения, две трети всех пациентов заболевают в первые 3 года жизни [1]. У 50–80% детей с БА первые симптомы появляются в возрасте младше 5 лет [2]. Эпидемиология БА у детей характеризуется увеличением частоты случаев БА, обращений за медицинской помощью, нарушением качества жизни, более выраженным по сравнению с детьми старшего возраста и взрослыми. Распространенность БА увеличивается, в частности, у дошкольников. Так, в США распространенность БА у детей в возрасте 4 лет и младше возросла с 1980 по 1999 г. на 83%; в это же время распространенность БА у детей в возрасте 5–14 лет увеличилась только на 25% [3]. По данным аудита БА, проведенного в 2001 г. в рамках Национальной кампании по борьбе с астмой в Великобритании, на фоне значительного увеличения количества обращений к врачу общей практики по поводу первых или еженедельно возникающих эпизодов БА за последние 25 лет отмечается особенно выраженный рост числа таких обращений среди детей дошкольного возраста.
Частота консультаций детей дошкольного возраста у врачей общей практики была самой высокой среди всех возрастных групп и составляла 192 в неделю на 100 тыс. детей в возрасте от 0 до 4 лет, 188 в неделю на 100 тыс. детей в возрасте 5–14 лет и 109 для взрослых в возрасте 15–44 лет. Распространенность БА и хрипов в грудной клетке у детей также увеличилась за последние 30 лет; результаты аудита показали, что у детей в возрасте 7–8 лет частота выявления хрипов в грудной клетке увеличилась с 11% в 1973 г. до 13% в 1988 г. У детей в возрасте от 1 года до 5 лет распространенность хрипов возросла с 12% в 1990 г. до 26% в 1998 г. Частота госпитализаций по поводу БА у детей дошкольного возраста значительно увеличилась в период с 1960-х до конца 1980-х гг., хотя в настоящее время отмечена тенденция к их снижению. Тем не менее нынешняя частота госпитализаций детей дошкольного возраста по поводу БА в Великобритании все еще более чем в три раза превосходит частоту госпитализаций детей старшего возраста и в шесть раз – частоту госпитализаций взрослых [4].
Предрасполагающие факторы и патогенез
Бронхиальная астма у детей – заболевание, развивающееся на основе хронического аллергического воспаления бронхов, их гиперреактивности и характеризующееся периодически возникающими приступами затрудненного дыхания или удушья в результате распространенной бронхиальной обструкции, обусловленной бронхоконстрикцией, гиперсекрецией слизи, отеком стенки бронхов. Гиперреактивность бронхов – сужение дыхательных путей в ответ на провокационные факторы. Данное определение и концепция астмы как хронического воспалительного заболевания дыхательных путей сложились в течение последних десятилетий на основании гистологических и иммунохимических исследований биоптатов бронхиальной стенки, бронхолаважной жидкости, полученной при обострении заболевания, и аутопсийного материала от умерших больных, страдавших БА.
Иммунологической основой аллергического воспаления при БА является поляризация CD4+ Т-лимфоцитов в сторону субпопуляции Т-хелперов 2 типа (Тh2). Эти клетки под воздействием аллергенных стимулов продуцируют интерлейкины (ИЛ) – ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10, суммарное действие которых проявляется в повышенной продукции IgE-антител. В последующем IgE-антитела фиксируются на рекрутируемых под действием этих же цитокинов в дыхательные пути тучных клетках, базофилах и эозинофилах. Соотношение Т-хелперов 1 типа (Тh1) и Тh2 в разные возрастные периоды имеет определенные различия. Если у здоровых взрослых отмечается относительное преобладание Тh1 и отношение Тh2:Тh1 составляет 3:4 в периферической крови, то в пуповинной крови это отношение (10–100):1, то есть для плода и новорожденного ребенка характерна Тh2-поляризация, которая чрезвычайно важна для физиологического течения беременности.
Доминирование в конце внутриутробной жизни выработки Тh2 носит адаптивный характер и направлено на защиту плаценты от потенциальной токсичности Тh1. Это доминирование персистирует еще в течение какого-то времени после рождения. В течение этого времени ребенок предрасположен к развитию атопии, отмечается феномен "открытого окна" для внешней сенсибилизации и манифестации атопических заболеваний (атопический дерматит, бронхиальная астма). Атопический дерматит (АД) является первым проявлением "атопического марша", под которым понимают последовательную смену органов-мишеней аллергического воспаления (кожа, слизистые оболочки бронхов, носа). Эпикутанная сенсибилизация, формирующаяся при АД, сопровождается не только локальным воспалением кожи, но и системным иммунным ответом с вовлечением различных отделов респираторного тракта. Это приводит к развитию БА у пациентов с АД. Одновременно с этим меняется и спектр сенсибилизации со стартовой пищевой, характерной для АД, на сенсибилизацию к аэроаллергенам, типичную для БА. Вместе с тем большая часть больных вплоть до подросткового возраста страдают дермо-респираторным синдромом.
Таким образом, онтогенетические особенности иммунной системы у детей первых лет жизни являются основой легкого возникновения БА в данной возрастной группе. Многие гены, принимающие участие в синтезе IgE и ремоделировании дыхательных путей, могут быть "законсервированными" фетальными генами, которые не были подавлены в раннем младенческом периоде [5]. Как показывают современные исследования тяжелой БА, ее течение имеет определенные клинические особенности в различных возрастных группах, в связи с чем выделяются три возраст-специфических фенотипа тяжелой БА у детей: младенческая, ранняя школьная и подростковая [6]. В основе возрастной гетерогенности лежит эволюция иммунного воспаления и морфологических изменений в бронхах от острого воспаления у младенцев через хроническое воспаление у школьников к ремоделированию стенки бронхов у подростков [7]. Другой группой причин, определяющих возрастную специфику БА у детей первых лет жизни, являются анатомо-физиологические особенности органов дыхания (табл. 1), предрасполагающие, прежде всего, к частому развитию бронхообструктивного синдрома (БОС).
Диагностика
Широкая распространенность эпизодов свистящих хрипов в грудной клетке и кашля даже в отсутствие БА у детей, особенно в возрасте младше 3 лет, является ведущей причиной трудности диагностики данного заболевания в детском возрасте. Частоту заболеваний, протекающих с БОС/свистящими хрипами, иллюстрируют следующие данные: в возрасте до одного года их переносят 20% детей, до трех лет – 33%, к шести годам – каждый второй ребенок [8]. В связи со столь высокой частотой БОС/свистящих хрипов у детей и на основании изучения их эпидемиологии и естественного течения эксперты GINA (2006) выделяют три их фенотипа у детей в возрастной группе младше 5 лет (табл. 2) [9]. Результаты крупных эпидемиологических исследований свидетельствуют, что диагностика БА часто оказывается несвоевременной. Так, например, продолжительность периода между первыми симптомами болезни и установлением диагноза в среднем превышает 4 года. Для детей первых лет жизни справедливо общее педиатрическое правило: "чем младше возраст ребенка, тем вероятнее, что БОС/свистящие хрипы у него не являются БА". Этот тезис диаметрально противоположен актуальному для взрослых пациентов правилу диагностики астмы: "всякий повторный БОС следует считать БА, пока не будет доказано обратное" [10].
Самой частой причиной острой бронхиальной обструкции у детей является острый бронхиолит, преимущественно респираторно-синцитиальной вирусной этиологии. Например, в США его переносят ежегодно 21% детей в возрасте до года [11]. Среди хронических заболеваний, проявляющихся БОС, при проведении дифференциального диагноза следует иметь в виду бронхолегочную дисплазию, бронхоэктатическую болезнь, аспирацию вследствие гастроэзофагеальной рефлюксной болезни, дисфункции глотки, муковисцидоз, облитерирующий бронхиолит, иммунодефициты, анатомические аномалии, первичную цилиарную дискинезию, врожденные пороки сердца с гиперволемией малого круга кровообращения [12]. Дифференциально-диагностические критерии некоторых хронических заболеваний легких, манифестирующих БОС, представлены в таблице 3 [13]. Ряд клинико-анамнестических и лабораторно-инструментальных признаков делают более вероятной диагностическую гипотезу о том, что БОС у данного пациента не является БА. К ним относятся следующие:
- начало симптомов с рождения;
- искусственная вентиляция легких, респираторный дистресс-синдром в неонатальном периоде;
- неврологическая дисфункция;
- отсутствие эффекта от терапии глюкокортикостероидами;
- свистящие хрипы, связанные с кормлением или рвотой, затруднение глотания и/или рвота;
- диарея;
- плохая прибавка массы тела;
- длительная оксигенотерапия;
- деформация пальцев рук ("барабанные палочки", "часовые стекла");
- шумы в сердце;
- стридор;
- локальные изменения в легких;
- цианоз;
- необратимость обструкции дыхательных путей;
- персистирующие рентгенологические изменения [14].
- аллергодиагностика in vivo/in vitro;
- рентгенография органов грудной клетки;
- 24-часовая рН-метрия;
- эзофагогастродуоденоскопия;
- потовый тест;
- генетическое исследование на муковисцидоз;
- морфологическое исследование респираторного эпителия;
- трахеобронхоскопия;
- высокоразрешающая компьютерная томография легких;
- ультразвуковое исследование сердца;
- серологические исследования на респираторные инфекции;
- исследование иммунного статуса [12].
Также необходимо оценивать эффект элиминации и применения бета-2-агонистов (быстрая положительная динамика клинических симптомов бронхиальной обструкции после прекращения контакта с причинно-значимым аллергеном, например, при госпитализации, после ингаляции). Как правило, аллергическая этиология бронхиальной обструкции подтверждается ретроспективно. Так, среди группы часто болеющих детей, в том числе переносивших рецидивирующий бронхит, при тщательном обследовании до 40% составили дети с недиагностированной БА [15]. В то же время тяжелый бронхиолит является фактором риска развития БА у детей. В группу повышенного риска попадают 14% детей, у которых регистрировались свистящие хрипы в раннем возрасте. К группе риска БА, по данным классического Тусонского исследования, относятся дети младшего возраста с частыми повторными эпизодами свистящего дыхания. Положительный прогностический индекс астмы имеют дети до 3 лет с частыми эпизодами хрипов и одним большим (наличие БА или АД/экземы у родителей) или двумя малыми критериями (эозинофилия 4% и выше, наличие хрипов вне связи с вирусной инфекцией дыхательных путей, аллергический ринит).
Предсказательная ценность положительного результата для 6-летних детей по БА составила 48%. В свою очередь, у детей с отрицательным прогностическим индексом предсказательная ценность отрицательного результата по БА – 92% [16]. Большим достижением в разработке диагностических критериев БА у детей явились Международные рекомендации по БА у детей рабочей группы из 44 экспертов из 20 стран Practical Allergology Pediatric Asthma Group (PRACTALL) [17]. Согласно этому документу, персистирующая БА диагностируется при сочетании бронхиальной обструкции со следующими факторами: клиническими проявлениями атопии (экзема, аллергический ринит, конъюнктивит, пищевая аллергия), эозинофилией и/или повышенным уровнем общего IgЕ в крови (в этой связи необходимо отметить, что эксперты GINA (2006) не считают повышение общего IgЕ маркером атопии в связи с высокой вариабельностью данного показателя [9]); специфической IgE-опосредованной сенсибилизацией к пищевым аллергенам в грудном и раннем детском возрасте и к ингаляционным аллергенам в последующем; сенсибилизацией к ингаляционным аллергенам в возрасте до 3 лет, прежде всего при сенсибилизации и высоком уровне экспозиции бытовых аллергенов в домашних условиях; наличием БА у родителей.
Кроме критериев диагноза в документе PRACTALL выделяются различные фенотипы БА у детей в возрасте старше 2 лет, распознавание которых может помочь в более точной оценке прогноза и стратегий терапии заболевания. Первый вопрос, который должен быть задан: чувствует ли ребенок себя здоровым в период между развитием симптоматики заболевания? Если ответ на данный вопрос утвердительный, следует в первую очередь рассмотреть возможность наличия вирус-индуцированной БА и БА, индуцированной физической нагрузкой. Для любого из этих фенотипов является возможным наличие у ребенка атопических состояний, что должно быть проверено. Если ребенок не чувствует себя здоровым в периоды между появлением клинической симптоматики и не соответствует критериям двух вышеуказанных фенотипов, возможно наличие у него клинически актуальной сенсибилизации – БА, индуцированной аллергеном, или БА неизвестной этиологии.
В последнем случае возможен широкий спектр этиологических факторов, включая экспозицию неизвестных аллергенов или раздражающих веществ. Таким образом, среди детей дошкольного возраста (от 3 до 5 лет) стойкость проявлений БА в течение года является ключевым дифференциальным признаком фенотипа заболевания. В согласованном отчете рекомендуется выполнение исследований скарификационных тестов или определение специфических IgE in vitro. Выявление сенсибилизации является подтверждением фенотипа аллерген-индуцированной БА. Отсутствие специфичного аллергического триггера может указывать на фенотип неаллергической БА. Однако вероятность данного фенотипа необходимо рассматривать с осторожностью, поскольку невозможность идентифицировать аллергический триггерный феномен может являться лишь свидетельством того, что он просто не был обнаружен.
Терапия
Лечение БА базируется на "трех китах" – ограничении контакта с аллергенами (комплекс элиминационных мероприятий), терапии обострения заболевания и базисной противовоспалительной терапии. Для лечения БА у детей используются такие же классы препаратов, как и у взрослых. Однако применение существующих препаратов у детей связано с определенными ограничениями, касающимися как терапии острой астмы (обострения заболевания), так и базисной (контролирующей) терапии. В базисной терапии, согласно положениям Национальной программы по БА 2008 г., нуждаются пациенты с персистирующим течением заболевания. Кромоны, помимо недостаточной доказательной базы эффективности, в особенности в дошкольном возрасте [9], имеют ряд недостатков, которые могут повлиять на выполнение врачебных рекомендаций пациентами, в том числе необходимость частого введения (4 раза в сутки – кромоглициевая кислота) и неприятный вкус недокромила натрия, о котором сообщали до 20% больных.
Между тем известно, что такие факторы, как сложность введения лекарственных препаратов и частота дозирования, взаимосвязаны с низкой приверженностью пациентов к терапии. Низкая комплаентность в этих случаях – одна из причин того, что препарат, эффективный в идеальных условиях клинического исследования, оказывается неэффективным в реальной клинической практике. Поэтому новые эффективные, хорошо переносимые и простые в применении лекарственные средства могут улучшить выполнение рекомендаций врача у детей с персистирующей БА. К ним относится прежде всего антагонист лейкотриеновых рецепторов монтелукаст натрия (Сингуляр). Согласно рекомендациям GINA (2006), антилейкотриеновые препараты и ингаляционные кортикостероиды в низких дозах относятся к препаратам первой линии в группе контролирующих течение заболевания [9]. Однако следует помнить, что препарат не может заменить бронхолитики и применяться для купирования приступов.
У детей в возрасте 5 лет и младше для введения ингаляционных лекарственных средств рекомендовано использование спейсера с лицевой маской. Этот метод более прост, чем использование дозирующего аэрозольного ингалятора, однако для него характерна вариабельность поступления лекарственного препарата в зависимости от используемого устройства. Небулайзеры не в такой степени, как другие средства доставки, требуют координации действий или сотрудничества пациента и поэтому являются рекомендованными устройствами для введения бета-2-агонистов/М-холинолитиков, будесонида, кромоглициевой кислоты у детей младшего возраста. Небулайзер является оптимальным средством доставки для использования в специализированных отделениях и отделениях интенсивной терапии, а также при оказании неотложной помощи. Предпочтение отдается компрессионным небулайзерам (в ультразвуковых не достигается необходимая экспозиция препаратов, разрушается суспензия будесонида).
Важной характеристикой компрессионных небулайзеров, которую необходимо учитывать при их выборе и выборе режима ингаляций, является размер частиц генерируемого аэрозоля. Частицы размером более 10 мкм осаждаются в ротоглотке, 5–10 мкм – в ротоглотке, гортани и трахее, 2–5 мкм – в нижних дыхательных путях, 0,5–2 мкм – в альвеолах, менее 0,5 мкм – не осаждаются в легких. Таким образом, для терапии БА необходимы ингаляторы, генерирующие аэрозоль с частицами 0,5–5 мкм. Размер частиц может регулироваться как различными режимами (насадками) в одном небулайзере, так и различаться в разных небулайзерах. Преимуществами компрессионных небулайзеров, в отличие от других средств доставки, являются отсутствие необходимости координации вдоха и ингаляции, возможность проведения высокодозной терапии у тяжелых больных, отсутствие фреона, генерация высокодисперсного аэрозоля.
К клиническим преимуществам небулайзерной терапии относятся уверенность в том, что пациент получает адекватную дозу препарата, неинвазивность, непревзойденно быстрое купирование приступов затрудненного дыхания, возможность использования при жизнеугрожающих симптомах, возможность использования в госпитальных и амбулаторных условиях (в последнем случае уменьшается вероятность госпитализации), уменьшение риска системного действия препарата. Недостатками данных устройств могут быть шум при использовании, возможность микробной контаминации, значительная продолжительность ингаляции, которая определяется скоростью подачи газа и объемом ингалируемого раствора (у детей нецелесообразно использование более 2 мл). Стандартные компрессионные небулайзеры при скорости подачи газа 6–8 л/мин доставляют 2 мл раствора за 5–10 мин. Правила использования компрессионных небулайзеров заключаются в следующем:
- младенцам ингаляции проводятся в положении лежа на руках у матери или в кроватке, при этом желательно использовать переходник, удерживающий маску вертикально (предусмотрен в комплекте Pari Boy);
- перед ингаляцией необходимо проверить срок годности препарата, помыть руки;
- использовать в качестве растворителя только стерильный физиологический раствор, для заправки ингаляционного раствора – стерильные шприцы и иглы;
- рекомендуемый объем наполнения небулайзера – 2 мл, это сокращает время ингаляции;
- для ингаляции используется маска, при ингаляции стероидов маска должна максимально прилегать к лицу для ограничения контакта лекарств с глазами, возможна ингаляция в кислородную палатку;
- продолжать ингаляцию до тех пор, пока в камере небулайзера остается жидкость, так как концентрация препарата в конце ингаляции выше;
- после ингаляции стероидов необходимо обработать водой рот, попить воды, умыть лицо.
После ингаляции небулайзер промывают чистой, по возможности стерильной водой, высушивают. Частое промывание небулайзера необходимо для предотвращения кристаллизации препаратов и бактериального загрязнения. Проводится дезинфекция. При использовании небулайзера несколькими пациентами необходимо стерилизовать небулайзер после каждого пациента. В компрессионных небулайзерах не используются нестерильные растворы, включая щелочные и минеральную воду, антигистаминные препараты, аминофиллин, преднизолон, гидрокортизон, дексаметазон для парентерального введения, травяные сборы, эфирные масла. Для купирования остро возникших нарушений бронхиальной проходимости у больных БА используются бета-2-агонисты (формотерол, сальбутамол, фенотерол), антихолинергические препараты (ипратропиума бромид), метилксантины.
Ведущими механизмами обратимой бронхиальной обструкции у детей с БА являются спазм гладкой мускулатуры бронхов, гиперсекреция слизи и отек слизистой оболочки. Последний механизм является ведущим у детей младшего возраста, что в клинической картине проявляется преобладанием влажных хрипов ("влажной" астмы, по выражению основоположника изучения детской астмы в нашей стране профессора С.Г. Звягинцевой). Вместе с тем влияние бронхолитических препаратов на указанные механизмы бронхиальной обструкции различно. Так, бета-2-агонисты и аминофиллин обладают преимущественным действием на бронхоспазм, а М-холинолитики – на отек слизистой оболочки. Данная гетерогенность действия разных бронхолитических препаратов связана с распределением адренергических рецепторов и М-холинорецепторов в респираторном тракте. В бронхах мелкого калибра, в которых доминирует бронхоспазм, преимущественно представлены бета-2-адренорецепторы, в средних и крупных бронхах с преобладающим развитием отека слизистой оболочки – холинорецепторы. Данными обстоятельствами объясняются необходимость, эффективность и преимущества комбинированной (бета-2-агонист/М-холинолитик) бронхолитической терапии у детей.
Применение ипратропиума бромида в лечении детей с острой астмой в отделении неотложной помощи в комбинации с бета-2-агонистами улучшает функцию дыхания, уменьшает время выполнения и число небулайзерных ингаляций, сокращает частоту последующих обращений. В обзорном исследовании у детей до 2-летнего возраста не был доказан достоверный эффект от аэрозоля антихолинергического препарата, но был эффект от использования комбинации ипратропиума бромида и бета-2-агониста [18]. В систематическом обзоре 13 рандомизированных контролируемых исследований, включавших детей с БА в возрасте 18 месяцев – 17 лет, было показано, что при тяжелых приступах БА применение нескольких ингаляций ипратропиума бромида в сочетании с бета-2-агонистом (например, фенотеролом) улучшает показатель ОФВ1 и снижает частоту госпитализаций в большей степени, чем монотерапия бета-2-агонистом; у детей с легкими и среднетяжелыми приступами данная терапия также улучшала показатели респираторной функции [19]. В связи с этим ингаляция ипратропиума бромида рекомендуется у детей с обострением астмы, в особенности при симптомах, рефрактерных к начальным дозам ингаляционных бета-2-агонистов.
Согласно рекомендациям GINA (2011) и Российской национальной программы "Бронхиальная астма у детей. Стратегия лечения и профилактика" (2008), фиксированная комбинация фенотерола и ипратропиума бромида (Беродуал) является препаратом выбора в терапии обострений, хорошо зарекомендовавшим себя у детей начиная с раннего возраста [9, 14]. Для достижения бронхолитического действия при использовании данной комбинации требуется более низкая доза бета-адренергического компонента, что позволяет практически полностью избежать побочных эффектов. В то же время бронхолитический эффект при применении Беродуала выше, чем у исходных препаратов, развивается быстро (через 3–5 мин) и характеризуется продолжительностью до 8 часов. Использование данного препарата позволяет снизить дозы сопутствующих препаратов (бета-2-агонисты, аминофиллин). Сравнительный анализ эффективности терапии обострения БА Беродуалом и Эуфиллином показал быстрое купирование приступа, восстановление показателей пиковой скорости выдоха, явный регресс клинических симптомов обострения астмы при использовании небулизированного Беродуала [20].
Таким образом, БА у детей характеризуется эпидемиологическим и клиническим своеобразием. Сложность ее диагностики связана, прежде всего, с высокой частотой регистрации свистящих хрипов, необходимостью исключения большого числа острых и хронических заболеваний, протекающих с БОС. Высокоэффективным и безопасным препаратом терапии обострений БА у детей является Беродуал.
1. Крюков А.И., Туровский А.Б., Талалайко Ю.В. Синусит в опыте врача общей практики // РМЖ. 2010. № 7. С. 435–438.
2. Пальчун В.Т., Лучихин Л.А., Магомедов М.М. Практическая оториноларингология. М., 2006. 368 с.
3. Нурмухаметов Р.Х. Лечение синуситов // РМЖ. 1999. Т. 7. № 7. С. 5–7.
4. Магомедов М.М., Гуров А.В. Острые гнойные синуситы. Проблемы антибиотикотерапии // Доктор Ру. 2006. № 2. // www.medafarm.ru/php/content.php?id=12288
5. Тетеркина М.Н., Лопатин А.С. Клиническая оценка эффективности препарата ИРС 19 в профилактике обострений хронического рецидивирующего риносинусита // Российская ринология. 2008. № 1. С. 12–14.
6. Гаращенко Т.И. Результаты многоцентрового исследования по применению препарата ИРС 19 в профилактике ЛОР-заболеваний у часто болеющих детей // Актуальные вопросы оториноларингологии детского возраста и фармакотерапия болезней ЛОР-органов. Юбилейный сборник научных трудов. М., 2001.
7. Тихомирова И.А., Рязанцев С.В. Дифференцированные схемы лечения хронических заболеваний ЛОР-органов у детей с применением бактериальных лизатов // Российская оториноларингология. 2009. № 1. С. 188–193.
8. Страчунский Л.С., Богомильский М.Р. Антибактериальная терапия синусита у детей // Детский доктор. 2000. № 1. С. 32–33.
9. Лучихин Л.А., Тетцоева З.М., Богданец С.А. Иммунотерапия препаратом ИРС 19 больных острым и хроническим синуситом // Вестник оториноларингологии. 2004. № 4. С.44–47.
10. Богомильский М.Р., Гаращенко Т.И., Радиг Е.Ю. и др. Опыт применения препарата ИРС® 19 в лечении острых заболеваний верхних дыхательных путей у детей // Детский доктор. 2000. № 2. С. 10–13.
11. Кладова О.В., Учайкин В.Ф., Демина Е.Д. Местный иммуномодулятор ИРС® 19 в комплексной терапии ОРЗ // Детские инфекции. 2006. № 4. С. 51–54.
12. Bush A. Diagnosis of asthma in children under five // Prim. Care. Respir. J. 2007. Vol. 16. № 1. P. 7–15.
13. Шабалов Н.П. Детские болезни. Т. 1. СПб.: Питер, 2008. 562 с.
14. Национальная программа "Бронхиальная астма у детей. Стратегия лечения и профилактика". 3-изд., испр. и доп. М., 2008. 106 с.
15. Зиновьева Н.В., Давыдова Н.В., Щербина А.Ю. и др. Часто болеющие дети: мифы и реальность // Аллергология и иммунология в педиатрии. 2005. № 4. С. 26–30.
16. Wright A.L., Taussing L.M., Ray C.G. et al. The Tucson Children’s Respiratory Study II: Lower respiratory tract illness in the first year of life // Am. J. Epidemiol. 1989. Vol. 129. № 6. P. 1232–1246.
17. Геппе Н.А., Ревякина В.А. Новые международные рекомендации по бронхиальной астме у детей PRACTALL // Атмосфера. Пульмонология и аллергология. 2008. № 1. P. 60–68.
18. Schuh S., Johnson D.W., Callahan S. et al. Efficacy of frequent nebulised ipratropium bromide added to frequent high-dose albuterol therapy in severe childhood asthma // Pediatr. 1995. Vol. 126. № 4. P. 639–645.
19. Plotnick L.H., Ducharme F.M. Combined inhaled anticholinergics and b2 agonists in the initial management of acute asthma in children // Cochrane Database Syst. Rev. 2000. Vol. 4. CD000060.
20. Малахов А.Б., Желудкова В.П., Макарова С.А. и др. Эффективность небулайзерной терапии обострений бронхиальной астмы у детей на догоспитальном этапе // Пульмонология. 2000. № 4. С. 67–72.
Новости на тему
28.12.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.