Выбор препаратов базисной терапии бронхиальной астмы у детей и подростков в реальной клинической практике
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – проанализировать противовоспалительную базисную терапию у детей с бронхиальной астмой, госпитализированных в связи с обострением заболевания.
Материал и методы. Проведено открытое проспективное нерандомизированное сравнительное исследование с участием 192 детей в возрасте от шести до 17 лет 11 месяцев. Все дети в период с 2019 по 2023 г. поступили на стационарное лечение в педиатрическое отделение городской детской клинической больницы г. Уфы в связи с обострением аллергической бронхиальной астмы разной степени тяжести. Из 192 пациентов 120 (62,5%) в возрасте от шести до 11 лет 11 месяцев составили группу «Дети», 72 (37,5%) в возрасте от 12 до 17 лет 11 месяцев – группу «Подростки». В данной популяции были оценены структура, объем и способ ингаляционной доставки препаратов базисной противовоспалительной терапии, рекомендованной на момент госпитализации в стационар, а также степень контроля над симптомами бронхиальной астмы как основного критерия эффективности лечения.
Результаты. У госпитализированных детей чаще всего отмечалось среднетяжелое течение заболевания. Так, с легким течением бронхиальной астмы было 74 (38,5%) ребенка, со среднетяжелым течением – 75 (39,1%), с тяжелым течением – 43 (22,4%). Большая доля (68,8%) наблюдаемых получала монотерапию ингаляционными глюкокортикостероидами в низких и средних дозах, из них 18,1% были в группе «Подростки». На применявших комбинированную базисную противовоспалительную терапию ингаляционными глюкокортикостероидами и длительно действующими агонистами β2 в низких и средних дозах приходилось 30,7%, из них 6,8% были в группе «Дети».
Анализ способа ингаляционной доставки препаратов в дыхательные пути показал, что небулайзеры использовали 29,7%, дозированные аэрозольные ингаляторы – 54,2%, дозированные порошковые ингаляторы – 16,1%. Спейсер был в наличии у 41 (21,4%) ребенка.
При оценке техники ингаляционной терапии установлено, что 60,9% совершали ошибки при проведении процедуры, 39,1% выполняли ее правильно. Согласно ретроспективному анализу роли отдельных клинико-анамнестических предикторов в формировании обострения астмы у наблюдаемых детей, наиболее значимыми оказались контакт с причинно-значимым аллергеном (119 (61,9%)), острая респираторная вирусная инфекция (101 (52,6%)), физическая нагрузка (77 (40,1%)), психоэмоциональное напряжение и стресс (59 (30,7%)). К характерным особенностям течения бронхиальной астмы были отнесены ранняя манифестация клинических симптомов бронхиальной обструкции (100%), наследственная предрасположенность к развитию аллергической патологии (71,4%), сопутствующие аллергические заболевания (100%), высокий уровень сывороточного иммуноглобулина E (100%) и поливалентная сенсибилизация к неинфекционным аллергенам (79,2%).
Заключение. Несмотря на имеющиеся международные и национальные согласительные документы, определяющие тактику терапии детей с бронхиальной астмой, в реальной клинической практике все еще существует проблема, связанная с причиной формирования неконтролируемого течения и обострений патологии, требующих госпитализации в стационар. Ее решение включает выбор оптимальных схем лечения с учетом возрастных и индивидуальных особенностей пациентов с динамической оценкой его эффективности, а также коррекции.
Цель исследования – проанализировать противовоспалительную базисную терапию у детей с бронхиальной астмой, госпитализированных в связи с обострением заболевания.
Материал и методы. Проведено открытое проспективное нерандомизированное сравнительное исследование с участием 192 детей в возрасте от шести до 17 лет 11 месяцев. Все дети в период с 2019 по 2023 г. поступили на стационарное лечение в педиатрическое отделение городской детской клинической больницы г. Уфы в связи с обострением аллергической бронхиальной астмы разной степени тяжести. Из 192 пациентов 120 (62,5%) в возрасте от шести до 11 лет 11 месяцев составили группу «Дети», 72 (37,5%) в возрасте от 12 до 17 лет 11 месяцев – группу «Подростки». В данной популяции были оценены структура, объем и способ ингаляционной доставки препаратов базисной противовоспалительной терапии, рекомендованной на момент госпитализации в стационар, а также степень контроля над симптомами бронхиальной астмы как основного критерия эффективности лечения.
Результаты. У госпитализированных детей чаще всего отмечалось среднетяжелое течение заболевания. Так, с легким течением бронхиальной астмы было 74 (38,5%) ребенка, со среднетяжелым течением – 75 (39,1%), с тяжелым течением – 43 (22,4%). Большая доля (68,8%) наблюдаемых получала монотерапию ингаляционными глюкокортикостероидами в низких и средних дозах, из них 18,1% были в группе «Подростки». На применявших комбинированную базисную противовоспалительную терапию ингаляционными глюкокортикостероидами и длительно действующими агонистами β2 в низких и средних дозах приходилось 30,7%, из них 6,8% были в группе «Дети».
Анализ способа ингаляционной доставки препаратов в дыхательные пути показал, что небулайзеры использовали 29,7%, дозированные аэрозольные ингаляторы – 54,2%, дозированные порошковые ингаляторы – 16,1%. Спейсер был в наличии у 41 (21,4%) ребенка.
При оценке техники ингаляционной терапии установлено, что 60,9% совершали ошибки при проведении процедуры, 39,1% выполняли ее правильно. Согласно ретроспективному анализу роли отдельных клинико-анамнестических предикторов в формировании обострения астмы у наблюдаемых детей, наиболее значимыми оказались контакт с причинно-значимым аллергеном (119 (61,9%)), острая респираторная вирусная инфекция (101 (52,6%)), физическая нагрузка (77 (40,1%)), психоэмоциональное напряжение и стресс (59 (30,7%)). К характерным особенностям течения бронхиальной астмы были отнесены ранняя манифестация клинических симптомов бронхиальной обструкции (100%), наследственная предрасположенность к развитию аллергической патологии (71,4%), сопутствующие аллергические заболевания (100%), высокий уровень сывороточного иммуноглобулина E (100%) и поливалентная сенсибилизация к неинфекционным аллергенам (79,2%).
Заключение. Несмотря на имеющиеся международные и национальные согласительные документы, определяющие тактику терапии детей с бронхиальной астмой, в реальной клинической практике все еще существует проблема, связанная с причиной формирования неконтролируемого течения и обострений патологии, требующих госпитализации в стационар. Ее решение включает выбор оптимальных схем лечения с учетом возрастных и индивидуальных особенностей пациентов с динамической оценкой его эффективности, а также коррекции.





Введение
На современном этапе бронхиальную астму (БА) рассматривают как гетерогенную патологию, характеризующуюся хроническим воспалением бронхиальной стенки и респираторными симптомами, такими как свистящие хрипы, одышка, заложенность в груди и кашель, различающимися по интенсивности, времени возникновения и проявляющимися одновременно с вариабельной обструкцией дыхательных путей [1–3].
Бронхиальная астма – широко распространенное хроническое заболевание респираторной системы у детей [4]. Так, ее встречаемость в общей популяции колеблется от 1 до 18%, у детей – от 2 до 10%. В Российской Федерации БА страдают порядка 6,9% взрослых и 10,0% детей и подростков [3, 5, 6].
Неуклонный рост заболеваемости БА среди детей и подростков обусловил разработку международных и национальных согласительных документов, а их внедрение в клиническую практику позволило сформировать единую позицию в отношении диагностики, терапии и профилактики заболевания с учетом возрастных особенностей течения. Согласно программным документам, БА относится к патологии, течение и исход которой непосредственно зависят от своевременности верификации диагноза и назначения адекватного объема базисной терапии. У детей с БА раннее назначение противовоспалительных препаратов в низких дозах приводит к уменьшению выраженности хронического воспаления слизистой оболочки дыхательных путей, гиперреактивности бронхов, предупреждая их ремоделирование, восстановлению бронхиальной проходимости, а также сокращению риска назначения высоких доз препаратов [4, 7, 8]. Ведение пациентов с БА детского возраста предусматривает комплексный подход с назначением широкого круга мероприятий, направленных на достижение и длительное поддержание полного контроля над заболеванием, минимизацию риска будущих обострений, фиксированной обструкции дыхательных путей и развития нежелательных побочных эффектов [4, 9]. Уровень контроля над течением БА признан наиболее предпочтительным и общепринятым динамическим критерием эффективности выбранной противовоспалительной терапии [10, 11].
Несмотря на достигнутые успехи в медикаментозной терапии БА, довольно большой спектр эффективных противовоспалительных препаратов [12], в реальной клинической практике только часть больных достигает полного контроля над патологией. Установлено, что контролировать течение астмы способны не более 25% пациентов. Среди подростков и лиц молодого возраста количество больных с неконтролируемой БА может превышать 45% [13–15].
На сегодняшний день подходы к терапии у детей включают проведение образовательных программ для пациентов и членов их семей, элиминацию триггерных факторов обострения БА и контроль над ними, использование рациональной и обоснованной фармакотерапии, регулярный динамический мониторинг и оценку эффективности назначенного лечения. При этом каждый компонент комплексной терапии БА важен для достижения успеха [16–18].
С целью долгосрочного контроля БА у детей разработан ступенчатый подход, при котором интенсивность терапии, подбор дозы препаратов и способа их ингаляционной доставки в дыхательные пути зависят от степени контроля заболевания, тяжести его течения и наличия факторов обострения [1, 3, 19, 20]. Всего таких ступеней пять. Каждая из ступеней предполагает определенный объем лекарственных средств, выбор которых основан на доказательных данных высокой эффективности, безопасности и доступности [10, 21]. Кроме того, необходимо учитывать индивидуальные особенности больного [9, 22].
Целью исследования стал анализ противовоспалительной базисной терапии у детей с бронхиальной астмой, госпитализированных в связи с ее обострением.
Материал и методы
Проведено открытое проспективное нерандомизированное сравнительное исследование, в которое вошли 192 ребенка с БА. Пациенты, находившиеся под наблюдением, поступили на стационарное лечение в педиатрическое отделение городской детской клинической больницы г. Уфы в связи с обострением аллергической БА разной степени тяжести в период с 2019 по 2023 г.
Возраст детей составил от шести до 17 лет 11 месяцев. Средний возраст – 10,46 ± 2,98 года.
Больных БА в возрасте от шести лет до 11 лет 11 месяцев (средний возраст – 8,41 ± 1,52 года) было 120 (62,5%). Они составили группу «Дети». Пациентов в возрасте от 12 до 17 лет 11 месяцев (средний возраст – 13,68 ± 1,63 года) насчитывалось 72 (37,5%) (группа «Подростки»).
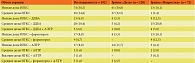
Для формирования выборки исследования были разработаны критерии включения и исключения, представленные в табл. 1.
В ходе исследовании проведена оценка медицинской документации («История развития ребенка» (учетная форма 112/у) и «Медицинская карта стационарного больного» (учетная форма 003/у)). Проанализированы также клинико-анамнестические и лабораторно-инструментальные данные пациентов. Кроме того, изучены структура, объем и способ ингаляционной доставки препаратов базисной противовоспалительной терапии, рекомендованной на момент госпитализации в стационар. Оценен уровень контроля над БА как основной критерий эффективности проводимого лечения.
Уровень контроля симптомов БА определяли с помощью адаптированных и стандартизированных тестов: С-ACT (Childhood Asthma Control Test) у детей от четырех до 11 лет и ACTТМ (Asthma Control Test) у детей старше 12 лет [1, 3].
Независимо от полученных результатов перед выпиской со всеми детьми были проведены беседа и образовательные занятия в Астма-школе по обучению правильной технике ингаляции, использованию ингаляционных устройств, оценке уровня контроля симптомов БА с использованием С-ACT и ACTТМ.
Статистическая обработка полученных данных проводилась согласно общепринятым методам описательной и вариационной статистики с использованием стандартных пакетов программ Microsoft Office Excel 2016 и Statistica 12. Результаты представлены в процентах. Независимые выборки при ненормальном распределении совокупностей сравнивали с использованием непараметрического метода Манна – Уитни с определением статистического U-критерия. Достоверность (р < 0,05) устанавливали с помощью метода Краскела – Уоллиса с определением Н-критерия. Достоверность (р < 0,05) с множественной проверкой оценивалась с определением средней доли ложных отклонений гипотез (среди всех отклонений) (FDR) по методу Бенджамини – Хохберга с использованием онлайн-калькулятора (https://tools.carbocation.com/FDR).
Результаты
Поскольку все дети на момент включения в исследование получали базисное противовоспалительное лечение, в соответствии с российскими клиническими рекомендациями оценка степени тяжести БА проводилась ретроспективно, исходя из изучения анамнеза и рекомендованного объема терапии (табл. 2).
Анализ лекарственных средств, применяемых против воспаления, показал, что в качестве препаратов первого выбора в группе «Дети» чаще всего применяли ингаляционные глюкокортикостероиды (ИГКС) в виде монотерапии – будесонид (53 (44,2%)) и беклометазона дипропионат (31 (25,8%)). Известно, что у детей с БА использование ИГКС на регулярной основе обеспечивает достижение стойкого контроля над симптомами заболевания, а также снижает риск госпитализаций [1, 3]. В группе «Подростки» чаще назначали ингаляционную терапию комбинацией флутиказона пропионата с салметеролом (30 (41,7%)) и фиксированной комбинацией будесонида с формотеролом (20 (27,7%)).
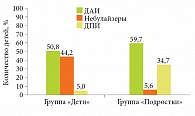
В группе «Дети» чаще применяли дозированные аэрозольные ингаляторы (ДАИ) (61 (50,8%)) и небулайзеры (53 (44,2%)), тогда как в группе «Подростки» – ДАИ (43 (59,7%)) и дозированные порошковые ингаляторы (ДПИ) (25 (34,7%)) (рисунок). Спейсер был у 41 (21,4%) ребенка с БА.
Анализ объема противовоспалительной терапии, необходимого для достижения контроля над симптомами заболевания с соотношением со ступенью лечения и учетом возрастных особенностей пациентов, представлен в табл. 3 и 4.
Объем противовоспалительной терапии у 74 (38,5%) наблюдаемых нами детей с БА соответствовал первой и второй ступеням терапии, установленной программными документами. Данные пациенты получали низкие дозы ИГКС. У 75 (39,1%) объем базисной терапии соответствовал третьей ступени. Из них 28 (14,6%) больных получали монотерапию ИГКС в средних дозах, 17 (8,8%) – комбинацию низких доз ИГКС и антагонистов лейкотриеновых рецепторов (АЛТР), 30 (15,6%) – низкие дозы ИГКС в комбинации с длительно действующими агонистами β2 (ДДБА).
В исследуемой популяции 29 (15,1%) детей получали средние дозы ИГКС – ДДБА, 8 (4,2%) – средние дозы комбинации ИГКС – ДДБА с АЛТР, 6 (3,1%) – средние/высокие дозы ИГКС – АЛТР, что соответствовало четвертой ступени терапии.
В группе «Дети» чаще всего назначали монотерапию ИГКС в низких (61 (50,8%)) и средних (27 (22,5%)) дозах. В группе «Подростки» в качестве базисной терапии преимущественно использовали средние дозы ИГКС в комбинации с ДДБА (15 (20,8%)) и низкие дозы ИГКС в виде фиксированной комбинации с ДДБА (13 (18,1%)).
У всех детей проведена оценка техники выполнения ингаляционной терапии. Установлено, что 75 (39,1%) пациентов при проведении ингаляции не совершали ошибок. У 117 (60,9%) имели место ошибки. Неправильная техника введения лекарственных препаратов наиболее часто отмечалась при использовании ДАИ (93 (48,4%)) из-за нечеткой координации старта ингаляции с началом вдоха, слишком быстрого и короткого вдоха, а также из-за отсутствия задержки дыхания на выдохе.
При оценке степени тяжести БА, основанной на объеме (ступени) противовоспалительной терапии, выявлено, что легкое течение БА имело место в 74 (38,5%) случаях, среднетяжелое – в 75 (39,1%), тяжелое – в 43 (22,4%) случаях. Результаты оценки степени тяжести БА в зависимости от возраста и пола пациентов представлены в табл. 5.
Поскольку все дети с БА на момент госпитализации находились в приступном периоде патологии, нами была определена и его тяжесть. Количество пациентов с легким или среднетяжелым обострением заболевания составило 156 (81,3%), с тяжелым обострением – 36 (18,7%). При этом в группе «Подростки» тяжелые приступы БА фиксировались чаще, чем в группе «Дети». При сравнении доли детей с тяжелыми приступами БА в обеих группах полученный результат достиг статистической значимости (р < 0,05).
Показатель контроля над симптомами БА, который во многом коррелирует с эффективностью базисной терапии и необходимостью проведения ее коррекции, у всех наблюдаемых детей оказался на недостаточном уровне (табл. 6).
Неконтролируемое течение БА зафиксировано у 135 (70,3%) детей, частично контролируемое течение – у 57 (29,7%), что требует дальнейшего динамического мониторинга уровня контроля заболевания и оценки противовоспалительной терапии. Анализ результатов С-ACT и ACTТМ (медианы суммарного количества баллов) выявил различия между группами БА легкой и средней степени тяжести (U2 = 1041, p2 = 0,001, p2FDR = 0,0015) и группой БА тяжелой степени (U3 = 766, p3 = 0,00003, p3FDR = 0,00009). Корреляционный анализ уровня контроля над течением заболевания в зависимости от его тяжести, основанный на данных С-ACT и ACTТМ, выявил различия между группами, достигшие статистической значимости (H = 19,3, p = 0,0001).
При изучении факторов риска обострения БА, послужившего поводом для госпитализации в стационар, преобладали такие предикторы, как контакт с причинно-значимым аллергеном (119 (61,9%)), острая респираторная вирусная инфекция (101 (52,6%)), физическая нагрузка (77 (40,1%)), психоэмоциональное напряжение и стресс (59 (30,7%)).
При анализе возраста дебюта симптомов бронхиальной обструкции установлено, что у большей части (139 (72,4%)) наблюдаемых нами детей манифестация клинически значимых эпизодов экспираторной одышки, кашля и свистящих хрипов приходилась на возраст от полутора до пяти лет. Средний возраст дебюта клинических симптомов бронхиальной обструкции у детей с БА составил 3,01 ± 1,32 года. В группе БА тяжелого течения симптомы дебютировали достоверно раньше (р < 0,05). Средний возраст детей с первыми эпизодами БА при легком течении заболевания составил 3,69 ± 1,66 года, при среднетяжелом – 3,66 ± 1,81 года, при тяжелом – 3,19 ± 1,50 года.
Нами также была проведена оценка наследования по линии отца и матери. Так, отягощенный семейный анамнез в отношении аллергии имел место у 137 (71,4%) детей с БА. При этом отягощенность семейного анамнеза в отношении БА по материнской и отцовской линии возрастала по мере утяжеления течения заболевания, составив 1,6, 4,0 и 30,2% соответственно. При оценке наличия сопутствующих аллергических заболеваний как предиктора развития аллергического фенотипа БА выявлено, что у 192 (100%) наблюдаемых детей в анамнезе имела место сопутствующая патология аллергической природы. В ходе сравнения групп по наличию сопутствующих аллергических заболеваний зафиксированы статистически значимые различия между детьми с легким и среднетяжелым течением БА по аллергическому риниту (χ²1 = 9,8, p1 = 0,0002, p1FDR = 0,0005), детьми с легкой и тяжелой степенью БА по поллинозу (χ²3 = 7,9, p3 = 0,001, p3FDR = 0,003).
У 102 (53,1%) обследованных детей отмечена тенденция к повышению относительного содержания эозинофилов (5% и более) в общем анализе крови. По данному признаку между группами детей с легким и тяжелым течением БА были выявлены различия, достигшие статистической значимости (p3 = 0,00001, p3FDR = 0,00003). Повышение уровня общего иммуноглобулина E (IgE) в сыворотке крови обнаружено у 192 (100%) больных. Средний уровень общего IgE в сыворотке крови при легком течении заболевания составил 298,69 ± 371,65 МЕ/мл, при среднетяжелом течении – 321,22 ± 289,81 МЕ/мл, при тяжелом течении – 401,19 ± 769,50 МЕ/мл.
Аллергологический статус пациентов устанавливали исходя из результатов оценки специфически значимых ингаляционных аллергенов. Полисенсибилизация к разному спектру аллергенов встречалась у 152 (79,2%) детей с БА, статистически значимо чаще в группах с тяжелым (χ²3 = 6,2, p3 = 0,006, p3FDR = 0,01) и среднетяжелым (χ²2 = 4,1, p2 = 0,02, p2FDR = 0,04) течением БА по сравнению с группой с легким течением патологии.
Обсуждение
В ходе настоящего исследования выявлено, что у детей преобладало среднетяжелое течение БА – 75 (39,1%). Легкое течение патологии отмечено в 74 (38,5%) случаях, тяжелое течение – в 43 (22,4%). Аналогичная тенденция прослеживалась в группах «Дети» и «Подростки». Однако в группе «Дети» пациентов с тяжелым течением БА было в два раза меньше, чем в группе «Подростки» (p < 0,05).
Несмотря на то что все находившиеся под наблюдением дети с БА получали препараты базисной противовоспалительной терапии для достижения и поддержания стойкого контроля над симптомами, а также для минимизации риска развития обострений, они были госпитализированы именно из-за обострения разной степени тяжести с недостаточным уровнем контроля над симптомами заболевания. С легким или среднетяжелым обострением БА было 81,3%, с тяжелым обострением – 18,7%. Количество детей с неконтролируемым течением БА составило 70,3%, с частично контролируемым течением – 29,7%.
Анализ рекомендованного в амбулаторно-поликлинических условиях объема базисной противовоспалительной терапии с оценкой фармакологической группы препаратов показал, что большая часть (68,9%) наблюдаемых нами пациентов получала монотерапию ИГКС в низких и средних дозах. При этом 18,1 из 68,9% больных были из группы «Подростки». Применявших препараты базисной противовоспалительной терапии в виде комбинации ИГКС с ДДБА в низких и средних дозах насчитывалось 30,7%, из них 6,8% были из группы «Дети».
Проведенный нами анализ не исключает наличия связи между характером рекомендованной в амбулаторно-поликлинических условиях базисной терапии и риском обострения БА. Обострение БА у наблюдаемых нами детей могло возникнуть как по причине недостаточного объема базисной терапии, так и по причине выбора неоптимального препарата. В соответствии с современными программными документами у детей одной из наиболее оптимальных, безопасных, эффективных и перспективных стратегий, направленных на улучшение контроля над симптомами БА, а также на минимизацию риска формирования обострения, считается использование свободной или фиксированной комбинации ИГКС и ДДБА в режиме единого ингалятора (SMART) [1, 3, 21]. Применение комбинации ИГКС и ДДБА способствует аддитивному эффекту, который основан на достижении контроля над симптомами БА без повышения дозы ИГКС. Данная комбинация рекомендуется в качестве стартовой сразу после верификации диагноза или очередного приступа обострения БА у детей с шести лет на третьей ступени терапии и у детей с 12 лет на второй ступени лечения [3].
Согласно оценке рекомендованного в амбулаторно-поликлинических условиях способа ингаляционной доставки препаратов в дыхательные пути, небулайзеры использовали 29,7% детей, ДАИ – 54,2%, ДПИ – 16,1% детей. Спейсер был у 41 (21,4%) ребенка с БА.
При проведении ингаляционной терапии совершали ошибки 60,9% пациентов. Только 39,1% выполняли процедуру правильно. На сегодняшний день получено достаточное количество данных, указывающих на прямую связь между выбором средства ингаляционной доставки препаратов, а также ошибками в технике ее проведения и риском госпитализации вследствие обострения БА [21]. Поэтому индивидуальная эффективность терапии у детей с БА как в случае обострения, так и в случае ремиссии патологии наряду с обоснованным выбором молекулы препарата определяется его диспозицией в бронхиальном дереве, то есть выбором оптимального и рационального способа доставки. Ингаляционное устройство доставки препаратов в дыхательные пути у детей выбирается в зависимости от возраста, периода заболевания, а также используемой группы лекарственных средств [3]. В данной популяции предпочтение отдается ДАИ, в том числе в комбинации со спейсером, применение которого позволяет повысить биодоступность и легочную депозицию препарата и таким образом достичь терапевтической эффективности [1, 21]
Успех базисной противовоспалительной терапии у детей с БА также во многом зависит от партнерских отношений между врачом, пациентом и его родителями.
Мероприятия, направленные на обучение пациента и его родителей технике ингаляции, с дальнейшим динамическим контролем способствуют снижению риска развития обострения БА, а также повышению уровня контроля над симптомами заболевания [9].
Проведенный нами ретроспективный сравнительный анализ роли отдельных клинико-анамнестических предикторов в формировании обострения БА показал, что наиболее значимыми были контакт с причинно-значимым аллергеном (119 (61,9%)), острая респираторная вирусная инфекция (101 (52,6%)), физическая нагрузка (77 (40,1%)), психоэмоциональное напряжение и стресс (59 (30,7%)).
К характерным особенностям течения БА нами отнесены ранняя манифестация клинических симптомов бронхиальной обструкции (100%), наличие наследственной предрасположенности к развитию аллергической патологии (71,4%) и сопутствующих аллергических заболеваний (100%), высокий уровень сывороточного IgE (100%) и поливалентная сенсибилизация к неинфекционным аллергенам (79,2%).
Заключение
Несмотря на имеющиеся международные и национальные согласительные документы, определяющие тактику терапии детей с БА, в реальной клинической практике все еще существует проблема, связанная с формированием обострений, требующих госпитализации в стационар с целью оказания неотложной медицинской помощи.
Ее решение включает своевременное выявление факторов риска обострения и их коррекцию.
Проведенное нами исследование демонстрирует, что в группах «Дети» и «Подростки» обострение бронхиальной астмы было ассоциировано с недостаточным объемом базисной противовоспалительной терапии. Установлено, что 68,9% наблюдаемых нами детей получали монотерапию ИГКС в низких и средних дозах, что требует проведения коррекции противовоспалительной терапии с назначением альтернативных схем, основанных на использовании комбинированных препаратов в разрешенной возрастной дозе и оптимальной форме доставки.
У наблюдаемых нами детей выявлена связь развития обострения БА с воздействием таких триггерных факторов, как контакт с причинно-значимыми аллергенами, острая респираторная вирусная инфекция, физическая нагрузка, психоэмоциональное напряжение и стресс, что обусловливает необходимость проведения динамического мониторинга и контроля их влияния на течение и исход. Кроме того, с учетом имеющихся факторов риска показана коррекция объема и продолжительности противовоспалительной терапии.
R.M. Fayzullina, МD, PhD, Prof., R.R. Gafurova
Bashkir State Medical University
Contact person: Rita R. Gafurova, rita.gafurova2017@yandex.ru
Pharmacotherapy of bronchial asthma in children involves a step-by-step approach. A certain amount of medicines is provided for each stage. The choice of a specific tool is based on the data of its high efficiency, safety and accessibility. An equally important issue is the choice of the optimal and rational method of drug delivery to the respiratory tract.
The aim of the study was to analyze anti-inflammatory basic therapy in children with bronchial asthma who were hospitalized due to an exacerbation of the disease.
Material and methods. An open prospective non-randomized comparative study was conducted with the participation of 192 children aged six to 17 years and 11 months. All children were admitted to the pediatric department of the Ufa City Children's Clinical Hospital for inpatient treatment due to an exacerbation of allergic bronchial asthma of varying severity in the period from 2019 to 2023.
Of the 192 patients, 120 (62.5%) aged six to 11 years and 11 months were in the ‘Children’ group, 72 (37.5%) aged 12 to 17 years and 11 months were in the ‘Teenagers’ group. In this population, the structure, volume and method of inhalation delivery of basic anti-inflammatory therapy drugs recommended at the time of hospitalization, as well as the degree of control over the symptoms of bronchial asthma, as the main criterion for the effectiveness of treatment, were evaluated.
Results. The hospitalized children most often had a moderate course of the disease. Thus, there were 74 (38.5%) children with mild bronchial asthma, 75 (39.1%) with moderate asthma, and 43 (22.4%) with severe asthma. A large proportion (68.8%) of the observed patients received monotherapy with inhaled glucocorticosteroids in low and medium doses. Of these, 19.5% were in the ‘Teenagers’ group. Those who used combined basic anti-inflammatory therapy with inhaled glucocorticosteroids and long-acting β2 agonists in low and medium doses accounted for 30.7%, of which 6.8% were in the ‘Children’ group.
An analysis of the method of inhalation delivery of drugs into the respiratory tract showed that 29.7% used nebulizers, 54.2% used metered-dose aerosol inhalers, and 16.1% used metered-dose powder inhalers. Spacer was available to 41 (21.4%) children.
When evaluating the technique of inhalation therapy, it was found that 60.9% made mistakes during the procedure, 39.1% performed it correctly. According to a retrospective comparative analysis of the role of individual clinical and anamnestic predictors in the formation of asthma exacerbation in the observed children, the most significant were contact with a causally significant allergen (119 (61.9%)), acute respiratory viral infection (101 (52.6%)), physical activity (77 (40.1%)), psycho-emotional tension and stress (59 (30.7%)). The characteristic features of the course of bronchial asthma included early manifestation of clinical symptoms of bronchial obstruction (100%), hereditary predisposition to the development of allergic pathology (71.4%), concomitant allergic diseases (100%), high levels of serum immunoglobulin E (100%) and polyvalent sensitization to non-infectious allergens (79.2%).
Conclusion. The choice of adequate anti-inflammatory therapy remains relevant in pediatric practice. That is why the mechanisms of variable efficacy of drugs, the safety of their use and methods of inhalation delivery to the respiratory tract remain the subject of scientific research. Optimization and implementation of new approaches into clinical practice will improve the quality of life and control of symptoms in patients with bronchial asthma.
Our study confirms the need for timely assessment of the effectiveness of prescribed basic therapy and treatment adherence.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.