Прогностическая значимость липидных экстрактов мочи при плацента-ассоциированных осложнениях беременности
- Аннотация
- Статья
- Ссылки
- English
Цель – проанализировать липидный состав мочи у беременных с ЗРП с последующей разработкой неинвазивной методики раннего прогнозирования ЗРП среди беременных с высоким риском развития ЗРП.
Материал и методы. В когортном исследовании участвовали 29 беременных. На основании результатов скрининга они были разделены на группы высокого и низкого риска ЗРП. Одномоментный сбор образцов мочи проводили при включении пациенток в исследование на сроках 11–14 недель. Состав липидов в образцах мочи анализировали с помощью жидкостной хроматографии с масс-спектрометрическим детектированием. Выполняли сравнительный анализ липидного профиля мочи пациенток с высоким и низким риском ЗРП, а также мочи пациенток, у которых во время беременности развилась ЗРП и у которых ЗРП отсутствовала.
Результаты. При сравнительном анализе липидного профиля мочи пациенток в зависимости от риска ЗРП выявлено 68 липидов со статистически значимой разницей (р < 0,05). Липиды относились к классам сфинголипидов, глицеролипидов, глицерофосфолипидов и холестериновым эфирам. Обнаружено совпадение пяти липидов в профилях мочи, значимо изменяющих свой уровень как в группе высокого риска ЗРП, так и среди пациенток с реализацией данного осложнения: OxTG 16:0_18:0_17:1(OHOH), TG 16:0_17:0_20:0, Plasmanyl-PS 29:0, Cer d22:5_22:6, DG 8:0_20:2. На основании выявленных отличий были созданы прогностические математические модели реализации ЗРП методом проекций на скрытые структуры (OPLS-DA), обладающие высокой точностью (>99%).
Заключение. Продемонстрирована возможность использования липидного профиля мочи для прогнозирования и раннего детектирования ЗРП неинвазивным методом.
Цель – проанализировать липидный состав мочи у беременных с ЗРП с последующей разработкой неинвазивной методики раннего прогнозирования ЗРП среди беременных с высоким риском развития ЗРП.
Материал и методы. В когортном исследовании участвовали 29 беременных. На основании результатов скрининга они были разделены на группы высокого и низкого риска ЗРП. Одномоментный сбор образцов мочи проводили при включении пациенток в исследование на сроках 11–14 недель. Состав липидов в образцах мочи анализировали с помощью жидкостной хроматографии с масс-спектрометрическим детектированием. Выполняли сравнительный анализ липидного профиля мочи пациенток с высоким и низким риском ЗРП, а также мочи пациенток, у которых во время беременности развилась ЗРП и у которых ЗРП отсутствовала.
Результаты. При сравнительном анализе липидного профиля мочи пациенток в зависимости от риска ЗРП выявлено 68 липидов со статистически значимой разницей (р < 0,05). Липиды относились к классам сфинголипидов, глицеролипидов, глицерофосфолипидов и холестериновым эфирам. Обнаружено совпадение пяти липидов в профилях мочи, значимо изменяющих свой уровень как в группе высокого риска ЗРП, так и среди пациенток с реализацией данного осложнения: OxTG 16:0_18:0_17:1(OHOH), TG 16:0_17:0_20:0, Plasmanyl-PS 29:0, Cer d22:5_22:6, DG 8:0_20:2. На основании выявленных отличий были созданы прогностические математические модели реализации ЗРП методом проекций на скрытые структуры (OPLS-DA), обладающие высокой точностью (>99%).
Заключение. Продемонстрирована возможность использования липидного профиля мочи для прогнозирования и раннего детектирования ЗРП неинвазивным методом.

Введение
Частота задержки роста плода (ЗРП) составляет 4–8% всех беременностей в экономически развитых регионах и 30% – в странах с развивающейся экономикой [1, 2]. ЗРП – недостижение плодом потенциала своего роста, при котором вес и индекс массы тела (ИМТ) новорожденного не соответствуют общепопуляционной норме для соответствующего срока беременности. Согласованное определение задержки (ограничения) роста включает в себя массу тела при рождении меньше 3-го процентиля на популяционных или индивидуальных диаграммах роста или наличие не менее трех из пяти показателей:
- масса тела при рождении ниже 10-го процентиля по популяционным или индивидуальным диаграммам роста;
- окружность головы ниже 10-го процентиля;
- длина тела ниже 10-го процентиля;
- пренатально установленная ЗРП;
- осложненное течение беременности (артериальная гипертензия, преэклампсия) [3, 4].
Образующаяся патологическая плацентация из-за отсутствия трансформации спиральных артерий, предрасполагающая к плацентарным поражениям материнской сосудистой мальперфузии, считается внешней причиной, приводящей к раннему началу преэклампсии. Причины ЗРП подразделяют на внутренние, присущие плоду или плаценте, и внешние. На фоне прогрессирования данного осложнения создаются критические условия кислородного и энергетического голодания с централизацией кровотока у плода [5]. Роль материнской адаптации к плацентарной недостаточности при этом расстройстве полностью не изучена. Интерес представляют биологические процессы и взаимодействие ряда метаболитов, в том числе липидов, ассоциированных с ЗРП. Исследование C. Paules и соавт., включавшее анализ сети взаимодействий метаболитов материнской крови, продемонстрировало роль белка-гомолога нейрогенного локуса NOTCH1 в регуляторных процессах при ЗРП. Анализ генной онтологии ряда белков выявил участие в этих процессах 14 канонических путей и позволил лучше понять значение биологических процессов при ЗРП (в том числе с поздним началом), в частности изменения профиля свободных липидов (отток холестерина и фосфолипидов), адгезии клеток крови, метаболизма жирных кислот и дислипидемии [6].
На сегодняшний день отсутствуют адекватные способы прогнозирования данного осложнения беременности, что требует разработки неинвазивных и объективных методов пренатальной диагностики и мониторинга. Простота, неинвазивность и возможность раннего применения (с первого триместра беременности) – ключевые требования к новым тест-системам, направленным на своевременное медицинское вмешательство и улучшение результатов беременности. Изучение состава липидов различных сред организма необходимо для выявления особенностей ряда акушерских осложнений на молекулярном уровне, биологических механизмов, лежащих в их основе, а также новых биомаркеров. В настоящий момент оценка динамики липидного профиля в биологических средах беременных при ЗРП является достаточно распространенной целью научных исследований. Тем не менее систематизированных обобщенных данных пока не получено [7–9]. В аспекте разработки новых эффективных подходов к ранней диагностике и прогнозированию беременных с ЗРП интерес представляет метаболомный анализ мочи. Сбор мочи – неинвазивная и относительно простая процедура, которая может проводиться регулярно и даже в домашних условиях. Анализ метаболитов мочи считается крайне актуальным лабораторным методом для раннего обнаружения групп высокого риска ЗРП и последующего динамического мониторинга.
Цель – проанализировать липидный состав мочи у беременных с ЗРП с последующей разработкой неинвазивной методики раннего прогнозирования в группе высокого риска развития ЗРП.
Материал и методы
В 2022–2024 гг. на базе Городской клинической больницы № 15 им. О.М. Филатова (родильный дом № 8) проводилось проспективное когортное исследование. В него были включены женщины, обратившиеся в поликлиническое отделение для прохождения пренатального скрининга первого триместра беременности. На основании результатов скрининга изначально в исследование вошло 50 беременных: 25 пациенток высокого риска ЗРП и 25 – низкого. У всех пациенток выполнялся одномоментный сбор мочи на сроке 11–14 недель гестации. В дальнейшем 21 пациентка выбыла из исследования по следующим причинам: выявленная хромосомная патология плода; неразвивающаяся беременность; самопроизвольный выкидыш; отказ (отсутствие возможности) от участия в исследовании; отсутствие информации об исходе родоразрешения, потеря контакта с пациенткой. После родоразрешения, исходя из критериев включения и невключения, в окончательный анализ вошли данные 29 пациенток.
Все пациентки подписали информированное согласие на участие в исследовании. Исследование было одобрено локальным этическим комитетом. Критериями включения служили возраст беременных 18–40 лет, одноплодная беременность на сроке 11–14 недель, наличие данных о риске развития ЗРП (на основании данных расширенного пренатального скрининга). Критерии исключения: резус- и AB0-изоиммунизация, хромосомные аномалии, генетические мутации и врожденные пороки развития у плода, наличие у матери тяжелой экстрагенитальной патологии, хронических заболеваний почек, миомы матки больших размеров, острых инфекционных заболеваний.
Экстракты липидов получали в соответствии с модифицированным методом Фолча. К 40 мкл образца добавляли 480 мкл раствора хлороформа в метаноле (2:1, об./об.), смесь инкубировали в течение десяти минут, тщательно перемешивая. В полученный раствор добавляли воду. Смесь центрифугировали при 13 000 G в течение десяти минут при температуре окружающей среды, отбирали 150 мкл органического нижнего слоя, содержавшего липиды, в оставшуюся смесь добавляли 250 мкл раствора хлороформа в метаноле (2:1, об./об.). Повторно смесь перемешивали, центрифугировали при 13 000 G в течение десяти минут и отбирали еще 300 мкл нижнего слоя. Органическую фазу высушивали в потоке азота, затем растворяли в 200 мкл смеси ацетонитрил-2-пропанола (1:1, об./об.) для последующего масс-спектрометрического анализа.
Молекулярный состав образцов определяли с помощью хроматомасс-спектрометрии с электрораспылительной ионизацией на жидкостном хроматографе Dionex UltiMate 3000 (Thermo Scientific, Германия), соединенном с масс-анализатором Maxis Impact qTOF с ЭРИ источником ионов (Bruker Daltonics, Германия). Образцы разделяли методом обращенно-фазовой хроматографии на колонке Zorbax C18 (150 × 2,1 мм, 5 мкм, Agilent, США) с градиентом от 15 до 45% элюента B в течение двух минут, а затем от 45 до 99% в течение 15 минут. В качестве элюента А использовали раствор ацетонитрила/воды (60/40, об./об.) с добавлением 0,1%-ной муравьиной кислоты и 10 ммоль/л формиата аммония, в качестве элюента В – раствор ацетонитрила/изопропанола/воды (90/8/2 об./об./об.) с добавлением 0,1%-ной муравьиной кислоты и 10 ммоль/л формиата аммония. Скорость потока элюирования – 35 мкл/мин, объем инжектируемого образца – 1 мкл. Масс-спектры получали в режиме положительных и отрицательных ионов в диапазоне m/z 100–1700 со следующими установками: напряжение на капилляре – 4,1 кВ для режима положительных ионов и 3,0 кВ для режима отрицательных ионов, давление распыляющего газа – 0,7 бар, скорость потока осушающего газа – 6 л/мин, температура осушающего газа – 200 °C. Для идентификации липидов выполняли тандемную масс-спектрометрию в режиме зависимого сканирования с шириной окна 5 Да.
Для предварительной обработки хроматомасс-спектрометрических данных использовали программы msConvert из Proteowizard 3.0.9987 для преобразования файлов в MzXml с информацией о масс-спектре в любой момент времени, ms2 с информацией о спектре фрагментации иона в заданный момент времени и MzMine для выделения пиков, нормирования на полный ионный ток и создания таблицы, содержащей информацию о пике – массе иона, площади пика и времени выхода. Идентификация липидов проводилась средствами скриптов LipidMatch [10]. Номенклатура липидов соответствует рекомендациям консорциума LipidMaps.
Сравнение уровней липидов и количественных клинических параметров между группами с высоким и низким риском ЗРП, а также пациентками с ЗРП и без ЗРП проводилось с помощью непараметрического критерия Уилкоксона – Манна – Уитни. Аналогично сравнивали категориальные клинические параметры исходя из критерия согласия Пирсона (хи-квадрат). Для описания количественных данных использовали медианы (Me) и квартили Q1 и Q3. Величину порогового уровня значимости p принимали равной 0,05. Были построены классифицирующие модели на основе дискриминантного анализа ортогональных проекций на скрытые структуры (OPLS-DA) [11]. В ходе кросс-валидации были построены операционные кривые и рассчитана площадь под ними. Статистический анализ осуществлялся средствами языка R 4.3.3 в среде Rstudio 2023.09.1 Build 494.
Результаты
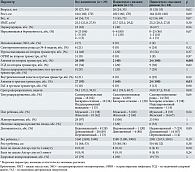
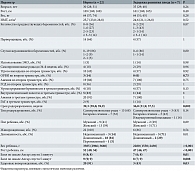
Из 29 пациенток, вошедших в исследование, у 24 в первом триместре, согласно результатам скрининга, был определен высокий риск ЗРП, у пяти – низкий. В дальнейшем ЗРП развилось у семи беременных, шесть из них ранее были отнесены к группе высокого риска, одна – к группе низкого риска (табл. 1). На основании результатов скрининга сравнивали клинические параметры между группами разного риска (высокий и низкий) и группами с разными исходами беременности (основная группа с ЗРП и группа сравнения без ЗРП). Для сравнения численных параметров использовали тест Манна – Уитни, для сравнения категориальных параметров – критерий согласия Пирсона (хи-квадрат). Статистически значимым считали различие при p < 0,05.
Беременные группы высокого риска ЗРП были старше (Ме 31 (28; 33)), 67% пациенток были первородящими, у 6 (24%) повторнородящих данной группы в анамнезе имелись преждевременные роды до 34 недель (p > 0,05). Только в этой группе в 8% случаев беременность наступила в результате вспомогательных репродуктивных технологий (p > 0,05). Течение беременности у пациенток высокого риска ЗРП чаще осложнялось угрозой выкидыша и гестационным сахарным диабетом во втором триместре – 13 (54%) и 9 (38%) случаев соответственно (p > 0,05). Только в этой группе в третьем триместре также выявлены гестационная артериальная гипертензия и внутрипеченочный холестаз – 3 (13%) и 6 (25%) случаев соответственно (p > 0,05). Статистически значимые различия в группе высокого риска ЗРП и группе низкого риска были получены по таким клиническим параметрам, как анемия во втором (24 (100%); p = 0,001) и третьем (24 (100%); p = 0,03) триместрах. Причем данное осложнение наблюдалось у всех пациенток группы высокого риска. Родоразрешение среди беременных группы высокого риска в 38% случаев было оперативным (кесарево сечение). Только в данной группе была зафиксирована антенатальная гибель плода у одной пациентки (p > 0,05). Данные представлены в табл. 1.
На следующем этапе были проанализированы клинические данные в зависимости от исходов для плода (наличие или отсутствие ЗРП) на момент рождения (анализ данных по типу «случай – контроль»). В группе ЗРП родоразрешение произошло значимо раньше (Ме 36,0 (31,9; 37,5); p = 0,002), недоношенность младенцев достигала 71% (p = 0,01), вес и рост детей (< 0,001) и оценка по шкале Апгар были значимо ниже (p = 0,01 для оценки на первой минуте и p = 0,008 для оценки на пятой минуте после рождения). Однако статистическая значимость описанных данных обусловлена делением на группы (с ЗРП и без ЗРП). Данные представлены в табл. 2.
При расчете относительного риска (ОР) для акушерских и перинатальных исходов в зависимости от принадлежности к группе риска ЗРП, установленной на основании данных первого скрининга, были выявлены следующие результаты. В группе высокого риска ОР развития ЗРП оказался выше в 1,25 раза (95%-ный доверительный интервал (ДИ) 0,63–2,49), а ОР рождения недоношенного ребенка – в 1,46 раза (95% ДИ 0,78–2,72).
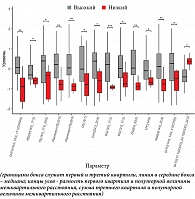
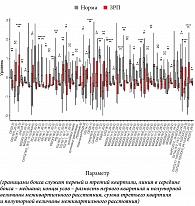
При сравнении уровней липидов в моче пациенток с высоким и низким риском развития ЗРП выявлено 14 липидов со статистически значимой разницей (рис. 1). Сравнение состава мочи пациенток группы «Норма» и группы ЗРП позволило выявить 54 липида, уровни которых статистически значимо отличались (рис. 2).
Таким образом, липиды, значимо меняющие свой уровень в моче в первом триместре беременности у женщин с последующей реализацией ЗРП, относятся к сложным эфирам спиртов и жирных кислот: сфинголипидам, глицеролипидам, глицерофосфолипидам и холестериновым эфирам. Внутригрупповое деление дополнительно выявило наличие фосфатидилхолинов и их лизоформ, фосфатидилсеринов и этаноламинов, фосфатидной кислоты, ди- и триглицеридов и их окисленных форм.
Особый интерес вызвало наблюдение, результаты которого указали на совпадение пяти липидов в профилях мочи как в группе высокого риска ЗРП (согласно данным скрининга), так и среди пациенток с реализацией данного осложнения: OxTG(16:0_18:0_17:1(OHOH)), TG(16:0_17:0_20:0), Plasmanyl-PS(29:0), Cer(d22:5_22:6), DG(8:0_20:2). Уровни всех перечисленных липидов были повышены в группах, ассоциированных с ЗРП. Можно предположить, что эти липиды имеют значение в патогенезе данного осложнения беременности.
Далее была рассмотрена возможность разработки OPLS-DA-моделей, позволяющих отличить образцы мочи пациенток рассматриваемых групп. Такие модели в перспективе можно использовать для диагностики и прогнозирования соответствующих патологий.
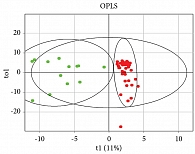
На рисунке 3А представлен график счетов, построенный по результатам OPLS-DA-анализа уровней липидов в моче пациенток с низким и высоким риском развития ЗРП. Наблюдается хорошее разделение точек, соответствующих образцам различных групп, что свидетельствует о заметном отличии липидных профилей в группах. ROC-анализ полученной модели подтверждает ее высокую эффективность: площадь под ROC-кривой составила 0,996 (рис. 3Б).
При построении OPLS-DA-модели, позволяющей отличить образцы групп с низким и высоким риском ЗРП, также была получена хорошая кластеризация образцов на графике счетов (рис. 4). Для этой модели значение площади под ROC-кривой составило 1.
Обсуждение
На сегодняшний день крайне актуален поиск неинвазивных и малоинвазивных маркеров диагностики в акушерстве. Одним из локусов неинвазивного забора биологического материала считается моча. В результате проведенного нами анализа были идентифицированы липиды, относящиеся к сфинголипидам, глицеролипидам, глицерофосфолипидам и холестериновым эфирам. Эти группы органических соединений включают жиры и жироподобные вещества, являющиеся неотъемлемой частью клеточной мембраны и важными регуляторами обмена веществ [12–14]. Анализ изменения данных групп соединений при акушерской патологии представляется крайне актуальным. В эмбриональном периоде липиды играют первостепенную роль в росте и развитии плода. Любые колебания состава жирных кислот мембранных фосфолипидов плода в перинатальном периоде могут быть связаны со структурными и/или функциональными клеточными нарушениями [15]. Изменение профиля жирных кислот и липидов во время беременности на фоне осложнений может отображать ряд поломок в системе контроля над нейроэндокринной функцией и энергетическим обменом «на территории» плода, с последующей реализацией ЗРП [16, 17]. С большой долей вероятности при обнаружении изменения уровня липидов можно установить нарушения в работе системы «мать – плацента – плод» на доклиническом этапе.
Особый интерес представляет наблюдение, указывающее на совпадение пяти липидов в профилях мочи как в группе высокого риска ЗРП (согласно данным скрининга), так и среди пациенток с реализацией данного осложнения: OxTG 16:0_18:0_17:1(OHOH), TG 16:0_17:0_20:0, Plasmanyl-PS 29:0, Cer d22:5_22:6, DG 8:0_20:2. Уровни всех перечисленных липидов были значимо повышены в группах, ассоциированных с ЗРП, еще в первом триместре беременности, то есть на доклиническом этапе данного осложнения. Можно предположить, что эти липиды, относящиеся к глицерофосфолипидам, фосфатидилсеринам, ди- и триглицеридам и их окисленным формам, имеют значение в патогенезе ЗРП.
В исследовании K. Mizugishi и соавт. показано, что метаболический путь сфинголипидов играет критическую роль в толерантности плода и матери, регулируя врожденный иммунитет на границе раздела между плодом и матерью как в экспериментах на животных, так и в исследовании с участием людей, и может расширить понимание терапевтических стратегий лечения акушерских осложнений [18].
Церамиды относятся к группе церамидных липидов в сфинголипидах. Их структура состоит из сфингоидной основы, в частности сфингозина, и жирной кислоты. Жирная кислота может иметь переменную длину, быть гидроксилированной и содержать двойные связи. Церамиды являются важными промежуточными продуктами в биосинтезе всех сложных сфинголипидов. За исключением кожи, церамиды быстро преобразуются и присутствуют только в следовых количествах, но выполняют важные биологические функции. Они могут образовывать богатые церамидами липидные плоты внутри клеточной мембраны и выполнять жизненно важную функцию в клеточной сигнализации, связанной с апоптозом, клеточной дифференцировкой и пролиферацией [19]. Кроме того, церамиды противодействуют эффектам церамид-1-фосфатов. Таким образом, их баланс необходим для гомеостаза, а дисбаланс связан с метаболическими и онкологическими заболеваниями, нейродегенеративными процессами и сердечно-сосудистыми заболеваниями [20–22].
Плазмалогены представляют собой класс глицерофосфолипидов и являются компонентами мембранной структуры. Плазмалогены важны для организации и стабильности микродоменов липидного рафта и богатых холестерином областей мембраны, участвующих в клеточной сигнализации [23]. В дополнение к их структурным ролям подмножество эфирных липидов предположительно функционируют как эндогенные антиоксиданты и, как показывают новые исследования, участвует в клеточной дифференцировке и сигнальных путях [24]. Хотя клиническое значение плазмалогенов связано с пероксисомальными расстройствами, патофизиологическая роль и их возможные метаболические пути не полностью изучены, они представляют уникальные структурные атрибуты для различных типов тканей.
Во время беременности свободные жирные кислоты необходимы для клеточного синтеза эмбриональных мембран. Свободный трансплацентарный транспорт материнских липопротеинов ограничен плацентарным барьером, однако плод потребляет ряд материнских свободных липидов наравне с синтезируемыми им самостоятельно [16]. Такие метаболиты матери, как фосфолипиды и триглицериды, не могут проникать напрямую в плод. На сегодняшний день описаны некоторые механизмы транспорта жирных кислот на «территорию» плода путем их связывания [17] и переноса через плаценту. При ЗРП мы наблюдаем проблемы на «территории» плода, появившиеся на фоне нарушений структуры и функции плаценты, и не отмечаем их в организме матери. Исследования, посвященные оценке изменения метаболитов крови в системе «мать – плод» при ЗРП [25], продемонстрировали, что при данном осложнении беременности изменяется содержание ряда липидов в материнской и пуповинной крови, снижается их рецепторное отображение в ткани плаценты. Динамика уровня липидов и их рецепторов в системе «мать – плод», вероятно, напрямую связана с изменениями роста и развития плода. Дисбаланс липидов может приводить к нарушению нормального транспорта холестерина и фосфолипидов, участвующих в построении клеточных мембран плода [26, 27].
Особый интерес представляет оценка результатов проведенного дискриминантного анализа, показавшего общность происходящих молекулярных процессов в группе беременных как при потенциальном риске ЗРП, так и при его реализации, еще на доклиническом этапе (первый триместр беременности). Образцы мочи пациенток с реализацией ЗРП и группы высокого риска (по данным первого скрининга) смещены в правую область графика. То есть направление изменений в липидном профиле при развитии ЗРП и потенциальном риске его возникновения (на основании данных скрининга) носят схожий характер. Исходя из полученных данных, можно предположить, что после валидации полученных моделей их можно будет использовать для прогноза развития ЗРП по липидному профилю мочи уже на ранних сроках беременности.
Заключение
Проведен углубленный анализ акушерских и перинатальных исходов, идентифицировано 175 липидов в образцах мочи пациенток, отнесенных к группам высокого и низкого риска реализации ЗРП, согласно данным перинатального скрининга. При групповой стратификации образцов мочи пациенток в зависимости от риска и реализации ЗРП выявлено 14 липидов со статистически значимой разницей (р < 0,05). Уровни 54 липидов имели достоверно значимые отличия в группе ЗРП по сравнению с группой «Норма» (р < 0,05). Выявлено совпадение пяти липидов в профилях мочи (образцы собраны в первом триместре беременности), значимо изменяющих свой уровень как в группе высокого риска ЗРП (согласно данным скрининга), так и среди пациенток с реализацией данного осложнения: OxTG 16:0_18:0_17:1(OHOH), TG 16:0_17:0_20:0, Plasmanyl-PS 29:0, Cer d22:5_22:6, DG 8:0_20:2. Можно предположить, что данные липиды имеют значение в патогенезе ЗРП. Выполненный OPLS-DA-анализ образцов мочи пациенток с реализацией ЗРП и группы высокого риска (по данным первого скрининга) продемонстрировал четкое смещение в правую область графика. То есть направление изменений в липидном профиле при развитии ЗРП и потенциальном риске его возникновения (на основании данных скрининга) носят схожий характер и могут указывать на общность происходящих молекулярных процессов при ЗРП еще на доклиническом этапе (первый триместр беременности). На основании данных о липидном профиле мочи пациенток были разработаны математические модели, прогнозирующие развитие ЗРП, имеющие высокую чувствительность и специфичность.
Таким образом, результаты проведенного нами исследования демонстрируют возможность использования анализа липидных экстрактов мочи в комплексном прогностическом исследовании беременных, причем независимо от принадлежности к группе риска, уже начиная с первого триместра беременности.
Финансирование. Работа выполнена при финансовой поддержке РНФ № 24-64-00006.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
K.V. Nosova, S.G. Tsakhilova, PhD, Prof., N. Sakvarelidze. PhD, Yu.V. Stepanova, V.V. Chagovets, A.O. Tokareva, N.A. Frankevich
Russian University of Medicine
Academician V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology
Contact person: Natalia A. Frankevich, natasha-lomova@yandex.ru
Low effectiveness of present fetal growth restriction (FGR) prognostic methods needs development of novel non-invasive hight-accuracy methods for prognostic and early prenatal diagnostic. Molecular profile based diagnostic methods include in a perspective direction of clinical medicine.
Purpose of the current study is detection of pregnant women urine lipidome’s features, which associate with fetal growth restriction and development of non-invasive methods for early prognosis of FGR in the group of pregnant women with high risk of FGR.
Material and methods. 29 pregnant women were included in cohort study and discriminate into groups of high and low risk of FGR according results of screening. Urine samples were one-moment collected at 11–14 weeks of gestation. Urine’s lipids were analysed by liquid chormatography with mass-spectrometry detection. Comparative analysis were performed for urine lipid profiles in case of high and low risk of FGR and in case of relesead or not FGR.
Results. As result of comparative analysis of urine lipids profile depended on risk and realization of FGR 68 lipids with statistical significant alteration (р <0,05) were selected. The lipids include in classes of sphingolipids, glycerophospholipids and cholesterol esters. 5 lipids statistical significant alterate level in case of high risk of FGR and in case of future released FGR, too: OxTG 16:0_18:0_17:1(OHOH), TG 16:0_17:0_20:0, Plasmanyl-PS 29:0, Cer d22:5_22:6, DG 8:0_20:2. Detected alterations were used for creation prognostic OPLS-DA model of FGR releasation with high accuracy (> 99%).
Conclusion. Non-invasive method based on urine lipids was demonstrated as possible methods for prognosis and early detection of FGR.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.