Микробиота тонкой кишки у девочек-подростков, страдающих ожирением
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследовании приняли участие 72 девочки в возрасте 12–17 лет, у половины из которых (первая группа) имело место ожирение. У другой половины участниц исследования (вторая группа) ожирение или какие-либо другие хронические заболевания отсутствовали. Исследование микробных маркеров в крови проводилось с помощью МСММ. Для установления связи представителей микробиоты тонкой кишки с развитием ожирения была построена логистическая модель. Для определения влияния количественного содержания микроорганизмов на ожирение применен ROC-анализ.
Результаты. У девочек с ожирением обнаружены изменения в микробиоме тонкой кишки. У подростков с ожирением отмечался более высокий уровень Nocardia asteroides (504,14 [296,00; 1015,00] кл/г × 105) и Candida spp. (241,85 [198,09; 629,97] кл/г × 105). Выявлен значимый дефицит ряда микроорганизмов условно-патогенной флоры представителей родов Actinobacteria, Firmicutes, Proteobacteriа, а также микроскопических грибов и герпесвирусов.
Заключение. Nocardia asteroides и Candida spp. ассоциированы с ожирением. С увеличением их количества риск развития ожирения у девочек-подростков возрастает.
Материал и методы. В исследовании приняли участие 72 девочки в возрасте 12–17 лет, у половины из которых (первая группа) имело место ожирение. У другой половины участниц исследования (вторая группа) ожирение или какие-либо другие хронические заболевания отсутствовали. Исследование микробных маркеров в крови проводилось с помощью МСММ. Для установления связи представителей микробиоты тонкой кишки с развитием ожирения была построена логистическая модель. Для определения влияния количественного содержания микроорганизмов на ожирение применен ROC-анализ.
Результаты. У девочек с ожирением обнаружены изменения в микробиоме тонкой кишки. У подростков с ожирением отмечался более высокий уровень Nocardia asteroides (504,14 [296,00; 1015,00] кл/г × 105) и Candida spp. (241,85 [198,09; 629,97] кл/г × 105). Выявлен значимый дефицит ряда микроорганизмов условно-патогенной флоры представителей родов Actinobacteria, Firmicutes, Proteobacteriа, а также микроскопических грибов и герпесвирусов.
Заключение. Nocardia asteroides и Candida spp. ассоциированы с ожирением. С увеличением их количества риск развития ожирения у девочек-подростков возрастает.


Введение
Проблема ожирения не теряет своей актуальности на протяжении последних десятилетий [1, 2]. При этом значительную долю занимает детское ожирение. Согласно данным Всемирной организации здравоохранения (ВОЗ), с 2020 г. число случаев развития ожирения среди детей может возрасти более чем вдвое и к 2035 г. составить около 208 млн среди мальчиков и 175 млн среди девочек [3].
Ожирение напрямую связано с различными социальными и медицинскими проблемами [4, 5]. В последних популяционных исследованиях показано, что наличие ожирения у девочек в пубертатном периоде в 2,7 раза увеличивает риск репродуктивных нарушений, что может отразиться на демографических показателях [6, 7].
Ожирение имеет сложный и не до конца изученный этиопатогенез. В его развитии участвуют сотни генов и факторов внешней среды. На сегодняшний день в различных экспериментальных и клинических исследованиях доказана роль состава и функции микробиоты кишечника (МК) [8].
На сегодняшний день микробиота человека рассматривается как экстракорпоральный орган, который задействован в поддержании гомеостаза, обладает высокой метаболической и иммунологической активностью и определяет состояние здоровья всего макроорганизма. При изменении качественного и количественного состава МК, уменьшении ее разнообразия повышается метаболическая активность с образованием дополнительной энергии от съеденной пищи. Кроме того, МК влияет на энергобаланс за счет воздействия на гены, регулирующие расход и запас энергии. В конечном итоге развивается хроническое вялотекущее воспаление. Бактериальные эндотоксины участвуют в созревании компонентов иммунной системы, обусловливая способность к нейтрализации и элиминации патогенов. В то же время измененная в силу разных причин проницаемость кишечного барьера и следующая за этим транслокация микробов в несвойственные им эпитопы могут стать причиной воспаления различной интенсивности [9, 10].
Изменения МК, ассоциированные с ожирением, неоднозначны. Одни авторы указывают на связь с различными филами, другие – с отдельными бактериальными таксонами, что можно объяснить различиями в этнических группах, рационе и образе жизни участников исследований, а также протоколов исследований. При этом исследования у детей малочисленны.
Целью нашей работы стало выявление особенностей микробиома тонкой кишки у девочек-подростков с ожирением с помощью газовой хромато-масс-спектрометрии микробных маркеров крови.
Материал и методы
Стадии исследования соответствовали законодательству РФ, международным этическим нормам и нормативным документам исследовательских организаций. Исследование проводилось после подписания законными представителями детей информированного согласия на участие в исследовании.
Проведено стандартное клинико-лабораторное обследование 72 девочек в возрасте от 12 до 17 лет, 36 из которых страдали ожирением различной степени тяжести. Эти девочки составили первую группу. Во вторую группу вошли 36 детей без ожирения.
С учетом рекомендаций ВОЗ ожирение и его степень диагностировали с помощью величины стандартных отклонений индекса массы тела (SDS ИМТ) [11].
На момент включения в исследование у всех девочек отсутствовали острые и тяжелые хронические заболевания, в том числе патология желудочно-кишечного тракта. В течение шести месяцев до обследования никто из них не получал антибактериальные, пробиотические или пребиотические препараты.
Состояние пристеночной микробиоты тонкой кишки оценивалось с помощью газовой хромато-масс-спектрометрии крови (МСММ) по авторской методике Г.А. Осипова. Данный диагностический метод сертифицирован Росздравнадзором (разрешение ФС 2010/038 от 24.02.2010).
МСММ – высокочувствительный и достоверный метод детектирования микрофлоры по видоспецифическим высшим жирным кислотам клеточной стенки микроорганизмов. Данное исследование позволяет определить более 50 видов бактерий, три вида грибов и три вида вирусов из группы герпесов, а также доминантные виды микроорганизмов в количественном эквиваленте. Для МСММ нет ограничений по локализации забора биоматериала. Она является универсальным методом скрининг-исследования, который указывает на изменения состава микробиоты желудочно-кишечного тракта, характеризуя индивидуальные особенности профиля нормофлоры. Кроме того, она имеет некоторые преимущества перед метагеномным секвенированием 16S рРНК [12].
Статистическая обработка данных проводилась с использованием программ IBM SPSS Statictics 26, MedCalc V.19. Количественные данные по микроорганизмам были представлены в виде медианы и первого и третьего квартилей (Ме [Q1; Q3]), так как гипотеза о нормальности распределения в выборке была отвергнута (критерий Шапиро – Уилка). Для сравнения результатов групп применялся критерий Манна – Уитни. При уровне p < 0,05 они считались статистически значимыми.
В работе был использован логистический регрессионный анализ с построением логистической модели взаимосвязи представителей МК с ожирением, а также ROC-анализ для определения влияния количественного содержания микроорганизмов на зависимую переменную (ожирение).
Графическое представление данных выполнено с помощью программы Jamovi [13].
Результаты и их обсуждение
Все девочки находились в одинаковых условиях по характеру и кратности питания, пищевым предпочтениям и питьевому режиму.
Стереотип питания характеризовался высокой частотой приемов пищи, большим объемом съедаемых порций, наличием перекусов и ночных приемов пищи.
При анализе качественных характеристик рациона отмечено избыточное употребление мясных полуфабрикатов, сладких молочных продуктов, газированных напитков, кондитерских изделий, дефицит овощей. Количество дополнительной чистой питьевой воды составляло 1–1,5 л/сут.
Рост девочек с ожирением составлял 167,5 [164; 172] см, масса тела – 93,5 [82; 105] кг, ИМТ – 33 [30; 38] кг/м2, SDS ИМТ – 2,7 [2,4; 4,9]. Из 36 обследованных у пяти имело место ожирение первой степени, у шести – второй степени, у восьми – третьей степени, у 17 – морбидное ожирение. У девочек без ожирения антропометрические параметры были следующими: рост – 166 [160; 168] см, масса тела – 56 [52; 66] кг, ИМТ – 28 [19; 24] кг/м2, SDS ИМТ – 0,6 [0,2; 0,8].
Половое развитие всех девочек, определяемое по формуле Таннера, соответствовало третьей – пятой стадии.
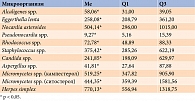
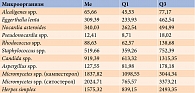
По результатам МСММ, у девочек с ожирением по сравнению с девочками с нормальной массой тела выявлены значимые различия микробиоты тонкой кишки (табл. 1 и 2).
Ориентируясь на численность отдельных микроорганизмов в сложнокомпонентном составе микробного сообщества кишечника и их свойства, можно оценить ожидаемые метаболические последствия.
У девочек с ожирением в отличие от девочек без ожирения доминировали только два вида микроорганизмов – Nocardia asteroides и Candida spp. Так, их представленность оказалась в 1,5 и 3,8 раза выше. Девять видов микроорганизмов, включая грибы и вирусы, у пациенток с ожирением выявлялись в статистически значимо меньшем количестве, чем у относительно здоровых детей, – в 1,2–4,5 раза.
Nocardia asteroides (род Actinobacteriа) – грамположительная бацилла, облигатный аэроб, частично кислотоустойчивая. Является возбудителем пневмонии и диссеминированных инфекций [14]. Данные о ее роли в развитии ожирения отсутствуют.
Candida spp. выделяет токсины, которые ослабляют иммунную систему. При определенных условиях вызывает кандидоз [14].
Alcaligenes spp. (род Proteobacteriа) – грамотрицательные палочки, облигатный аэроб, способный утилизировать ацетат, пропионат, бутират, цитрат, аланин. Защелачивает питательные среды, содержащие белки или их производные [14].
Eggerthella lentа (род Actinobacteriа) – грамположительные анаэробные, палочкообразные, неподвижные бактерии. Заселяют желудочно-кишечный тракт, женскую репродуктивную систему. Деконъюгируют желчные кислоты. Участвуют в развитии смешанных инфекций при абсцессе печени, бактериальном вагинозе, менингите, встречаются при воспалительных заболеваниях кишечника, болезни Грейвса [14].
Pseudonocardia spp. (род Actinobacteriа) – малоизученная грамположительная бактерия. Является перспективным источником новых антибиотиков и обладает мощным ферментативным аппаратом, антимикотическими свойствами [14].
Rhodococcus spp. (род Actinobacteriа) – факультативные внутриклеточные актинобактерии, способные персистировать и вегетировать в макрофагах и других клетках высших организмов, вызывая их разрушение. Результирующее действие родококков приводит к поражению тканей, аналогичному действию микобактерий туберкулеза. Они вырабатывают ферменты, гидролизующие липиды (например, холестеролоксидазу), которые токсичны для организма человека. Участвуют в синтезе стероидов, деградации ксенобиотиков [14].
Staphylococcus spp. (род Firmicutes) – неподвижные шарообразные клетки. Являются довольно распространенными представителями микробиома человека. Вызывают множество заболеваний, в том числе поверхностные и глубокие гнойные инфекции, инфекции мочевых путей, интоксикации.
Aspergillus spp. – высокоаэробные виды микроорганизмов, которые растут на богатых углеродом субстратах, таких как глюкоза и амилоза. Аспергиллы признаны распространенным заражающим фактором крахмалистых продуктов (хлеба и картофеля). В кишечнике не растут, только выделяются [14].
Micromycetes spp. (ситостерол) и Micromycetes spp. (кампестерол) широко распространены в окружающей среде – в почве, воде, воздухе, на внутренних стенах жилых и производственных помещений. Образуют мицелий, повреждают субстрат адгезии. Превосходят все прочие микроорганизмы по продукции антибиотиков и витаминов, обладают мощным ферментативным аппаратом [14].
Herpes simplex вызывает распространенную инфекцию, которая проявляется на коже и слизистых группами пузырьков с жидкостью.
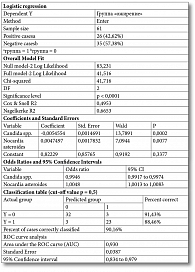
Для оценки связи представителей МК с ожирением использован логистический регрессионный анализ с построением логистической модели.
Зависимая бинарная переменная – ожирение. Определена корреляция независимых переменных: при наличии регрессоров с коэффициентом взаимной корреляции более 0,7 выбирается один из них, исходя из логики рассуждений, либо с наименьшим уровнем значимости.
Выбор независимых переменных (регрессоров): в мультивариантную модель включают переменные с уровнем значимости при унивариантном анализе p < 0,1.
Из всех регрессоров данному требованию отвечали две переменные – Candida spp. и Nocardia asteroides.
Дискриминантная функция Z:
Z = β0 - β1 × Х1 + β2 × Х2, где β0 – константа, а β1 и β2 – стандартные коэффициенты регрессии (β0 = 0,82229, β1 = -0,0054554 и β2 = 0,0047497);
Х1 – среднее значение переменной Candida spp.;
Х2 – среднее значение Nocardia asteroides.
В модели используется логистическое преобразование дискриминантной функции, характеризующее вероятность принадлежности каждого конкретного наблюдения к группе ожирения:
Р = 1 : (1 + e-Z), где e – основание натурального логарифма (е ≈ 2,718).
Логистическая функция может принимать значения от нуля до одного.
Рассчитана вероятность принадлежности к первой группе (ожирение) – р = 0,609.
Таким образом, если переменная менее 0,609, она относится к группе без ожирения, если более 0,609 – к группе ожирения.
Для определения влияния количественного содержания микроорганизмов (микробиоты кишечника) на зависимую переменную (ожирение) выполнен унивариантный ROC-анализ. Разделяющую величину количественного содержания в точке cut-off определяли по наивысшему значению индекса Юдена.
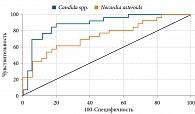
Точность модели составила 90,2%, статистическая достоверность – р < 0,0001. Площадь под ROC-кривой – 0,930 ± 0,0387 (95%-ный доверительный интервал (ДИ) 0,834–0,979), что оценивается как отличное. Чувствительность при прогнозировании ожирения – 91,43% (32 случая из 35), специфичность – 88,46% (23 случая из 26) (табл. 3, рис. 1).
Установлена взаимосвязь независимых переменных с ожирением.
В модели выбрана объясняющая переменная, соответствующая Candida spp.
Площадь под ROC-кривой, соответствующей связи между Candida spp. и ожирением, составила 0,862 (95% ДИ 0,752–0,936). Полученная модель была статистически значимой (p < 0,0001). Порог отсечения Candida spp. в точке cut-off составил ≤ 620,2. Величина ≤ 620,2 ассоциирована с ожирением. Чувствительность модели – 88,5%, специфичность – 78,4%.
Указанные переменные включены в мультивариантную логистическую регрессионную модель, представленную на рис. 2.
Параметры модели: уровень статистической значимости – p < 0,0001, чувствительность – 88,5%, специфичность – 91,4%, точность – 90,2%.
На рисунке 3 представлены ROC-кривые для независимых переменных Candida spp. и Nocardia asteroids, зависимая переменная – ожирение.
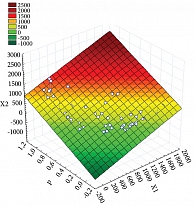
График вероятности распределения микробиоты по средним значениям в группах Candida spp. и Nocardia asteroides представлен на рис. 4. Выполнена стратификация поверхности графика цветом.
Построенная математико-статистическая модель взаимосвязи свидетельствует о том, что два вида микроорганизмов, в частности Candida spp. и Nocardia asteroides, ассоциируются с развитием ожирения у девочек в пубертатном периоде. Логистическая модель обладает высокой точностью, чувствительностью и специфичностью и может быть использована на практике (p < 0,0001, AUC = 0,930, 95% ДИ 0,834–0,979). ROC-анализ выявил влияние количественного содержания Candida spp. и Nocardia asteroides на возникновение ожирения в данной популяции.
Выводы
Согласно данным газовой хромато-масс-спектрометрии микробных маркеров крови, у девочек-подростков с ожирением можно выделить следующие особенности микробиома тонкой кишки.
- Избыточный рост Nocardia asteroides и Candida spp. Именно эти микроорганизмы связаны с ожирением. Так, с увеличением их количества возрастает вероятность развития ожирения.
- Преобладание дисбиотических нарушений с преимущественным дефицитом резидентных микроорганизмов представителей всех родов (Actinobacteria, Firmicutes, Proteobacteriа).
- Значительное снижение количества микроскопических грибов и герпесвирусов. Следовательно, в будущем снижается риск развития вызываемых ими заболеваний.
Необходимо продолжить детальное изучение этого вопроса в дальнейших исследованиях.
Коррекция выявленных нарушений микрофлоры у девочек в подростковом возрасте позволит осуществить метаболическое программирование их репродуктивного здоровья на последующие годы жизни.
L.D. Shogiradze, V.P. Novikova, MD, PhD, Prof., N.V. Evdokimova, PhD, A.A. Pokhlebkina, Yu.V. Petrenko, PhD, Ye.A. Mikhnina, MD, PhD, Yu.S. Poznanskaya
City Children's Clinic No. 19, St. Petersburg
St. Petersburg State Pediatric Medical University
Comprehensive care clinic ‘Scandinavia’, St. Petersburg
Academician I.P. Pavlov First St. Petersburg State Medical University
D.O. Ott Research Institute of Obstetrics, Gynecology and Reproductology
St. Petersburg Medical and Technical College of the Federal Medical-Biological Agency
Contact person: Nina V. Evdokimova, posohova.nina2014@yandex.ru
Aim of the study – to characterize the small intestine microbiome in adolescent girls with obesity according to gas chromatography-mass spectrometry of microbial markers (CMSMM).
Material and methods. The research involved 72 adolescents (girls) 12–17 years old, half of the children (group 1) were obese, the other half (group 2) were not obese, as well as did not have any chronic diseases.
Microbial markers in blood samples were examined by the CMSMM method. In order to examine correlation between the small intestine microbiota and obesity, a logistic model was formed. ROC analysis was used to determine possible effects of microorganisms on obesity.
Results. There were found significant differences in the small intestine microbiome of obese girls, and alike microbiocenosis of children with normal body weight. Obese adolescent girls had higher levels of Nocardia asteroides (504.14 [296.00; 1015.00] cells/g × 10⁵) and Candida spp. (241.85 [198.09; 629.97] cells/g × 10⁵). Microorganisms of the opportunistic flora such as Actinobacteria, Firmicutes, Proteobacteria and microscopic fungi, as well as herpesviruses were significantly deficient.
Conclusions. Nocardia asteroides and Candida spp. are associated with obesity. The risk of obesity in adolescent girls increases with a growing number of above-mentioned microorganisms.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.