Центральный несахарный диабет: этиопатогенез, подходы к диагностике и лечению
- Аннотация
- Статья
- Ссылки
- English







Введение
Нарушение водно-электролитного гомеостатического механизма представляет значимую клиническую проблему. Организм человека чрезвычайно чувствителен к дегидратации. Быстрая потеря 1/5 общего количества жидкости может быть смертельной [1].
Одной из причин синдрома полиурии – полидипсии является центральный несахарный диабет (ЦНД), или нейрогенный несахарный диабет. Центральный несахарный диабет – тяжелая нейроэндокринная патология с поражением гипоталамо-гипофизарной системы. В основе развития заболевания лежит дефект синтеза или секреции антидиуретического гормона (АДГ), ведущий к неспособности почек реабсорбировать воду, концентрировать мочу, что проявляется выраженной жаждой, выделением большого количества мочи с низким удельным весом [2–4]. Второе название этого гормона – вазопрессин (аргинин-вазопрессин), поскольку он регулирует сосудистый тонус, стимулируя сокращение гладкомышечных клеток сосудов и повышение артериального давления.
Антидиуретический гормон – это нонапептид из шести аминокислот, замкнутых в кольцо дисульфидным мостиком с боковой цепью из трех аминокислот. Он играет важную роль в регуляции водно-осмотического баланса, артериального давления и работы почек [4–6], поэтому дефекты его синтеза, секреции и действия имеют большое клиническое значение.
Синтез АДГ главным образом происходит в нейросекреторных клетках супраоптического и паравентрикулярного ядер гипоталамуса, в значительно меньшей степени – в супрахиазматическом ядре, в медиальных ядрах миндалины, сосудистом сплетении, гиппокампе. С помощью аксонального транспорта АДГ вместе с нейрофизином мигрирует в виде нейросекреторных гранул в заднюю долю гипофиза (нейрогипофиз), где накапливается в контактирующих с капиллярами окончаниях аксонов [4, 7]. Вазопрессин хранится в нейрогипофизе. После стимуляции около 10–20% может быть выделено в кровоток. Секреция АДГ из нейросекреторных гранул в кровеносную систему происходит путем экзоцитоза и опосредуется кальций-зависимым механизмом. Концентрация АДГ в крови зависит от времени суток. В ночное время она выше, поэтому ночью выделяется меньший объем мочи с более высокой осмоляльностью [4, 5].
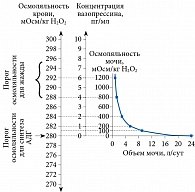
Секрецию АДГ регулируют расположенные в гипоталамусе осморецепторы, реагирующие на изменение осмоляльности плазмы крови (ОПК) (рис. 1). Кроме того, продукция АДГ зависит от объема циркулирующей крови и уровня артериального давления. Однако секреция вазопрессина более чувствительна к минимальным изменениям ОПК, чем к высвобождению гормонов, связанных с гиповолемией, гипотензией, что требует больших изменений давления и объема [2, 5, 7]. Повышение ОПК на 1–2% изменяет объем осморецепторных клеток и электрическую активность нейронов и приводит к выраженному увеличению уровня вазопрессина в плазме.
У взрослых начальная точка секреции АДГ в норме находится в пределах 280–290 мОсм/кг. Пороговый уровень секреции может меняться при ряде физиологических и патологических состояний. В частности, беременность, недостаточное питание, острый психоз, онкологические заболевания иногда сопровождаются смещением этой точки к более низким значениям [4, 5, 7].
Одновременно с секрецией АДГ в случае повышения ОПК (гиперосмия) активируется механизм утоления жажды. В совокупности это приводит к увеличению потребления воды и препятствует дегидратации организма [4, 7]. Высвобождение АДГ тормозится при уровне ОПК ниже порогового, что приводит к выведению большого количества максимально разведенной мочи. При нарушении секреции аргинин-вазопрессина потеря воды обусловливает гипернатриемию. Жажда и потребление жидкости усиливаются в той степени, которая достаточна для восстановления и сохранения ОПК. Следует напомнить, что в пожилом возрасте уменьшаются количество осморецепторов, а также чувствительность гипоталамических ядер к повышению ОПК, поэтому вероятность обезвоживания увеличивается [1, 5].
Как было отмечено ранее, на секрецию АДГ влияет изменение объема и давления крови [1, 6, 7]. Уменьшение внутрисосудистого объема крови на 10–15% существенно изменяет высвобождение АДГ, при этом снижается осмотический порог его секреции, но сохраняется линейная связь между ОПК и концентрацией пептида. Данный механизм реализуется посредством растяжения волюморецепторов легочных вен, нервные импульсы от которых через nervus vagus и ретикулярную формацию головного мозга достаточно эффективно влияют на секрецию АДГ гипоталамическими ядрами [4–6]. Гемодинамическое воздействие опосредуется и афферентными волокнами, идущими от каротидных, аортальных барорецепторов и барорецепторов легочных артерий. Тошнота, боль и стресс, в том числе в послеоперационном периоде, являются мощными стимуляторами секреции АДГ. И если в организм поступает избыточное количество свободной жидкости, может сформироваться угрожающая для жизни пациента гипонатриемия. Стимуляция АДГ происходит при болевых раздражениях, которые могут привести к рефлекторной анурии при эмоциональном возбуждении [5].
Главным физиологическим эффектом АДГ является сохранение воды в организме, поддержание ОПК посредством регуляции экскреции/реабсорбции воды почками путем снижения выделения мочи. Помимо традиционного гидроосмотического эффекта АДГ регулирует системную гемодинамику (прессорное действие), гемостаз, высвобождение ренина, синтез простагландинов в почках и, наконец, способность к обучению, а также поведение [1, 2, 8].
Эффекты АДГ реализуются за счет взаимодействия в тканях-мишенях с двумя типами мембранных рецепторов – V1 и V2 [6, 8].
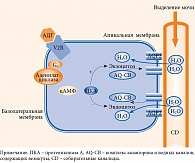
Способность АДГ повышать водную проницаемость стенки собирательных канальцев почек, концентрирование мочи, уменьшать экскрецию воды (увеличивать реабсорбцию) в значительной степени обусловлена стимуляцией V2-рецепторов (V2R) базолатеральной мембраны канальцев. Связывание АДГ с гладкомышечными клетками сосудов опосредовано V1а-рецепторами, что приводит к сосудосуживающему эффекту [6, 8]. Связывание с рецептором запускает внутриклеточный путь циклического аденозинмонофосфата (цАМФ), который вызывает фосфорилирование транспортных белков – аквапоринов 2 (AQP2), их транспорт к апикальной мембране и встраивание в нее, формирование водных каналов, увеличение проницаемости люминальной мембраны по отношению к воде. В итоге это обеспечивает пассивную реабсорбцию воды в гипертоническое мозговое вещество почек (рис. 2) [9, 10]. В результате образуется концентрированная моча с высокой осмоляльностью, диурез уменьшается [9, 11].
Таким образом, чем выше концентрация АДГ в крови, тем выше концентрация образующейся мочи. При снижении концентрации АДГ моча становится более разбавленной. После достижения водного гомеостаза уровень АДГ снижается, AQP2 подвергаются эндоцитозу, водонепроницаемость плазматической мембраны восстанавливается [1, 11].
Этиология и патогенез
Центральный несахарный диабет – редко встречающееся заболевание. Так, его распространенность в популяции в среднем составляет 0,004–0,01% и не различается у мужчин и женщин [2, 4].
В зависимости от механизма развития выделяют первичный (врожденный), вторичный (приобретенный) и идиопатический ЦНД (рис. 3), от тяжести дефицита АДГ – полный и частичный ЦНД [2, 3, 12].
В большинстве случаев причину заболевания установить не удается. Так, на идиопатический ЦНД приходится 25–30%. Однако благодаря повышению чувствительности визуализирующих методик и осведомленности об аутоиммунной воспалительной и сосудистой природе патологии удалось уменьшить долю идиопатического ЦНД [3, 4, 12].
Наследственные формы заболевания встречаются примерно в 5% случаев.
К частым причинам ЦНД относят транскраниальные, транссфеноидальные оперативные и лучевые вмешательства [13–15]. На их долю приходится 20% случаев. Острый послеоперационный ЦНД наблюдается не менее чем у 30% пациентов. У более половины больных он носит транзиторный характер. Транзиторный или постоянный характер ЦНД обусловлен анатомической локализацией повреждения [2, 12, 13]. При поражении области над срединным возвышением с вовлечением вазопрессин-синтезируемых клеток супраоптического и паравентрикулярного ядер функция нейросекреторных клеток, как правило, утрачивается навсегда. Напротив, при локализации патологического процесса в нижележащих отделах процесс нередко оказывается обратимым [13, 16].
Другими распространенными причинами заболевания являются патологические изменения гипоталамо-гипофизарной области (внутричерепные опухоли, инфильтративные изменения и др.), повреждение гипоталамуса, ножки гипофиза, нейрогипофиза при различных черепно-мозговых травмах (травма головы, глазницы, перелом костей черепа) [4, 14, 15]. Примерно у трети взрослых развитие ЦНД связано с первичной или метастатической опухолью в гипоталамо-гипофизарной области [12, 16]. Среди первичных опухолей следует отметить краниофарингиому, герминому, пинеалому, менингиому, опухоли области хиазмы зрительных нервов, воронки и третьего желудочка. Аденомы гипофиза, сопровождающиеся развитием ЦНД, как правило, имеют значительный супраселлярный рост [12, 15, 16]. Ввиду повышения выживаемости пациентов с онкологической патологией благодаря совершенствованию диагностических и лечебных мероприятий чаще стали выявлять метастазы опухоли в гипофиз. Возникновение ЦНД у онкологических больных в 90% случаев связано с метастазированием опухоли. Нередко метастазы в гипофиз могут быть первым проявлением опухолевого процесса. В гипофиз чаще метастазируют лимфома, рак молочной и щитовидной желез, бронхов, почек, гепатоцеллюлярный рак, колоректальная карцинома, меланома [12, 16, 17].
Аутоиммунное поражение гипоталамо-гипофизарной области также сопровождается развитием ЦНД. Лимфоцитарный инфундибуло-нейрогипофизит (инфильтрация задней доли гипофиза лимфоцитами, плазматическими клетками, эозинофилами) может объяснить ЦНД примерно у половины пациентов с идиопатической формой заболевания и сочетаться с лимфоцитарной инфильтрацией аденогипофиза [1, 18]. Заболевание нередко возникает во время беременности и в послеродовом периоде. В данной клинической ситуации магнитно-резонансная томография (МРТ) позволяет обнаружить увеличенный в размерах гипофиз и утолщение гипофизарной ножки [3, 19].
Среди более редких причин ЦНД необходимо отметить системные инфильтративные заболевания (саркоидоз, гистиоцитоз, туберкулез), гемобластозы (лейкоз, лимфогранулематоз и др.). Известны случаи ЦНД, вызванные сосудистой патологией – центральным аневризмом, тромбозом или кровоизлиянием, послеродовым некрозом гипофиза (синдромом Шиена – Симмондса) [2, 4, 12].
Причиной ЦНД могут быть и генетические дефекты, существование которых подтверждается наличием семейных форм заболевания. Таковые встречаются в 5% случаев [2, 20, 21]. Например, синдром Вольфрама, или DIDMOAD-синдром, представляет собой сочетание сахарного и несахарного диабетов, нейросенсорной тугоухости и атрофии зрительного нерва. Считается, что в основе дефицита АДГ лежит аплазия нейросекреторных клеток [22].
Клиническая картина и диагностика
Клиническая манифестация ЦНД отмечается при значительном (на 80–90%) снижении секреторной активности аргинин-вазопрессин-секретирующих нейронов нейрогипофиза [2, 23]. Начало заболевания обычно острое, внезапное, с развитием полиурии и полидипсии. Иногда развитию ЦНД предшествует полидипсия без нарушения концентрационной способности почек, что может отражать начальную, еще не критическую потерю секретирующих нейронов.
ЦНД в результате травмы, инфекции обычно проявляется или непосредственно после пускового фактора, или спустя две – четыре недели [2–4].
Классификация несахарного диабета по степени тяжести представлена в табл. 1.
Основными клиническими проявлениями заболевания являются повышенное выделение разведенной мочи (гипотоническая полиурия), выраженная жажда (полидипсия) (более 2 л/м2/сут), которая после приема жидкости возвращается и не прекращается в ночные часы (никтурия). Объем мочи увеличивается до 5–6 л, нередко достигает 10–12 л [2, 23]. При этом осмоляльность мочи (ОМ) ниже, чем ОПК (менее 290 мОсмоль/кг), а цвет мочи почти не отличается от воды. Гиперосмоляльность плазмы, обусловленная выраженной полиурией, стимулирует жажду. Больные выпивают от 5 до 15 л жидкости, отдавая предпочтение охлажденным напиткам. Длительные перерывы в приеме воды для них практически невозможны [2, 24]. Количество выделяемой мочи и выпиваемой жидкости обычно не различается. При недостаточном восполнении потери жидкости появляется сухость кожных покровов и слизистых оболочек. Нередко наблюдается уменьшение пото- и слюноотделения. Со стороны дыхательной и сердечно-сосудистой систем нарушений, как правило, не фиксируется. Из-за систематического употребления больших количеств жидкости могут наблюдаться патологические изменения со стороны желудочно-кишечного тракта (растяжение и опущение желудка, запоры). Часто снижены секреторная деятельность и аппетит. В редких случаях осложнением длительной полиурии (при несвоевременной диагностике) может стать гидронефроз, когда на фоне тех или иных причин (атония мочевого пузыря и др.) пациент не в состоянии полностью опорожнить мочевой пузырь [2, 4].
Характерны психические и эмоциональные нарушения – головные боли, бессонница, эмоциональная неуравновешенность вплоть до психозов, снижение умственной активности [12, 23, 24]. У пациентов с внутримозговой опухолью (герминома, краниофарингиома, глиома и др.) могут наблюдаться неврологические (головные боли, птоз, косоглазие, нарушение походки и др.) и зрительные (снижение остроты и/или выпадение поля зрения, диплопия) нарушения, а также симптомы, связанные с изменением тропных функций гипофиза [14–16].
Из-за бессонницы вследствие полиурии и полидипсии может возникнуть физическая и психическая астенизация.
Без адекватного восполнения потери жидкости на фоне продолжающейся полиурии нарастают проявления дегидратации, такие как сухость слизистых оболочек и кожи, тахикардия, снижение артериального давления, выраженная слабость [2, 23]. При тяжелой дегидратации быстро снижается масса тела, появляются головная боль, тошнота, рвота, лихорадка, судороги, коллапс, падает фильтрационная способность почек, сгущается кровь.
В типичных случаях постановка диагноза ЦНД не вызывает трудностей. Следует учитывать, что при неполном дефиците АДГ клиническая симптоматика может быть не столь яркая, что требует тщательной диагностики во избежание выбора неправильной тактики ведения пациентов.
Обязательное обследование на наличие ЦНД рекомендуется пациентам после перенесенных нейрохирургических вмешательств, черепно-мозговых травм, субарахноидальных кровоизлияний. Манифестация ЦНД чаще происходит в первые дни после операции. Однако его появление регистрируется на протяжении нескольких недель [3, 12, 14]. Подтверждением диагноза служат полиурия (выделение мочи более 3 л/сут или более 40 мл/кг/сут), полидипсия и наличие таких маркеров, как гиперосмоляльность плазмы (более 300 мОсм/кг) и/или гипернатриемия (более 145 ммоль/л) в сочетании с гипоосмоляльностью мочи (менее 300 мОсм/кг), относительная плотность мочи менее 1005 г/л во всех порциях разовой мочи или при анализе мочи по Зимницкому [3, 12].
В отсутствие характерных диагностических маркеров в клинической практике используют тест с сухоедением (концентрационный тест, дегидратационная проба), который позволяет дифференцировать ЦНД и первичную полидипсию, когда изменение секреции АДГ и чувствительности к нему отсутствует [3, 12, 25]. Проведение указанного теста противопоказано при наличии гипернатриемии.
Суть теста заключается в том, что больные под постоянным медицинским наблюдением лишаются любой жидкости, желательно также ограничение пищи, по крайней мере в течение первых восьми часов его проведения. При кормлении пища не должна содержать много воды и легкоусвояемые углеводы, предпочтительны вареные яйца, зерновой хлеб, нежирные сорта мяса и рыбы. До и в ходе проведения теста (каждые один-два часа) измеряют массу тела, артериальное давление, пульс, осмоляльность крови и мочи, объем мочи, содержание натрия в плазме [12]. Длительность пробы с сухоедением зависит от причины и выраженности полидипсии. Проба с сухоедением прекращается при потере более 5% массы тела, невыносимой жажде, объективно тяжелом состоянии пациента, нарастании содержания натрия, ОПК выше границ нормы и ОМ более 600 мОсм/кг [3, 25].
В норме или при психогенной (первичной) полидипсии (ПП) на фоне дегидратации самочувствие пациента существенно не меняется, происходит концентрирование мочи (ОМ более 600 мОсм/кг), осмоляльность и натрий крови остаются в пределах референсных значений.
Результаты пробы с сухоедением свидетельствуют о несахарном диабете (табл. 2), если ОМ в ответ на дегидратацию не превышает ОПК и остается менее 300 мОсм/кг, осмоляльность крови и натрий повышаются, объем мочи существенно не уменьшается, отмечаются выраженная жажда, сухость слизистых оболочек, тахикардия [3, 12, 25].
Тест с десмопрессином проводится для дифференциальной диагностики центрального и нефрогенного несахарного диабета (ННД). Пациенту дается или 0,1 мг таблетированного десмопрессина (под язык до полного рассасывания), или 60 мкг в виде подъязычных лиофилизированных таблеток, или 10 мкг интраназально в виде спрея, спустя два и четыре часа определяют объем мочи и ОМ (см. табл. 2). Тест позволяет оценить чувствительность к действию экзогенного десмопрессина, то есть сохранение функциональной активности V2R [2, 3, 25].
Тест с десмопрессином проводится сразу после окончания теста с сухоедением, когда достигнут максимум возможности секреции/действия эндогенного АДГ.
В ходе теста пациенту разрешается пить (не более полуторакратного объема выделенной мочи на пробе с сухоедением).
Результаты пробы с десмопрессином свидетельствуют о наличии ЦНД, если после введения препарата ОМ увеличивается более чем на 50% относительно величин, достигнутых на фоне дегидратации. Отсутствие эффекта, то есть прирост ОМ менее 50%, может указывать на ННД [2, 3, 25].
На практике точная диагностика полиуритического состояния не всегда легка. Трудности возникают при дифференциальной диагностике ПП и частичных форм ЦНД и ННД. С одной стороны, у многих пациентов с ПП наблюдаются незначительные нарушения почечной концентрационной функции за счет постоянного вымывания минеральных веществ и мочевины из интерстициального пространства мозгового вещества почек, с другой – у пациентов с частичными формами заболевания отмечается остаточная секреция (при ЦНД) или чувствительность к аргинин-вазопрессину (при ННД) [3, 25].
Частичные формы несахарного диабета и первичную полидипсию в большинстве случаев легко разграничить с помощью назначения низких доз десмопрессина (0,1 мг два-три раза в день перорально, или 60 мкг лиофилизированных таблеток подъязычных два-три раза в день, или 10 мкг в сутки интраназально) в течение пяти – семи дней [3, 25].
Осмоляльность и натрий крови, осмоляльность мочи, суточный диурез и самочувствие оцениваются до и во время проведения пробного лечения.
При назначении низких доз десмопрессина у пациентов с ЦНД симптомы купируются, у больных ННД состояние в целом не меняется, у лиц с дипсогенной ПП может развиться гипотоническая гипонатриемия (табл. 3).
Определенную помощь в диагностике может оказать проведение пробы Зимницкого, предполагающей динамическое наблюдение относительной плотности мочи в течение суток. Эта проба характеризует состояние концентрационной и выделительной функции почек. Исследование проводится в условиях свободного приема жидкости (исключение избыточного потребления воды). В течение суток каждые три часа мочу собирают в отдельные банки, измеряют количество и определяют относительную плотность. В эти же временные промежутки учитывают объем выпитой жидкости. Пробу следует оценивать с учетом возможных экстраренальных потерь [26].
При сохраненной способности почек к осмотическому разведению и концентрированию мочи отмечаются:
- значительные колебания объема мочи в отдельных порциях (50–250 мл);
- максимальная относительная плотность мочи, характеризующая способность почек концентрировать мочу, не ниже 1020–1025 г/л;
- минимальная относительная плотность мочи, отражающая способность почек к осмотическому разведению мочи, ниже осмотической концентрации (осмоляльности) безбелковой плазмы, она обычно составляет 1003–1006 г/л;
- значительные колебания относительной плотности мочи (разница между максимальными и минимальными показателями) должны составлять не менее 12–16 г/л (например, от 1006 до 1020 или от 1010 до 1026 г/л и т.д.);
- значительные суточные колебания относительной плотности мочи связаны с сохранной способностью почек то концентрировать, то разводить мочу в зависимости от постоянно меняющихся потребностей организма;
- преобладание дневного диуреза над ночным (соотношение 3:1).
С целью выявления и последующего специализированного лечения патологии, являющейся причиной ЦНД (маркер патологии гипоталамо-гипофизарной области), также используются инструментальные методы [3, 12, 15]. МРТ головного мозга имеет ряд преимуществ перед другими методами визуализации. Она необходима для исключения органической природы заболевания, на которую приходится около 50% случаев. Метод позволяет распознать опухолевые или воспалительные образования, а также аномалии развития гипоталамо-гипофизарной области. Известно, что в норме на T1-взвешенных изображениях нейросекреторные гранулы вызывают образование высокоинтенсивного яркого пятна нейрогипофиза. Отличительная особенность ЦНД – отсутствие изображения нейрогипофиза или визуализация более тусклого свечения вследствие сниженного синтеза АДГ [27]. В отсутствие патологических изменений рекомендуется проведение МРТ в динамике, поскольку нередки случаи, когда ЦНД развивается за несколько лет до обнаружения самой опухоли.
Для гипофизита характерно значительное утолщение ножки гипофиза, которая после контрастного усиления приобретает гиперинтенсивный сигнал на T1-взвешенных изображениях [3, 15, 27].
Лечение
При недостаточности продукции АДГ необходима заместительная терапия аналогами гормона. Она направлена на восстановление и поддержание водно-солевого гомеостаза.
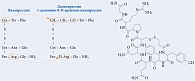
Наибольшей антидиуретической активностью среди синтезированных синтетических аналогов вазопрессина обладает 1-дезамино-8-D-аргинин-вазопрессин, десмопрессин – селективный агонист V2R [2, 3] (рис. 4).
Клинические эффекты препарата обусловлены взаимодействием десмопрессина со специфическими V2R почечных канальцев, способность активировать которые у него в 1,6 раза выше, чем у нативного вазопрессина [28, 29].
Особенности химической структуры десмопрессина обеспечивают не только устойчивость молекулы к разрушению, но и ряд важных клинических преимуществ по сравнению с природным гормоном. Так, замещение L-аргинина в восьмом положении цепи D-аргинином обусловливает пониженную сосудосуживающую активность (отношение антидиуретической активности к прессорной составляет примерно 2000:1 против 1:1 у природного пептида). Дополнительное дезаминирование цистеина в первом положении цепи еще больше повышает соотношение антидиуретической активности пептида к прессорной и увеличивает продолжительность действия десмопрессина.
Итак, антидиуретическое действие десмопрессина по сравнению с природным АДГ выражено в большей степени, как по силе, так и по продолжительности. При этом препарат практически лишен прессорной активности [28, 30].
При лечении десмопрессином важным моментом считается подбор минимально оптимальной дозы для конкретной лекарственной формы с целью устранения жажды и мочеизнурения. На фоне применения десмопрессина возможно развитие гипонатриемии и водной интоксикации, поэтому с учетом преимущественно пожизненного характера терапии крайне важны вопросы ее безопасности [2, 12, 31].
Разнообразие лекарственных форм десмопрессина (интраназальный спрей, пероральные таблетки, таблетки подъязычные) обеспечивает выбор наиболее эффективного варианта лечения в соответствии с состоянием больного и другими значимыми факторами [3, 30, 31].
Биодоступность существующих препаратов десмопрессина различается, что нивелировано разнообразием доз в разных формах выпуска (табл. 4).
Длительное время в качестве заместительной терапии ЦНД десмопрессин применялся в виде интраназального спрея (независимо от приема пищи) [29, 31]. При впрыскивании препарат распределяется по передней поверхности слизистой оболочки носовых ходов, фиксируется на ней, что обеспечивает длительный терапевтический эффект. Высокая интраиндивидуальная вариабельность действия этой формы десмопрессина может затруднять подбор дозы и повышать риск развития гипонатриемии [28, 29]. Следует учитывать, что абсорбция может нарушаться у пациентов с патологией слизистой оболочки носа, что, безусловно, ограничивает применение этой формы лекарственного средства при хроническом рините или катаральных явлениях. Противопоказаниями для интраназального применения десмопрессина являются аллергический ринит, заложенность носа, отек, рубцовые изменения слизистой оболочки носа, инфекции верхних дыхательных путей.
Начальная доза интраназальной формы десмопрессина для взрослых составляет по 10 мкг один-два раза в день. В дальнейшем ее изменяют в зависимости от эффекта. Терапевтическая доза десмопрессина индивидуальна – от 10 до 40 мкг/сут в один или несколько приемов.
Интраназальная форма наиболее часто применяется во время операций, в послеоперационном периоде, при резко выраженном негативизме к таблетированным препаратам [2, 3, 31].
Важным этапом фармакотерапии ЦНД стала разработка таблетированных форм десмопрессина – пероральной и подъязычной. Преимуществами таблетированных форм являются более широкие возможности изменения и подбора оптимальных доз, в большинстве случаев хорошая комплаентность пациентов лечению [1, 2, 31].
До недавнего времени на российском фармацевтическом рынке были представлены в основном импортные препараты десмопрессина.
На современном этапе развития здравоохранения РФ применение генерических препаратов, в том числе десмопрессина, в клинической практике является обоснованным как с медицинской, так и с экономической точек зрения.
Безусловно, при выборе препарата следует учитывать соблюдение производителем стандартов качества, процедур медико-биологического контроля (оценка биоэквивалентности).
Препарат вазопрессина Ноурем российского производителя «Канонфарма продакш» выпускается в виде таблеток пероральных по 0,1 и 0,2 мг и подъязычных по 60 и 120 мкг. Он разрешен для применения и у детей с пяти лет.
Широкий диапазон доз и наличие разных форм выпуска позволяют достаточно точно подбирать терапию с учетом индивидуальных характеристик пациентов с ЦНД.
Биоэквивалентность гарантирует схожесть терапевтического эффекта генерика и оригинального препарата. Сравнение фармакокинетики и терапевтической эквивалентности генерика Ноурем и референтного препарата продемонстрировало полную их биоэквивалентность [32, 33].
Согласно рекомендациям фармацевтического производителя, доза препарата Ноурем подбирается индивидуально, исходя из клинической ситуации и состояния больного с учетом сопутствующей патологии.
Прием с пищей снижает абсорбцию пероральной формы десмопрессина на 40%, в силу чего препарат рекомендуется принимать за 30 минут до или через два часа после еды.
Для больных ЦНД доза десмопрессина составляет 0,1–0,2 мг два-три раза в день [34].
Биодоступность десмопрессина при сублингвальном применении выше, чем при пероральном, и достаточна для того, чтобы обеспечить продолжительный антидиуретический эффект.
Сублингвальная форма десмопрессина быстро растворяется в ротовой полости и характеризуется стабильной фармакокинетикой. Это дает возможность лечить больных ЦНД с использованием меньших доз, что снижает риск развития гипонатриемии [34]. В целом риск гипонатриемии выше у лиц пожилого возраста, за счет повышения чувствительности почечных канальцев к АДГ, нарушения осморегуляции, недостаточно выраженного чувства жажды и нарушения способности почек сохранять натрий [2, 4]. Развитию данного осложнения способствует избыточное потребление жидкости.
Другим значимым преимуществом сублингвальной формы является отсутствие влияния приема пищи на абсорбцию и необходимости запивать препарат. Оптимальная поддерживающая доза составляет 60–120 мкг три раза в день [35, 36].
Клинический опыт применения сублингвальной формы десмопрессина продолжает накапливаться. Согласно регистру больных ЦНД Дании, три четверти пациентов получали сублингвальную форму. Ни об одном серьезном побочном эффекте не сообщалось [37].
С целью реализации терапевтического эффекта для каждой конкретной формы десмопрессина должны быть соблюдены определенные условия назначения (табл. 5) [3].
Особого внимания заслуживает начальный этап терапии десмопрессином с титрацией дозы до достижения клинического результата, что может сопровождаться увеличением риска гипонатриемии и водной интоксикации. На данный момент времени существуют несколько алгоритмов старта терапии десмопрессином в зависимости от лекарственной формы (табл. 6) [3]. Интраназальный спрей десмопрессина содержит сравнительно большую дозу, чем таблетированные формы, без возможности снижения, что делает ее избыточной для части пациентов с ЦНД. Поэтому применение интраназального спрея для инициации терапии может быть связано с большим риском водной интоксикации [37].
При необходимости смены одной лекарственной формы десмопрессина на другую (отсутствие эффекта, низкая приверженность терапии, сопутствующая патология) можно воспользоваться следующим ориентировочным перерасчетом дозы: клиническая эффективность 0,2 мг десмопрессина в пероральных таблетках равна эффективности 120 мкг десмопрессина в подъязычных таблетках и 10 мкг десмопрессина в виде интраназального спрея.
Следует рекомендовать пациентам потреблять жидкость в количестве, необходимом для удовлетворения жажды. Приема жидкости по любой другой причине следует избегать, так как в отличие от лиц с нормальной секрецией АДГ больные ЦНД не могут быстро увеличить диурез в ответ на увеличение потребления жидкости [3, 37]. Важно, чтобы на фоне фармакотерапии ЦНД суточный диурез не был ниже нормального уровня (15–30 мг/кг/сут).
При декомпенсации заболевания обязательно ведение дневника объема выпитой и выделенной жидкости.
Пациенты должны быть проинформированы о необходимости ограничить потребление жидкости и прекращения приема десмопрессина в случае рвоты, диареи, системных инфекционных заболеваний и повышения температуры и не возобновлять прием препарата до нормализации водно-электролитного баланса.
В процессе лечения осуществляется мониторинг эффективности назначенной терапии: контроль диуреза, частоты мочеиспускания ночью, массы тела, уровня электролитов (натрия, калия) в сыворотке крови [2, 3, 12]. Все эти мероприятия проводятся до стабилизации состояния.
Не следует считать терапевтической целью обязательное повышение относительной плотности мочи, особенно в каждой из проб анализа мочи по Зимницкому, поскольку не у всех пациентов с ЦНД на фоне клинической компенсации заболевания достигаются нормальные показатели концентрационной почечной функции (учет суточной физиологической вариабельности концентрации мочи, возраста, заболевания почек и др.).
При идиопатической форме ЦНД рекомендуется проведение МРТ головного мозга через 6 и 12 месяцев, далее ежегодно в течение пяти – семи лет после дебюта заболевания на предмет выявления возможной опухоли [3, 12].
Заключение
Несмотря на то что ЦНД относится к редкой нейроэндокринной патологии, он всегда должен оставаться в фокусе внимания врачей, поскольку нарушается способность сохранять воду в организме и существует риск развития тяжелой дегидратации. Ранняя диагностика заболевания на основании клинических признаков, анализа характера водно-электролитных нарушений с проведением диагностических тестов позволяет избежать тяжелой дегидратации и вовремя назначить адекватную терапию.
Наличие различных форм десмопрессина обеспечивает персонализированный подход к выбору лекарственного средства, что максимально оптимизирует лечебный процесс, повышает приверженность терапии.
Ye.V. Biryukova, MD, PhD, Prof., M.V. Shinkin
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Scientific and Practical Center
Contact person: Yelena V. Biryukova, lena@obsudim.ru
Violation of the water-salt balance often determines the symptoms and severity of many diseases course. One of the clinical manifestations of changes in water-electrolyte metabolism is polyuria-polydipsia. It is also recognized as the main indication of central diabetes insipidus – a rare neuroendocrine disease caused by insufficient production of antidiuretic hormone, as a result of which the renal reabsorption of water decreases and the large amount of urine with a low relative density is excreted, while the fluid intake compensatorily increases. To diagnose the disease, the dry-eating test and the desmopressin test are used. In the case of all forms of the disease with insufficient production of antidiuretic hormone, replacement therapy is vital. Substitution therapy for central diabetes insipidus can be carried out with different dosage forms of desmopressin: intranasal, tablet and sublingual. With any treatment option, the therapeutic dose is selected individually.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.