Цитокиновый статус мочи и результаты этиотропной терапии рецидива хронического бактериального цистита при разном сывороточном уровне витамина D
- Аннотация
- Статья
- Ссылки
- English
Цель. Изучить частоту и характер нарушений обмена витамина D и влияние этих нарушений на цитокиновый статус мочи у больных с рецидивом хронического бактериального цистита до и после этиотропной терапии.
Материал и методы. В исследование включены 30 здоровых женщин (контрольная группа) и 85 женщин с рецидивом хронического бактериального цистита (основная группа), которым исходно проводили бактериологические посевы мочи и определяли уровни интерлейкина (ИЛ) 8 и ИЛ-10 в моче, а также сывороточный уровень 25(ОН)D. Затем основная группа была разделена на две подгруппы: подгруппа 1 (n = 45) – с нормальным уровнем витамина D и подгруппа 2 (n = 40) – с дефицитом витамина D. В обеих подгруппах больные получали одинаковую этиотропную терапию: сначала нитрофурантоин перорально по 100 мг 3 раза в сутки семь дней, далее фосфомицина трометамол перорально по 3 г каждые 10 дней в течение трех месяцев. После окончания лечения проводили повторные бактериологические и иммунологические исследования мочи.
Результаты. Установлена достоверная обратная связь между сывороточным уровнем 25(OH)D и ретроспективной (в анамнезе) частотой рецидивов хронического бактериального цистита у больных основной группы (r = 0,652; n = 85; р = 0,001). Установлена достоверная прямая связь между средним значением сывороточного уровня 25(ОН)D и средними уровнями ИЛ-8 (r = 0,643; n = 85; р = 0,001) и ИЛ-10 (r = 0,445; n = 85; р = 0,001) соответственно в моче у больных с рецидивом хронического бактериального цистита. После окончания лечения при оценке уровней цитокинов в моче больных подгруппы 2 отмечено их достоверное снижение в ходе лечения (средний мочевой уровень ИЛ-8 снизился по сравнению с исходным уровнем в 1,9 раза, а средний мочевой уровень ИЛ-10 – в 3,15 раза соответственно; р < 0,001), однако к моменту окончания курса терапии сохранялся выраженный дисбаланс между средними уровнями про- и противовоспалительных цитокинов в моче: средний мочевой уровень ИЛ-8 оставался в 1,78 раза выше, а средний уровень ИЛ-10 – в 1,68 раза ниже, чем аналогичные средние значения показателей условно здоровой контрольной группы (р < 0,001). При этом степень микробиологической эрадикации из мочи уропатогенов, по данным бактериологических исследований мочи, в подгруппе 2, в отличие от подгруппы 1, составил всего 85,0% (р < 0,001).
Заключение. Дефицит витамина D следует рассматривать как иммуноопосредованный механизм патогенеза хронического бактериального цистита и независимый предиктор повышенного риска его рецидивов и снижения эффективности этиотропной терапии, в связи с чем скрининг на дефицит витамина D и его фармакологическая коррекция при выявлении целесообразны для всех больных с данной патологией.
Цель. Изучить частоту и характер нарушений обмена витамина D и влияние этих нарушений на цитокиновый статус мочи у больных с рецидивом хронического бактериального цистита до и после этиотропной терапии.
Материал и методы. В исследование включены 30 здоровых женщин (контрольная группа) и 85 женщин с рецидивом хронического бактериального цистита (основная группа), которым исходно проводили бактериологические посевы мочи и определяли уровни интерлейкина (ИЛ) 8 и ИЛ-10 в моче, а также сывороточный уровень 25(ОН)D. Затем основная группа была разделена на две подгруппы: подгруппа 1 (n = 45) – с нормальным уровнем витамина D и подгруппа 2 (n = 40) – с дефицитом витамина D. В обеих подгруппах больные получали одинаковую этиотропную терапию: сначала нитрофурантоин перорально по 100 мг 3 раза в сутки семь дней, далее фосфомицина трометамол перорально по 3 г каждые 10 дней в течение трех месяцев. После окончания лечения проводили повторные бактериологические и иммунологические исследования мочи.
Результаты. Установлена достоверная обратная связь между сывороточным уровнем 25(OH)D и ретроспективной (в анамнезе) частотой рецидивов хронического бактериального цистита у больных основной группы (r = 0,652; n = 85; р = 0,001). Установлена достоверная прямая связь между средним значением сывороточного уровня 25(ОН)D и средними уровнями ИЛ-8 (r = 0,643; n = 85; р = 0,001) и ИЛ-10 (r = 0,445; n = 85; р = 0,001) соответственно в моче у больных с рецидивом хронического бактериального цистита. После окончания лечения при оценке уровней цитокинов в моче больных подгруппы 2 отмечено их достоверное снижение в ходе лечения (средний мочевой уровень ИЛ-8 снизился по сравнению с исходным уровнем в 1,9 раза, а средний мочевой уровень ИЛ-10 – в 3,15 раза соответственно; р < 0,001), однако к моменту окончания курса терапии сохранялся выраженный дисбаланс между средними уровнями про- и противовоспалительных цитокинов в моче: средний мочевой уровень ИЛ-8 оставался в 1,78 раза выше, а средний уровень ИЛ-10 – в 1,68 раза ниже, чем аналогичные средние значения показателей условно здоровой контрольной группы (р < 0,001). При этом степень микробиологической эрадикации из мочи уропатогенов, по данным бактериологических исследований мочи, в подгруппе 2, в отличие от подгруппы 1, составил всего 85,0% (р < 0,001).
Заключение. Дефицит витамина D следует рассматривать как иммуноопосредованный механизм патогенеза хронического бактериального цистита и независимый предиктор повышенного риска его рецидивов и снижения эффективности этиотропной терапии, в связи с чем скрининг на дефицит витамина D и его фармакологическая коррекция при выявлении целесообразны для всех больных с данной патологией.




Введение
В настоящее время инфекции мочевыводящих путей (ИМП), поражающие как верхние (пиелонефриты), так и нижние (циститы) мочевые пути, остаются одними из наиболее распространенных инфекционных заболеваний человека, но, несмотря на существенный прогресс, достигнутый в области изучения их этиологии, патогенеза и методов лечения, остается нерешенным целый ряд вопросов. Известно, что ежегодная распространенность ИМП среди женщин старше 16 лет составляет не менее 11%, и именно ИМП являются одной из наиболее частых причин обращения к врачу и второй по распространенности причиной назначения антибиотиков после респираторных инфекций [1].
Если острые ИМП в большинстве случаев заканчиваются практически полным выздоровлением, то хронические ИМП представляют гораздо более серьезную проблему для психосоматического здоровья и социальной адаптации больных, поскольку эти заболевания склонны к рецидивирующему течению, что существенно снижает качество жизни больных [2]. Среди всего спектра рецидивирующих ИМП особое внимание обращает на себя рецидивирующий хронический бактериальный цистит (рХБЦ) как наиболее частая инфекция, развивающаяся у 10–20% женщин после первой атаки острого бактериального цистита [3].
По нашему мнению, ключевой практической проблемой данной формы ИМП остается сравнительно высокая частота тяжелых рецидивов заболевания, связанная с существенным снижением эффективности, даже целенаправленной (то есть индивидуально подобранной по результатам бактериологического исследования мочи), этиотропной антимикробной терапии. Все это поддерживает повышенный научный интерес к более глубокому исследованию механизмов патогенеза рХБЦ, которые бы позволили преодолеть существующие ограничения эффективности этиотропной терапии рецидивов заболевания, что ожидаемо могло бы снизить и частоту этих рецидивов.
В последние десятилетия активно изучаются иммунологические аспекты патогенеза рХБЦ, основанные, в частности, на исследованиях цитокинового статуса мочи, поскольку показано, что сигнальные молекулы системы врожденного (первичного) иммунитета (различные классы цитокинов) принимают непосредственное и самое активное участие в механизмах индукции и прогрессирования инфекционно-воспалительного процесса в мочевом пузыре, а также в регуляции процессов постинфекционной регенерации уротелия [4], что уже позволило внедрить в рутинную медицинскую практику метод локальной цитокинотерапии при лечении рХБЦ [5]. Однако ни в одном из доступных исследований роли цитокинов в патогенезе рХБЦ мы не нашли сведений о влиянии на цитокиновый обмен такого доказанного иммуномодулятора, как витамин D [6], хотя частота его дефицита в общей популяции, включая Российскую Федерацию, в настоящее время приобрела характер «мировой молчаливой неинфекционной пандемии» [7, 8]. В более ранних исследованиях у больных урологического профиля была выявлена высокая доля нарушений обмена витамина D, достигающая 68%, при этом у 52% урологических больных выявлялся абсолютный дефицит витамина D [9].
В настоящее время убедительно показано, что витамин D усиливает in vitro и in vivo выработку и повышает антимикробную активность важнейших цитокинов класса антимикробных пептидов (АМП), участвующих в механизмах первичного врожденного иммунного ответа кожи и слизистых оболочек, включая уротелий мочевых путей (прежде всего, β1- и β2-дефензинов и кателицидина LL-37) [10]. При этом обнаружена достоверная связь между уровнем кателицидина LL-37 в моче и частотой ИМП и выявлена достоверно более низкая экспрессия данного АМП у пациентов, подверженных ИМП, по сравнению со здоровыми субъектами [11].
Во многих современных публикациях убедительно подтверждена достоверная связь между дефицитом витамина D и более высокой частотой рецидивов ИМП у детей и взрослых [12, 13], в связи с чем прием добавок витамина D для профилактики ИМП стал предметом дальнейших научных исследований, проведенных преимущественно зарубежными авторами, по результатам которых Z. Han и соавт. (2025) провели метаанализ 50 рандомизированных контролируемых исследований (РКИ) с участием 10 495 пациентов с ИМП, в которых были изучены 14 различных профилактических «неантибактериальных» фармакологических вмешательств в монорежиме (D-манноза, иммунопрепараты, пробиотики, клюква, витамин D) и в виде комбинированной терапии (клюква + пробиотик + витамин А) [14]. Результаты этого метаанализа показали, что все вышеуказанные медикаментозные профилактические методы значительно снижали частоту ИМП по сравнению с плацебо в краткосрочной и/или долгосрочной перспективе, однако только витамин D продемонстрировал наибольшую противорецидивную эффективность у взрослых больных ИМП с длительным периодом наблюдения (≥ 1 года), хотя для более убедительного подтверждения этих данных крайне необходимы дальнейшие крупномасштабные исследования в популяции взрослых больных ИМП [14].
Несмотря на то что витамин D признан давно и убедительно доказанным иммуномодулирующим агентом, его влияние на цитокиновый статус мочи и результаты этиотропной терапии у больных рХБЦ до настоящего времени остаются практически не исследованными ни в зарубежной, ни в отечественной литературе. Вместе с тем можно предположить, что патогенетическая регуляция цитокин-опосредованных иммунных механизмов патогенеза рХБЦ посредством влияния на уровень витамина D (D-статус) у больных с целью активации природной антиинфекционной иммунореактивности мочевого пузыря может оказаться достаточно недорогой, но эффективной и безопасной лечебно-профилактической опцией при данной патологии.
Цель исследования – изучить частоту и характер нарушений обмена витамина D и их влияние на показатели цитокинового статуса мочи у больных с рецидивом хронического бактериального цистита до и после этиотропной антимикробной химиотерапии.
Материал и методы
В клиническое исследование вошли 85 женщин репродуктивного возраста (средний возраст 32,3 ± 3,5 года) с рецидивом хронического бактериального цистита (основная группа) и 30 клинически здоровых женщин аналогичного возраста (средний возраст 34,7 ± 3,5 года) без урологического анамнеза и патологии мочевой системы на момент исследования (контрольная группа), подписавших информированное добровольное согласие на участие в исследовании и использование полученных результатов в научных целях.
Критерии включения:
- возраст 18–45 лет;
- нормальный менструальный цикл;
- наличие в анамнезе хронического рецидивирующего бактериального цистита;
- наличие на момент исследования клинико-лабораторных критериев рецидива хронического бактериального цистита.
Критерии исключения:
- наличие инфекций, передаваемых половым путем, на момент исследования;
- самостоятельный прием антимикробных химиопрепаратов до обращения к врачу;
- острый или хронический пиелонефрит в анамнезе;
- прием добавок витамина D, эстроген-содержащих и противовоспалительных препаратов, а также иммуномодуляторов в течение последних шести месяцев;
- наличие онкологических, системных иммунологических и воспалительных заболеваний, а также гинекологических заболеваний в стадии обострения;
- период беременности и лактации.
Критериями диагноза «рецидив хронического бактериального цистита» согласно национальным клиническим рекомендациям были: наличие характерных клинических данных (жалобы на частое болезненное мочеиспускание малыми порциями мочи, рези и боль при мочеиспускании, императивные позывы к мочеиспусканию, боли в надлобковой области, отсутствие обильных выделений из влагалища) в сочетании с лейкоцитурией (наличие > 10 лейкоцитов в поле зрения при микроскопии осадка мочи в клиническом анализе мочи) и бактериурией (идентификация первичных уропатогенов группы I в диагностическом титре ≥ 103 КОЕ/мл или идентификация вторичных уропатогенов группы II в диагностическом титре ≥ 104 КОЕ/мл при стандартном микробиологическом исследовании мочи) [3, 15]. Длительность течения хронического бактериального цистита у пациенток основной группы, согласно данным анамнеза, составляла от 2 до 15 лет (в среднем 8,4 ± 2,8 года), при этом у 87,5% больных рХБЦ характеризовался достаточно длительным клиническим течением (от 4 до 10 лет).
У всех женщин контрольной и основной групп проводили оценку исходного уровня витамина D посредством определения концентрации его неактивного метаболита 25(ОН)D в сыворотке крови, взятой в утреннее время из кубитальной вены, методом иммунохемилюминесцентного анализа на автоматическом анализаторе UniCell DxI 800 Beckman Coulter Inc. (США) по методике производителя лабораторных реагентов. Сывороточный уровень 25(ОН)D определяли в нг/мл. Согласно российским клиническим рекомендациям, следует интерпретировать концентрацию 25(ОН)D в крови < 20 нг/мл как дефицит витамина D; концентрацию 25(ОН)D в крови ≥ 20 и < 30 нг/мл как недостаточность витамина D, а адекватным уровнем витамина D рассматривать сывороточный уровень 30–100 нг/мл [16]. Поскольку, как известно, дефицит витамина D и недостаточность витамина D не имеют достоверных отличительных или патогномоничных клинических симптомов, по которым можно было бы клинически дифференцировать эти два состояния, то в настоящем исследовании мы для удобства обработки полученных результатов ввели ограничение, согласно которому все показатели сывороточного уровня 25(ОН)D < 30 нг/мл мы интерпретировали как дефицит витамина D.
После рандомизации основной группы больных в зависимости от сывороточного уровня 25(ОН)D в ходе исследования были сформированы две новые подгруппы: подгруппа 1 (без дефицита витамина D) и подгруппа 2 (с дефицитом витамина D), в каждой из которых больные получали идентичную этиотропную терапию рецидива ХБЦ. Стартовой эмпирической этиотропной терапией в течение 5–7 дней сразу после сдачи образцов мочи для ее бактериологического исследования был прием нитрофурантоина перорально по 100 мг три раза в сутки, после чего по результатам бактериологического исследования мочи больным назначали целенаправленную этиотропную терапию фосфомицина трометамолом (к которому была выявлена 100%-ная чувствительность выделенных штаммов уропатогенов) в дозе 3 г один раз в 10 дней перорально на протяжении трех месяцев.
Для оценки иммунологических результатов проводимой этиотропной терапии рецидива ХБЦ у всех больных основной группы до и после курса лечения выполняли количественное определение в образцах утренней мочи уровней цитокинов интерлейкина (ИЛ) 8 и ИЛ-10 (цитокиновый статус мочи) методом иммуноферментного анализа с использованием тест-систем ООО «Цитокин» (Санкт-Петербург) по методике производителя лабораторных реагентов на иммуноферментном анализаторе Immunomat «Инститьют Вирион/Серион ГмбХ» (Германия) [17].
У здоровых женщин контрольной группы аналогичные исследования цитокинового статуса мочи проводили однократно, а полученные значения мочевых концентраций ИЛ-8 и ИЛ-10 использовали в качестве показателей условной нормы.
В качестве лабораторных критериев излеченности рецидива ХБЦ использовали показатель степени микробиологической эрадикации уропатогенов из мочи и полную нормализацию показателей цитокинового статуса мочи (мочевых уровней ИЛ-8 и ИЛ-10) после лечения.
Статистическая обработка данных выполнялась на индивидуальном компьютере с помощью электронных таблиц Microsoft Excel и пакета статистических программ Statistica V10 (StatSoft Inc., США) и SPSS Statistica V17 (США). Для оценки референсных интервалов уровня витамина D проводили проверку вариационных рядов на нормальность с помощью теста Шапиро – Уилка. Референсные интервалы (2,5 и 97,5 процентили) рассчитывались согласно рекомендациям Международной ассоциации клинической химии (IFSS) по статистической обработке референсных значений и Института клинических лабораторных стандартов (CLSI). Для оценки корреляционной зависимости применяли корреляционный анализ Пирсона (для нормально распределенных показателей) и непараметрический корреляционный анализ Спирмена. Статистическую значимость отличия параметров между исследуемыми группа оценивали с помощью теста Манна – Уитни. Различия между статистическими величинами считали статистически значимыми при уровне достоверности p < 0,05.
Результаты
На первом этапе исследования мы провели сравнительный анализ результатов измерений сывороточных уровней 25(ОН)D в контрольной и основной группах (табл. 1).
Как следует из таблицы 1, у 21 из 30 (70,0%) женщин контрольной группы дефицит витамина D отсутствовал (сывороточный уровень 25(ОН)D > 30 нг/мл), и только у 9 из 30 (30,0%) сывороточный уровень 25(ОН)D находился в диапазоне значений 20,1–29,9 нг/мл, что соответствовало наиболее легким нарушениям D-статуса – недостаточности витамина D.
В отличие от женщин контрольной группы, у больных основной группы наблюдались более выраженные и тяжелые нарушения обмена витамина D. Только у 45 из 85 (52,9%) пациенток данной группы сывороточный уровень 25(ОН)D оказался > 30 нг/мл, что соответствовало отсутствию дефицита витамина D, и этот показатель в 1,3 раза был достоверно меньше аналогичного показателя контрольной группы (р < 0,05). Частота более легкой по своим клиническим проявлениям недостаточности витамина D (сывороточный уровень 25(ОН)D в диапазоне 20,1–29,9 нг/мл) в основной группе также оказалась в 1,7 раза достоверно более низкой по сравнению с аналогичным показателем контрольной группы (р < 0,05). Однако, наиболее характерной особенностью D-статуса больных с рецидивом ХБЦ в основной группе явилось наличие у 29,4% (25 из 85 больных) абсолютного дефицита витамина D (сывороточный уровень 25(ОН)D < 20,0 нг/мл), который не был диагностирован ни у одной здоровой женщины контрольной группы.
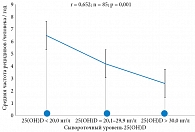
При корреляционном анализе (рис. 1) была установлена достоверная обратная связь между сывороточным уровнем 25(ОН)D и частотой рецидивов ХБЦ в анамнезе у больных основной группы (r = 0,652; n = 85; р = 0,001).
По результатам лабораторной оценки D-статуса на первом этапе исследования все больные основной группы были разделены на две подгруппы: подгруппа 1 (n = 45; больные без дефицита витамина D) и подгруппа 2 (n = 40; больные с дефицитом витамина D), у которых на следующих этапах исследования проводили оценку цитокинового статуса мочи до и после трехмесячного курса этиотропной антимикробной химиотерапии по поводу рецидива ХБЦ, а полученные результаты иммунологических исследований сравнивали с показателями контрольной группы. В контрольной и основной группах были женщины как с нормальным D-статусом, так и с его нарушениями, поэтому для стандартизации сравнительного анализа с показателями основной группы мы предварительно провели раздельную оценку цитокинового статуса мочи у больных контрольной группы в зависимости от их D-статуса. По нашему мнению, только по этому критерию между сравниваемыми группами могли быть определенные различия, которые следовало бы учитывать при статистической обработке результатов исследования в основной группе (табл. 2).
Как следует из табл. 2, исходя из средних уровней изучаемых цитокинов в моче здоровых женщин контрольной группы без признаков ИМП не было отмечено статистически достоверных различий, зависимых от уровня витамина D (р > 0,001), в связи с чем мы сочли нецелесообразным рандомизацию данной группы по показателям цитокинового статуса мочи в зависимости от сывороточного уровня 25(ОН)D. Для сравнения показателей цитокинового статуса мочи больных хроническим бактериальным циститом в качестве условно здоровой нормы были использованы средние значения уровней изучаемых цитокинов в моче женщин контрольной группы. По результатам исследования цитокинового статуса мочи больных с рецидивом ХБЦ до начала проведения этиотропной терапии были выявлены существенные и достоверные различия исходной иммунореактивности мочевого пузыря в зависимости от D-статуса женщин (табл. 3).
Как следует из табл. 3, средний уровень провоспалительного цитокина ИЛ-8 в моче у больных подгруппы 2 с дефицитом витамина D был в 3,4 раза выше уровня соответствующего цитокина в моче здоровых женщин контрольной группы, в то время как у больных подгруппы 1 без дефицита витамина D его концентрация в моче достигала 125,3 ± 10,5 пг/мл, то есть превышала среднее значение нормы в 8,8 раза и среднее значение у больных подгруппы 2 с дефицитом витамина D – в 3,8 раза (р < 0,001). Эти данные свидетельствуют о более выраженной активации провоспалительного компонента антиинфекционной иммунореактивности мочевого пузыря у больных подгруппы 1 с нормальным уровнем витамина D по сравнению с подгруппой 2 с дефицитом витамина D (р < 0,001).
Аналогичным образом зависел от сывороточного уровня 25(ОН)D мочевой уровень противовоспалительного цитокина ИЛ-10, который обуславливает индукцию противовоспалительного и регенераторного ответов при внедрении инфекционных агентов в различные органы, включая уротелий мочевого пузыря. Так, у больных подгруппы 2 с дефицитом витамина D уровень данного цитокина в моче достоверно превышал нормальные показатели контрольной группы только в 2 раза (4,54 ± 1,54 пг/мл против 2,13 ± 0,52 соответственно; р < 0,001), в то время как при отсутствии дефицита витамина D у больных подгруппы 1 его концентрация в моче увеличивалась до 8,45 ± 1,43 пг/мл, то есть была почти в 4 раза выше по сравнению с показателем здоровой контрольной группы и в 2 раза выше по сравнению с аналогичным показателем больных с дефицитом витамина D (р < 0,001). По нашему мнению, полученные результаты свидетельствовали о достоверно более выраженном противовоспалительном и регенераторном ответе у больных подгруппы 1 с нормальным уровнем витамина D по сравнению с подгруппой 2 пациенток с дефицитом витамина D (р < 0,001).
При проведении корреляционного анализа была установлена достоверная прямая связь между средним значением сывороточного уровня 25(ОН)D и средними уровнями ИЛ-8 (r = 0,643; n = 85; р = 0,001) и ИЛ-10 (r = 0,445; n = 85; р = 0,001) соответственно в моче у больных с рецидивом ХБЦ.
По нашему мнению, полученные результаты иммунологических исследований мочи убедительно свидетельствуют о достоверно более высоком уровне антиинфекционной цитокин-опосредованной иммунореактивности мочевого пузыря в ответ на внедрение в него бактериальных агентов исключительно у больных подгруппы 1 с нормальным уровнем витамина D по сравнению с больными подгруппы 2, имевшими различные нарушения D-статуса.
На втором этапе исследования, после трехмесячного курса этиотропной антимикробной химиотерапии, у больных обеих подгрупп 1 и 2, различавшихся между собой по D-статусу, проведена повторная оценка цитокинового статуса мочи, в ходе которой полученные показатели сравнивалась между подгруппами и с показателями контрольной группы, принятыми за условную норму (табл. 4).
Как следует из табл. 4, при оценке уровней цитокинов в моче у больных подгруппы 1 на фоне полной 100%-ной микробиологической эрадикации из мочи уропатогенов прослеживается четкая достоверная положительная динамика: не только снижение по сравнению с исходными значениями до лечения, но и полная нормализация цитокинового статуса мочи после окончания курса этиотропной антимикробной химиотерапии (р < 0,001). Так, по сравнению с исходными показателями до лечения средний мочевой уровень ИЛ-8 в процессе лечения снизился в 9 раз, а средний мочевой уровень ИЛ-10 – соответственно в 3,5 раза, и к моменту окончания лечения средние уровни указанных цитокинов в моче достоверно не отличались от аналогичных средних показателей условной нормы контрольной группы (р > 0,001).
При оценке уровней цитокинов в моче больных подгруппы 2 отмечено их достоверное снижение в ходе лечения (средний мочевой уровень ИЛ-8 снизился по сравнению с исходным уровнем в 1,9 раза, а средний мочевой уровень ИЛ-10 – в 3,15 раза соответственно; р < 0,001), однако к моменту окончания курса терапии сохранялся выраженный дисбаланс между средними уровнями про- и противовоспалительных цитокинов в моче: средний мочевой уровень ИЛ-8 оставался в 1,73 раза выше, а средний уровень ИЛ-10 – в 1,68 раза ниже, чем аналогичные средние значения показателей условно здоровой контрольной группы (р < 0,001). При этом степень микробиологической эрадикации из мочи уропатогенов, по данным бактериологических исследований мочи, в подгруппе 2, в отличие от подгруппы 1, составил всего 85,0% (р < 0,001).
Обсуждение
Согласно результатам исследования, отмечены более высокие общая частота нарушений D-статуса и частота тяжелого дефицита витамина D у больных хроническим бактериальным циститом по сравнению с клинически здоровыми женщинами. По полученным данным, только у 30,0% женщин контрольной группы были выявлены нарушения D-статуса, причем исключительно в легкой клинической форме (недостаточность витамина D). У больных основной группы одновременно были выявлены не только недостаточность витамина D (17,7%), но и абсолютный дефицит витамина D (29,4%), не характерный для здоровых женщин контрольной группы. В совокупности эти оба типа изменений, отражавших все нарушения D-статуса у больных хроническим бактериальным циститом, были выявлены у 47,1% больных, что достоверно превышало аналогичный показатель у здоровых женщин контрольной группы (30,0%) в 1,6 раза (р < 0,05).
Таким образом, практически у каждой второй пациентки рецидив ХБЦ протекал на фоне нарушений обмена витамина D, среди которых наиболее тяжелые нарушения (абсолютный дефицит витамина D) выявлялись достоверно в 1,7 раза чаще, чем более легкие нарушения в виде недостаточноcти витамина D (р < 0,05).
Аналогичных исследований в доступной отечественной литературе мы не обнаружили, в связи с чем полученные нами эпидемиологические данные о частоте дефицита витамина D у больных хроническим бактериальным циститом являются, пожалуй, одной из первых русскоязычных публикаций по изучаемой проблеме.
Вместе с тем, по данным одного из зарубежных исследований типа «случай – контроль», проведенного с участием 75 детей в возрасте двух – семи лет, было показано, что медианный сывороточный уровень 25(OH)D был достоверно ниже в группе с ИМП (14,5 нг/мл; 95%-ный доверительный интервал (ДИ) 9,4–18,8), чем в контрольной группе (27 нг/мл; 95% ДИ 22,4–39,0) (p < 0,001), а распространенность сывороточных уровней 25(OH)D < 20 нг/мл была выше у детей с ИМП, чем в контрольной группе (68 против 18%; р < 0,001) [18]. Таким образом, результаты этого исследования в педиатрической популяции больных ИМП в целом соответствуют эпидемиологическим данным, которые мы получили во взрослой когорте больных.
Выявленные нами в ходе ретроспективной оценки клинических данных достоверные корреляционные связи между низким сывороточным уровнем 25(ОН)D и высокой частотой рецидивов ХБЦ у взрослых пациентов в целом подтверждают результаты уже проведенных клинических исследований и метаанализов. Во многомерных моделях логистической регрессии также продемонстрирована достоверная связь между ИМП, с одной стороны, и сывороточными уровнями 25(ОН)D и женским полом, с другой (р < 0,05), при этом оба вида связей не зависели друг от друга и не были выявлены у мужчин [19].
Согласно результатам метаанализа 2019 г. Q-F. Deng и соавт. (9 РКИ и 1921 взрослый участник, из которых у 580 была диагностирована ИМП), дефицит витамина D достоверно связан с общим повышенным риском развития ИМП (суммарное отношение шансов (ОШ) 3,01; 95% ДИ 2,31–3,91) при умеренной гетерогенности исследований (I2 = 49,5%; р < 0,001). Средний сывороточный уровень 25(ОН)D был значительно ниже у женщин с ИМП по сравнению со здоровыми женщинами (стандартизированная средняя разница ((ССР) = -1,65; 95% ДИ -2,69–0,60; р < 0,001) [20]. Во всех исследованиях, вошедших в метаанализ, сравнивались взрослые пациенты с впервые возникшим острым эпизодом ИМП и взрослые здоровые добровольцы контрольной группы, и ни в одном из них не участвовали больные рецидивирующей ИМП, что в определенной степени снижает научную ценность и достоверность полученных результатов и не позволяет однозначно распространять их именно на больных с рецидивирующей ИМП, однако более новых метаанализов по данной тематике в доступной литературе мы не обнаружили.
В ходе нашего исследования также показаны статистически достоверные корреляционные связи цитокин-опосредованных провоспалительных, противовоспалительных и регенераторных клеточно-тканевых реакций на инфекционный агент, с сывороточным уровнем 25(ОН)D (р < 0,001), что подтверждает важную биологическую роль дефицита витамина D в патогенезе иммунологических нарушений при хроническом бактериальном цистите.
Следует сразу оговориться, что аналогичных исследований в доступной отечественной литературе по урологии мы не нашли, однако данные современных зарубежных исследований подтверждают нашу точку зрения. В частности, установлено, что рецепторы витамина D (VDR) экспрессируются во многих иммунокомпетентных клетках, а его активный метаболит 1,25(OH)2D (кальцитриол) усиливает хемотаксис, аутофагию и фаголизосомальное слияние клеток врожденного иммунитета [21]. Также показано, что иммунные клетки, помимо проявления чувствительности к действию витамина D, дополнительно способны самостоятельно метаболизировать его нативную форму 25(ОН)D (кальцидиол) в активную форму 1,25(ОН)2D (кальцитриол), что позволяет говорить о способности витамина D самостоятельно модифицировать функции иммунной системы как паракринными, так и аутокринными способами [22]. Кроме того, белок, связывающий витамин D, который регулирует гомеостаз витамина D в организме, является еще одной ключевой молекулой, способной также самостоятельно модулировать функции иммунной системы [23].
S.B. Ali и соавт. (2020) считают, что у женщин связь между низким уровнем витамина D в крови и повышенными рисками развития ИМП статистически достоверна в случаях умеренных и тяжелых форм ИМП. И в связи с растущей резистентностью уропатогенов к антибиотикам, вызывающей серьезную озабоченность во всем мире, именно витамин D как доказательно документированный регулятор иммунного ответа должен потенциально использоваться в сочетании с традиционной антимикробной химиотерапией ИМП, так как он способен существенно улучшить результаты лечения, особенно в случае мультирезистентных к лекарственным препаратам мочевых инфекций [24].
По нашему мнению, выявленные исходные существенные иммунологические нарушения в мочевом пузыре у больных с рецидивом ХБЦ подгруппы 2 с D-дефицитом в виде существенного снижения активности всех ключевых звеньев (провоспалительного, противовоспалительного и регенераторного) цитокин-опосредованного локального (мочепузырного) иммунного ответа при внедрении уропатогенов и развитии в мочевом пузыре инфекционно-воспалительного процесса позволяют объяснить описанную в литературе повышенную индивидуальную восприимчивость людей с дефицитом витамина D к любым инфекционным заболеваниям, включая ИМП [25].
Мы полагаем, что снижение антиинфекционной иммунореактивности мочевого пузыря, выявленное в ходе исследования у больных с дефицитом витамина D, с высокой долей вероятности может объяснять такую нередко наблюдаемую клиническую особенность рецидивов ХБЦ в урологической практике, как их более тяжелое, с точки зрения симптоматики, и/или более длительное течение, несмотря на, казалось бы, адекватный характер и объем назначенной этиотропной антимикробной химиотерапии. Мы можем высказать предположение, что многие из таких пациентов, скорее всего, при прочих равных условиях имеют недиагностированный и потому некорректированный дефицит витамина D.
Обсуждая результаты проведенных после курса этиотропной антимикробной химиотерапии иммунологических исследований в подгруппах 1 и 2 больных хроническим бактериальным циститом с различным D-статусом, следует отметить, что, очевидно, нам удалось выявить одну из возможных важных причин снижения эффективности современной стандартной этиотропной терапии заболевания у многих больных хроническим бактериальным циститом. Так, по результатам нашего исследования показано, что наиболее «гармоничные» c точки зрения антиинфекционной иммунореактивности и регенераторного ответа мочевого пузыря изменения цитокинового статуса мочи в ходе лечения рецидива ХБЦ наблюдались исключительно у больных подгруппы 1 с исходно нормальным уровнем витамина D. На фоне рецидива средний мочевой уровень ИЛ-8 повысился в 8,8 раза, средний мочевой уровень ИЛ-10 – в 3,9 раза по сравнению с нормальными значениями (р < 0,001), а к окончанию лечения они достоверно снизились (средний мочевой уровень ИЛ-8 – в 9 раз, а средний мочевой уровень ИЛ-10 – соответственно в 3,5 раза по сравнению с исходным уровнем; р < 0,001). И к моменту окончания курса терапии средние уровни указанных цитокинов в моче достоверно не отличались от аналогичных средних показателей условной нормы контрольной группы (р > 0,001). Следовательно, такая динамика мочевых цитокинов у больных подгруппы 1 с нормальным уровнем витамина D отражала полное завершение инфекционно-воспалительного процесса (рецидива) в мочевом пузыре и отсутствие иммунологических признаков персистенции постинфекционного резидуального (остаточного) хронического субклинического цитокин-опосредованного воспаления в мочевом пузыре.
В отличие от подгруппы 1 у пациенток подгруппы 2 с дефицитом витамина D после курса этиотропной терапии в моче сохранялись выраженные иммунологические нарушения, которые проявлялись в сохранении существенного дисбаланса между средними мочевыми уровнями про- и противовоспалительных цитокинов (средний уровень ИЛ-8 мочи оставался в 1,78 раза выше, а средний уровень ИЛ-10 мочи оказался в 1,68 раза ниже по сравнению с аналогичными средними значениями показателей условно здоровой контрольной группы; р < 0,001). Мы считаем, что эти нарушения отражают незавершенность инфекционно-воспалительного процесса в мочевом пузыре вследствие персистенции в нем постинфекционного декомпенсированного резидуального (остаточного) хронического субклинического цитокин-опосредованного воспаления на фоне сохраняющегося дефицита витамина D, что может существенно снижать эффективность стандартной этиотропной антимикробной химиотерапии рецидива ХБЦ и в большей степени повышать риски рецидивов заболевания у пациенток с дефицитом витамина D, чем у пациенток без него.
Выводы
- Для больных хроническим бактериальным циститом характерна достоверно более высокая частота дефицита витамина D по сравнению со здоровыми женщинами, при этом сывороточный уровень 25(ОН)D находится в достоверной обратной связи с частотой рецидивов заболевания.
- Мочевые уровни цитокинов ИЛ-8 и ИЛ-10 при хроническом бактериальном цистите также демонстрируют статистически достоверные корреляционные связи с сывороточным уровнем 25(ОН)D, что позволяет говорить об участии витамина D в регуляции антиинфекционной иммунореактивности и регенераторного ответа мочевого пузыря у больных хроническим бактериальным циститом.
- Дефицит витамина D сопровождается выраженным угнетением всех основных звеньев (провоспалительного, противовоспалительного и регенераторного) локального иммунитета мочевого пузыря, что приводит к персистенции в мочевом пузыре постинфекционного декомпенсированного резидуального (остаточного) хронического субклинического цитокин-опосредованного воспаления после курса этиотропной терапии. Это один из важных патогенетических аспектов установленной в данном и других исследованиях связи дефицита витамина D с высоким риском рецидивов хронического бактериального цистита, с одной стороны, и ключевая причина снижения эффективности противорецидивной этиотропной антимикробной химиотерапии – с другой.
- Дефицит витамина D следует рассматривать как важный системный механизм патогенеза хронического бактериального цистита, а также как независимый предиктор повышенного риска его рецидивов и снижения эффективности этиотропной терапии, в связи с чем скрининг на дефицит витамина D и его фармакологическая коррекция при выявлении целесообразны для всех больных с данной патологией.
Финансирование. Работа выполнена без спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
O.I. Bratchikov, PhD, Prof., E.A. Koryagin, I.A. Tyuzikov, PhD
Kursk State Medical University
Medical Center Tandem Plus, Yaroslavl
Contact person: Evgeny A. Koryagin, e-koryagin@bk.ru
The results of etiotropic therapy of recurrent chronic bacterial cystitis in a number of cases remain unsatisfactory, which stimulates the search for new effective «non-antibacterial» methods of treatment and prevention of the disease. In this regard vitamin D has long been a well-proven immunomodulatory agent, but its effect on the cytokine status of urine and treatment outcomes in patients with this pathology has so far remained virtually unexplored.
Aim. To study the frequency and nature of vitamin D metabolic disorders and their effect on the cytokine status of urine in patients with recurrent chronic bacterial cystitis before and after etiotropic therapy.
Material and methods. The study included 30 healthy women (control group) and 85 women with recurrent chronic bacterial cystitis (main group), who initially underwent bacteriological urine cultures and determination of levels of IL-8 and IL-10 in urine, as well as serum levels of 25(OH)D, based on which the main group was divided into two subgroups: subgroup 1 (n = 45) with normal vitamin D levels and subgroup 2 (n = 40) with vitamin D deficiency. In both subgroups, patients received the same etiotropic therapy (100 mg oral nitrofurantoin 3 times a day for 7 days, followed by 3 g oral fosfomycin trometamol every 10 days for 3 months) with repeated bacteriological and immunological urine tests.
Results. A reliable feedback relationship has been established between the serum level of 25(OH)D and the retrospective (in the anamnesis) recurrence rate of chronic bacterial cystitis in patients of the main group (r = 0.652; n = 85; p = 0.001). A reliable direct relationship has been established between the average serum level of 25(OH)-D and mean levels of IL-8 (r = 0.643; n = 85; p = 0.001) and IL-10 (r = 0.445; n = 85; p = 0.001), respectively, in the urine of patients with recurrent chronic bacterial cystitis. After the end of treatment, when assessing cytokine levels in the urine of patients in subgroup 2, they significantly decreased during treatment (the average urinary level of IL-8 decreased by 1.9 times compared to the baseline level, and the average urinary level of IL-10 decreased by 3.15 times, respectively; p < 0.001), however, by the end of the course of therapy, there was a pronounced imbalance between the average levels of pro- and anti-inflammatory cytokines in the urine: the average urinary level of IL-8 remained 1.78 times higher, and the average level of IL-10 was 1.68 times lower than the similar average values of the conditionally healthy control group (p < 0.001). At the same time, the degree of microbiological eradication from the urine of uropathogens, according to bacteriological studies of urine, in subgroup 2, in contrast to subgroup 1, was only 85.0% (p < 0.001).
Conclusion. Vitamin D deficiency should be considered as an immune-mediating mechanism of the pathogenesis of chronic bacterial cystitis and an independent predictor of an increased risk of its recurrence and a decrease in the effectiveness of etiotropic therapy, and therefore screening for vitamin D deficiency and its pharmacological correction are appropriate for all patients with this pathology.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


