В настоящее время ультразвуковое исследование является оптимальным диагностическим методом в практике неонатолога, учитывая его безвредность, высокую информативность, неинвазивность, доступность и простоту выполнения [3]. Следует отметить, что применяемые ранее рентгенографические методы исследования надпочечников сейчас используются весьма ограниченно в связи с необходимостью специальной подготовки ребенка, вредным воздействием излучения и низкой информативностью. Таким образом, эхография является методом выбора уже на первом этапе применения среди визуализирующих инструментальных методов диагностики (КТ, МРТ) [4, 5]. Цель проведенной работы заключалась в определении анатомических и эхографических параметров надпочечников, в том числе визуализации органного кровотока у здоровых новорожденных и детей, имеющих осложненное течение раннего неонатального периода.
Надпочечники расположены ретроперитонеально, у новорожденных детей их топография асимметрична – правый находится ниже левого, который иногда оказывается смещенным с верхнего полюса почки к ее воротам по латеральной или медиальной поверхности [2]. Правый надпочечник чаще имеет форму треугольника, а левый напоминает полумесяц. Снаружи надпочечник окружен фиброзной капсулой из плотной волокнистой соединительной ткани, от которой в толщу железы отходят соединительнотканные перегородки. Строма надпочечника состоит из рыхлой волокнистой соединительной ткани, поддерживающей эпителиальные клетки и содержащей огромное количество кровеносных капилляров с фенестрированным эндотелием, паренхима – из совокупности эпителиальных клеток, имеющих различное строение на разном расстоянии от капсулы надпочечника.
Кровоснабжение коры надпочечника осуществляется из трех источников: верхней надпочечниковой артерии (ветвь нижней диафрагмальной артерии), средней надпочечниковой артерии, отходящей непосредственно от брюшной части аорты, нижней надпочечниковой артерии (ветвь почечной артерии). Отток венозной крови осуществляется через центральную надпочечниковую вену. Центральная вена правого надпочечника (длиной около 1 см) впадает в нижнюю полую вену, а вена левого надпочечника, которая несколько длиннее правой (2–4 см), впадает в почечную вену. Преимущественно из левого надпочечника выходят многочисленные мелкие вены, которые впадают в притоки воротной вены.
Высокая функциональная значимость надпочечников определяется продукцией целого ряда гормональных субстанций, обладающих большим разнообразием биологических свойств и широким спектром действия на обменные процессы, регулирующих жизненно важные функции и играющих значительную роль в осуществлении защитно-приспособительных реакций организма. Продукция гормона кортизола, являющегося важнейшим адаптивным стероидом, регулируется гипофизом с помощью адренокортикотропного гормона (АКТГ), но и активность гипофиза зависит от количества кортизола в крови – по механизму обратной отрицательной связи увеличение концентрации кортизола в крови снижает продукцию АКТГ передней долей гипофиза, что, в свою очередь, ведет к уменьшению синтеза кортизола надпочечниками. Важная роль в регуляции образования и секреции АКТГ принадлежит центральной нервной системе.
В регуляции этого типа принимает участие ряд нейромедиаторов, в том числе норадреналин, ацетилхолин и серотонин. Скорее всего, именно нейромедиаторы опосредуют стрессорную реакцию со стороны АКТГ, который стимулирует продукцию глюкокортикоидов, необходимых для адаптации к стрессам при различных воздействиях на организм. При длительных и особо угрожающих жизни стрессогенных воздействиях в механизме обратной связи, прерывающей секрецию кортикостероидов (КС), могут возникать сбои, когда взаимодействие между нервными и химическими механизмами разлаживается. Обнаружено, что при этом КС связываются с особым белком крови – транскортином (ТР). Соединение «КС + ТР» задерживается гематоэнцефалическим барьером, поэтому в мозг перестает поступать информация об избытке КС в крови и секреция АКТГ не прерывается.
Когда обратная отрицательная связь, ограничивающая рост уровня КС, не срабатывает, начинается стадия истощения. Избыточное накопление гормонов коры надпочечников в жидких средах организма ведет к расстройству его функций, которое распространяется постепенно на нервную и эндокринную систему, захватывая сердце, сосуды, легкие, органы пищеварения. Предполагается, что характер патологического синдрома связан с тем, какие звенья адренергической системы оказываются несостоятельными и не выдерживают сильного напряжения и какая форма нарушений при этом возникает: возбуждение, истощение, образование промежуточных продуктов метаболизма [6, 7, 8]. Таким образом, гипоталамо-гипофизарно-адреналовая система участвует в осуществлении механизмов адаптации новорожденных детей к внеутробной жизни, что определяет важность и необходимость исследования надпочечников у детей в перинатальном периоде.
Материал и методы исследования
Комплексное ультразвуковое обследование надпочечников у новорожденных детей проводилось на базе перинатального центра ГКБ № 7. Использовался ультразвуковой аппарат экспертного класса М-Turbo (SonoSite, США) с линейным широкополосным датчиком частотой 10–16 МГц. Надпочечники определялись при расположении датчика между передней и средней подмышечными линиями. При продольном сканировании оценивались высота и ширина органа, а при поперечном – его толщина [2].
В исследование были включены 167 новорожденных детей (71 девочка и 96 мальчиков). Первую группу (группу сравнения) составили 79 новорожденных с неосложненным течением раннего неонатального периода. Среди детей этой группы 60 новорожденных были доношенными, 19 – недоношенными с гестационным возрастом 33–37 недель. Масса тела при рождении недоношенных детей группы сравнения составляла от 1870 до 3790 г (длина тела 42–52 см), а доношенных – от 2150 до 4220 г (длина тела 45–54 см). Все дети, включенные в группу сравнения, на момент исследования являлись условно здоровыми или имели незначительные отклонения в состоянии здоровья: слабо выраженные нарушения гемоликвородинамики без структурных изменений, конъюгационную желтуху 1-й степени – или находились в отделении с целью выхаживания.
Вторую (основную) группу составили 88 новорожденных, среди них 16 доношенных детей и 72 недоношенных ребенка. В число недоношенных включены 12 детей, рожденных на 25–28-й неделях беременности, 26 недоношенных с гестационым возрастом 29–32 недели и 34 ребенка, родившихся на 33–37-й неделях гестации. Масса тела при рождении недоношенных детей 25–28 недель гестации составляла от 790 до 990 г (длина тела 33–34 см); детей 29–32 недель гестации – от 1060 до 2190 г (длина тела 35–42 см); недоношенных с гестационным возрастом 33–37 недель – от 1610 до 3290 г (длина тела 42–51 см). Масса тела при рождении доношенных детей второй группы составляла от 2540 до 4460 г при длине тела от 46 до 57 см. Дети второй группы на момент исследования характеризовались наличием патологических состояний органов дыхания (врожденных пневмоний), выраженных ишемических поражений головного мозга различной степени тяжести, в том числе со структурными изменениями в ЦНС, то есть отличались тяжелым, осложненным течением раннего неонатального периода. Среди детей данной группы на аппаратной вентиляции легких находился 51 новорожденный ребенок (длительность ИВЛ составляла от нескольких дней до месяца), 10 детям кислородотерапия проводилась другими методами (палатка, носовой катетер). Низкую оценку по шкале Апгар (менее 5 баллов) имели 22 (25%) новорожденных основной группы. Среди новорожденных группы сравнения только 1 ребенок (1,3%) характеризовался низкой оценкой по шкале Апгар. Ультразвуковое исследование надпочечников осуществлялось в возрасте одной, двух, трех недель и одного месяца жизни детей с целью выяснения возрастной динамики размеров данной эндокринной железы.
Всем обследуемым детям проводилось ультразвуковое сканирование надпочечников в В-режиме. В процессе исследования оценивались расположение надпочечников, их форма, характеристика контуров органа, эхогенность, эхоструктура, дифференцировка слоев и проводилось определение линейных размеров, используемых для расчета объема органа: ширины основания надпочечника, его высоты и толщины (рис. 1, 2). Кроме обзорного ультразвукового исследования использовался режим цветового и энергетического допплеровского картирования, проводилась импульсно-волновая допплерометрия кровотока в артериях надпочечника. Чаще всего визуализировалась средняя надпочечниковая артерия (наиболее крупная ветвь брюшного отдела аорты), однако параметры кровотока в ней, по литературным данным, достоверно не отличаются от таковых в других надпочечниковых артериях [9]. Используя полученные при обзорной эхографии данные, произведен расчет суммарного объема надпочечников путем сложения объемов правой и левой железы, вычисленных по формуле: V = 0,520 × A × B × C, где А, В, С – линейные размеры надпочечников (см), 0,520 – коэффициент пересчета, вычисленный экспериментальным путем.
В процессе исследования для каждого ребенка был проведен подсчет площади поверхности тела с учетом весо-ростовых показателей, рассчитывалось отношение суммарного объема надпочечников новорожденного к площади поверхности тела. Статистическая обработка результатов проводилась стандартными методами. Количественные параметры представлены в виде значений средней арифметической с поправкой на стандартную ошибку средней величины (М ± m). Различия гипотез считали достоверными при уровне значимости р < 0,05. В процессе исследования была проведена оценка функционального состояния коры надпочечников в раннем неонатальном периоде путем определения в крови новорожденных двухнедельного возраста концентрации стероидного гормона кортизола, который является одним из важнейших адаптивных факторов. Для этого иммунохемилюминисцентным методом на автоматизированной системе IMMULITE 2000 (Siemens) был определен уровень общего кортизола в сыворотке крови 40 детей, из них 8 детей группы сравнения (4 недоношенных и 4 доношенных ребенка) и 32 новорожденных основной группы (24 недоношенных и 8 доношенных детей).
Результаты исследования и их обсуждение
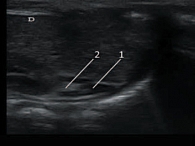
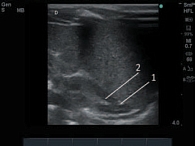
В результате проведенного ультразвукового исследования были получены следующие данные: у здоровых доношенных и недоношенных детей первой группы надпочечники визуализированы в типичном месте как структуры с четкими, ровными контурами, преимущественно треугольной (справа) и полулунной (слева) формы, четкой дифференцировкой на гиперэхогенный мозговой и гипоэхогенный корковый слои (рис. 3). У детей второй группы при двумерном сканировании надпочечники имели обычное расположение, по форме, эхоструктуре и дифференцировке слоев были аналогичны надпочечникам новорожденных первой группы. Однако граница между гиперэхогенным мозговым и гипоэхогенным корковым веществом не всегда была ровной, хотя сохраняла четкость у всех новорожденных второй группы. Следует отметить, что в эхоструктуре гиперэхогенного мозгового слоя надпочечников у детей второй группы отмечалось большое количество одиночных гипоэхогенных включений, а в гипоэхогенном корковом веществе выявлялись гиперэхогенные включения (рис. 4, 5). Особенно ярко выраженные структурные изменения в виде неровности контуров и неоднородности структуры органа за счет включений отмечены при исследовании 10 глубоко недоношенных детей второй группы, что составляет 83% от общего числа обследуемых детей с гестационным возрастом 25–28 недель. Среди других категорий недоношенных детей, входящих в основную группу, данные эхографические изменения также выявлялись в большинстве случаев, хотя носили менее выраженный характер: у 18 новорожденных 29–32 недель гестации, что составляет 69%; у 19 детей 33–37 недель гестации (56%). Доношенные дети второй группы характеризовались аналогичными особенностями ультразвуковой картины, однако среди этой категории обследованных они отмечались значительно реже (у 5 (31%) детей).
При эхографическом исследовании в В-режиме измерялись линейные размеры надпочечников: высота, ширина и толщина. При анализе полученных данных установлено, что значения ширины основания и высоты надпочечников колеблются в широком диапазоне у всех обследованных детей. Ширина основания надпочечников детей группы сравнения составляла от 5 до 14 мм, высота надпочечников – от 9 до 18 мм вне зависимости от сторонности. В отличие от весьма вариабельных значений ширины и высоты надпочечника, величина его толщины в поперечном сечении изменялась строго в определенных пределах. По полученным в результате исследования данным, границы разброса этого параметра составляют от 2,0 до 6 мм для детей, находящихся на разных этапах раннего возраста, как условно здоровых, так и детей с пневмониями и тяжелыми гипоксическими поражениями головного мозга. В связи с этим ключевое значение для эхографической характеристики данной эндокринной железы имеет измерение толщины надпочечника при его поперечном сканировании. В процессе исследования отмечено, что максимальный показатель толщины в первой группе характерен для первых дней жизни ребенка, а далее следует его уменьшение (табл. 1). Значения толщины надпочечников у детей первой и второй недели жизни достоверно отличались как с правой, так и с левой стороны. Между остальными возрастными группами статистически подтвержденных различий толщины надпочечников выявлено не было. Значения параметра толщины колебались от 2,0 до 6 мм среди здоровых доношенных детей и от 2,0 до 5 мм – среди здоровых недоношенных новорожденных.
С помощью корреляционного и регрессионного анализов установлено, что между значением толщины надпочечника и величиной его объема существует сильная прямая положительная корреляционная связь. Выявленная закономерность позволяет использовать параметр толщины как основную характеристику надпочечника при оценке его объема. На основании измерения линейных значений надпочечников было проведено вычисление объемов правой и левой железы, затем подсчет суммарного объема надпочечников посредством сложения полученных данных. При анализе и сопоставлении результатов вычислений было установлено, что изменение суммарного объема надпочечников у детей имеет определенную возрастную закономерность. Здоровые новорожденные первой недели жизни характеризовались наибольшим по сравнению с другими возрастными категориями детей первой группы суммарным объемом надпочечников. В результате расчета отношения суммарного объема к площади поверхности тела ребенка среди здоровых новорожденных максимальное значение получено также для детей первой недели жизни. С восьмого дня до трехнедельного возраста имело место снижение величины суммарного объема надпочечников в группе здоровых детей, а затем отмечен постепенный подъем данного параметра к месяцу жизни (табл. 3). Возрастная динамика этого показателя у детей основной группы представлена в таблице 4.
Учитывая различия в весо-ростовых показателях обследованных детей, в целях получения адекватной оценки объемных показателей надпочечников было проведено вычисление отношения суммарного объема надпочечников к площади поверхности тела каждого обследованного ребенка (табл. 5, 6). При анализе полученных результатов выяснено, что дети второй группы характеризуются большими значениями отношения суммарного объема надпочечников к площади поверхности тела, чем в первой группе во всех возрастных категориях. Это свидетельствует о том, что на единицу площади поверхности тела у детей с выраженными патологическими изменениями в организме приходится большее значение суммарного объема надпочечников, чем у здоровых детей. При оценке достоверности статистически значимые различия подтверждены между доношенными детьми первой и второй групп в возрасте одной, трех недель и месяца жизни. Для недоношенных детей 33–37 недель гестации с патологическими изменениями и условно здоровых недоношенных новорожденных того же гестационного возраста статистически достоверных различий не выявлено. Вероятно, возрастание отношения суммарного объема надпочечников к площади поверхности тела у недоношенных детей основной группы, рожденных на 25–32-й неделях гестации, связано с обеспечением адаптивных нейроэндокринных реакций адреналовой системы и включением компенсаторных механизмов в условиях наличия патологических изменений в организме.
Допплерометрическое исследование в импульсно-волновом режиме было проведено 64 детям первой группы (среди них 9 недоношенных и 55 доношенных новорожденных) и 66 детям второй группы (из них 50 недоношенных и 16 доношенных новорожденных). Значимых различий в параметрах кровотока среди детей различного возраста выявлено не было, поэтому представленные в таблице 7 данные не разделены по возрастам. В результате проведенного биохимического исследования на определение общего кортизола отмечено, что здоровые доношенные и недоношенные новорожденные группы сравнения и дети 33–37 недель гестации, а также доношенные дети основной группы характеризуются нормальным уровнем данного гормона в крови, то есть его содержание соответствует общепринятым референтным значениям в этой возрастной группе (от 190 до 1300 нмоль/л). У недоношенных детей от 25 до 32 недель гестации с патологическими изменениями в организме имело место статистически значимое снижение концентрации кортизола в крови по сравнению с доношенными детьми основной группы (табл. 8). Это может свидетельствовать о нарушении функционального состояния коркового вещества надпочечников в период развернутой клинической картины заболевания у недоношенных детей гестационного возраста 25–32 недели.
Следует отметить, что наряду с низким уровнем кортизола у большей части недоношенных новорожденных от 25 до 32 недель гестации с патологическими изменениями в организме чаще, чем в других категориях обследуемых, наблюдаются эхографические изменения в структуре надпочечников в виде наличия неровностей контуров железы, а также нечеткости границы между слоями, неоднородности внутренней структуры с появлением гипоэхогенных включений в мозговом слое и гиперэхогенных тяжей и включений в корковом веществе. Полученные данные свидетельствуют о том, что эхографические изменения в структуре надпочечников, обнаруженные у недоношенных новорожденных с гестационным возрастом от 25 до 32 недель, позволяют прогнозировать возможное снижение уровня кортизола у данной категории детей. Выявленная особенность этой части обследованных указывает на необходимость определения концентрации кортизола в крови при наличии изменений структуры надпочечников у них по данным эхографии.
Таким образом, ультразвуковой метод исследования в детской практике является приоритетным для комплексной оценки состояния надпочечников, поскольку позволяет оценить их структурные и гемодинамические характеристики. Новорожденные, имеющие различные патологические состояния, характеризуются большим значением отношения суммарного объема надпочечников к площади поверхности тела по сравнению со здоровыми детьми группы сравнения. У большинства недоношенных детей от 25 до 32 недель гестации с патологическими изменениями в организме имело место значимое достоверное снижение концентрации кортизола в крови, что указывает на функциональную недостаточность коры надпочечников на высоте патологического процесса у недоношенных детей данного гестационного возраста. Полученные в процессе исследования результаты позволяют предположить, что наличие патологических изменений вызывает активацию адаптивных процессов организма, в том числе реакцию адреналовой системы, необходимую для поддержания оптимального гомеостаза в организме и компенсации имеющихся нарушений.