Упругие свойства предстательной железы как предиктор патологических изменений
- Аннотация
- Статья
- Ссылки
- English
![Таблица 1. Исходные характеристики 75 пациентов в группах доброкачественного и злокачественного новообразований (J. Duan и соавт.) [10]](/upload/resize_cache/iblock/f0b/o79qdqz1hf101rz16lehk19z49pzns0z/195_350_1/Muslov2.jpg)
![Таблица 2. Корреляция между m-Emax и ДГПЖ (N. Huang и соавт.) [11]](/upload/resize_cache/iblock/6c2/y59jmku92myfctsih0hfbd9c4bk1gna3/195_350_1/Muslov3.jpg)
![Таблица 3. Корреляция между m-Emax и РПЖ (N. Huang и соавт.) [11]](/upload/resize_cache/iblock/133/z2o2loe2xjkpi72hqwruk3406vewbz1l/195_350_1/Muslov4.jpg)
![Таблица 4. Упругие модули различных зон простаты [19]](/upload/resize_cache/iblock/368/oy52bcnufo2x5y8ma3c8eutt24415wjy/195_350_1/Muslov6.jpg)
![Таблица 5. Результаты исследования распределения жесткости ткани ПЖ (кПа) (O. Rouvière и соавт.) [21]](/upload/resize_cache/iblock/e6c/5gp613fdj665nxrunvrm0gp994tctb43/195_350_1/Muslov7.jpg)
![Таблица 6. Параметры гиперупругой модели Йео для нормальной и раковой тканей предстательной железы (S.R. Mousavi и соавт.) [28]](/upload/resize_cache/iblock/83b/fie79b0qjt92bd42cjjr53wvv6mfokru/195_350_1/Muslov8.jpg)
![Таблица 8. Информативность пороговых значений эластографии сдвиговой волной (SWE) в диагностике ДГПЖ (М.З. Хасанов) [41]](/upload/resize_cache/iblock/801/x94lktlbs8hvvjezg9sqzwxg52dg1j36/195_350_1/Muslov10.jpg)

Введение
Прямая механическая характеристика ткани – это применение инженерных методов к биологической ткани для определения ее жесткости или эластичности, которые могут изменяться в зависимости от патологических состояний. Опубликован ряд статей о применении этих методов к ткани предстательной железы (ПЖ) с различными результатами (N.P. Kelly и соавт.) [1].
Цель данного исследования – определить упругие и гиперупругие свойства ПЖ и выяснить полезность прямой механической характеристики тканей железы для выявления патологических состояний.
Результаты и обсуждение
Модуль упругости описывает жесткость ткани; более жесткие ткани имеют более высокий модуль упругости, чем более мягкие. Поскольку деформация обратно пропорциональна модулю упругости, при заданном напряжении более жесткие структуры демонстрируют меньшую деформацию или смещение, а более мягкие ткани – большую. Для измерения движения ткани можно использовать как магнитно-резонансную томографию (МРТ), так и ультразвук. В последние годы возникло направление, основанное на использовании сдвиговых волн для оценки состояния органов и тканей – ультразвуковая эластография сдвиговой волной (В.Г. Андреев и соавт.; A.P. Sarvazyan и соавт.) [2, 3]. Методами эластографии измеряется смещение ткани в ответ на приложенное напряжение и создаются изображения смещений или деформации ткани, отражающие относительные различия в жесткости ткани (Prostate Elastrography, 2025) [4].
Действительно, помимо сжатия-растяжения ткани в ней могут возникать сдвиговые волны. Эти сдвиговые волны распространяются в направлении, перпендикулярном направлению распространения волны. Пространственное и временное поведение сдвиговой волны в ткани регулируется волновым уравнением:
![]()
где u – величина смещения ткани, c – скорость волны, 2 – дифференциальный оператор Лапласа (дивергенция градиента).
Уравнение (1) связывает пространственное поведение волны (левая часть уравнения) с временным поведением (правая часть). Кроме того, существует коэффициент пропорциональности c, который называется скоростью волны сдвига. Скорость сдвиговой волны можно связать с модулем сдвига через понятия линейной упругости и однородности ткани:
G = ρc2, (2)
где G – модуль сдвига.
Кроме того, в предположении несжимаемости, которое считается справедливым для мягких тканей, таких как ткань ПЖ, модуль Юнга E прямо пропорционален модулю сдвига G:
E = 2G (1+μ) ≈ 3G = 3ρc2, (3)
где μ ≈ 0.5 – коэффициент Пуассона мягких тканей.
Следовательно, если скорость сдвиговой волны измеряется с помощью эластографических методов, можно напрямую оценить соответствующие модули сдвига и Юнга. По обеим формулам (2) и (3) модули прямо пропорциональны скорости сдвиговой волны; таким образом, чем выше ее скорость, тем выше упругость среды, в которой распространяется волна.
Помимо эмпирических данных о том, что раковая ткань ПЖ более жесткая, чем нормальная ткань ПЖ, было опубликовано множество исследований, количественно оценивающих эту жесткость.
M. Zhang и соавт. при моделировании с помощью метода релаксации напряжений вязкоупругой ткани провели исследование ex vivo ПЖ и обнаружили: средние значения комплексных модулей Юнга (|E*|) нормальной и раковой тканей ПЖ составили 15,9 ± 5,9 кПа и 40,4 ± 15,7 кПа при 150 Гц соответственно, что давало упругий контраст 2,6 : 1. Цилиндрические образцы ткани задней области предстательной железы были получены после радикальной простатэктомии. Всего было протестировано 17 образцов тканей ПЖ человека – восемь нормальных (n = 8) и девять раковых (n = 9) [5]. L. Zhai и соавт. использовали количественные методы сдвиговой эластографии на образцах ex vivo и сообщили, что модуль Юнга нормальной периферической зоны и раковой ткани ПЖ составил 12,3 ± 2,4 кПа и 30 ± 3,0 кПа соответственно [6]. Хотя жесткость в разных исследованиях различалась, в обоих исследованиях было обнаружено, что на раковых участках ткань примерно в 2,5 раза жестче по сравнению с тканью периферической зоны ПЖ.
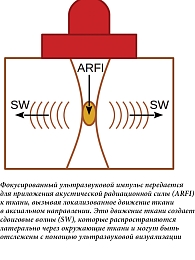
Отметим, что в последнем случае авторы использовали метод визуализации акустического радиационного силового импульса (Acoustic Radiation Force Impulse, ARFI) – метод ультразвуковой диагностики и один из вариантов эластографии, который позволяет количественно оценить механические свойства тканей. Он не требует компрессии тканей датчиком, что обеспечивает воспроизводимость результатов. В методе используется феномен радиационного давления, создаваемого ультразвуком, открытый Фарадеем еще в 1831 г. Величина силы ARFI выражается дробью:
![]()
где α – коэффициент поглощения ультразвука тканью, Нп/м; I – начальная интенсивность волны, Вт/м2;
c – ее скорость в ткани, м/с.
Параметры ультразвуковой волны подбирают так, что радиационное давление будет максимальным там, где необходимо генерировать сдвиговые волны (рис. 1).
Затем при обычном ультразвуковом сканировании анализируют продвижение сдвиговой волны, определяют ее скорость в метрах в секунду, по формулам (2) и (3) пересчитывают в модули упругости и отображают на экране в килопаскалях. Такая технология создания сдвиговых волн, использующая радиационное давление сильного сфокусированного ультразвукового импульса, получила название ARFI. Участки с различной скоростью сдвиговых волн кодируются разными оттенками серого цвета или разными цветами по шкале с определенным количеством цветовых ячеек, что дает возможность визуально выявлять зоны с разной эластичностью (С.В. Романов и соавт.) [7]. В итоге метод ARFI позволяет создать двухмерное серошкальное или цветовое изображение, отражающее пространственные различия в жесткости тканей. К слову, согласно исследованию авторов, модуль Юнга нормальных тканей простаты составлял 55–70 кПа, карциномы простаты – 90–240 кПа.
Целью исследования B. Ahn и соавт. была оценка механических свойств (упругости) нормальных и раковых тканей ПЖ и разработка карты эластичности тканей для диагностики и локализации рака простаты. В экспериментах с использованием роботизированной системы пальпации были рассмотрены в общей сложности 735 участков из 35 образцов радикальной простатэктомии, а эластичность образцов оценивалась с помощью определенного алгоритма. Оцененные эластичности из 21 области были разделены на нормальные и раковые ткани с использованием патологической информации, а карта эластичности тканей была разработана с использованием числовых функций и метода нелинейной подгонки поверхности. Средние модули упругости нормальных и раковых тканей составили 15,25 ± 5,88 кПа и 28,80 ± 11,20 кПа соответственно. Наибольшую эластичность имела область основания, за которой следовали медиальная и апикальная области. Эти результаты продемонстрировали возможность разделения раковой и нормальной тканей на основе их модулей упругости. Картирование эластичности ткани проводилось с использованием расчетной эластичности и нелинейной подгонки поверхности. Предложенная карта отображала эластичность и использовалась для оценки модуля упругости предстательной железы в любой заданной области. Авторы заявили, что эластичность ткани может быть важным индикатором рака предстательной железы (РПЖ), поскольку патологические изменения изменяют ее свойства, включая целостность клеток и межклеточный матрикс [8]. Данная работа предоставляет количественную и объективную информацию для диагностики РПЖ. Кроме того, эти результаты могут иметь значение для локализации РПЖ.
В 2020 г. B. Johnson и соавт. исследовали упругие свойства ПЖ человека и свиньи с использованием методов зондирования и испытания на неограниченное сжатие при разных скоростях нагрузки. Различий между модулем упругости, измеренным с использованием протоколов сжатия и зондирования, как для человеческих, так и для образцов ткани свиньи обнаружено не было. Модуль упругости варьировался от 0,08 МПа при 1%/с до 0,24 МПа при 25%/с для человеческих образцов ткани и от 0,2 МПа при 1%/с до 0,4 МПа при 25%/с для образцов ткани свиньи, что несколько необычно и гораздо выше обычных значений, встречающихся в литературе. Образцы ткани свиньи были значительно жестче, чем образцы ткани человека, в конечной фазе кривой напряжение-деформация. Для обоих методов испытаний наблюдалась зависимость модуля упругости от скорости деформации. Зависимость от скорости деформации достигала насыщения при высоких скоростях (свыше 100%/с). Была создана модель материала для количественной оценки этой зависимости:
![]()
где ![]() – скорость деформации, a, b, c, d – численные параметры, Eterm – слагаемое модуля, зависящее от
– скорость деформации, a, b, c, d – численные параметры, Eterm – слагаемое модуля, зависящее от ![]() .
.
Авторы декларировали, что выявленная зависимость между модулем упругости и скоростью деформации может быть применена в моделях ПЖ для понимания реакции на динамические нагрузки [9].
J. Duan и соавт. отмечали, что РПЖ – одна из самых распространенных злокачественных опухолей у мужчин и уровень заболеваемости ею растет. РПЖ имеет длительное течение и часто протекает бессимптомно на ранних стадиях, что затрудняет его дифференциацию от доброкачественной гиперплазии предстательной железы (ДГПЖ) до тех пор, пока опухоль не достигнет определенного размера и не вызовет симптомов обструкции шейки мочевого пузыря. Раннее выявление и лечение РПЖ имеют решающее значение, поскольку имеют лучший прогноз по сравнению со случаями метастазирования опухоли и значительно влияют на продолжительность жизни пациента и качество его жизни [10].
Ультразвуковая сдвигово-волновая эластография (SWE) позволяет неинвазивно оценить жесткость ткани ПЖ для диагностики РПЖ, но до сих пор не существует общепризнанного стандарта для процесса обнаружения и метода расчета значения модуля Юнга при трансректальном ультразвуковом исследовании с SWE (TSWEUI). В исследовании была разработана номограмма с использованием клинических характеристик, связанных с диагностикой РПЖ и полученных с помощью однофакторного анализа и многофакторного логистического регрессионного анализа, и было предложено считать основным информативным параметром среднее значение (m-Emax) измеренных максимальных значений модуля Юнга Emax в четырех квадрантах. В ретроспективное исследование были включены пациенты с подозрением на злокачественное заболевание ПЖ с результатами патологоанатомического исследования в больнице. Исходные характеристики 75 пациентов, прошедших TSWEUI, включая простатический специфический антиген (ПСА), PV (объем предстательной железы), количество тромбоцитов, PLR (PLR (Platelet-to-Lymphocyte Ratio – анализ, который используется как маркер системного воспаления)
и m-Emax, представлены в табл. 1. PV, ПСА и m-Emax были использованы для разработки номограммы. Номограмма могла эффективно предсказать вероятность РПЖ, тем самым, в том числе, снижая частоту пункционной биопсии для диагностики РПЖ.
Это указало на то, что m-Emax может использоваться в качестве инновационного параметра в TSWEUI для диагностики РПЖ. Метод TSWEUI более экономически эффективен, чем магнитно-резонансная томография (МРТ) при диагностике РПЖ.
При этом однофакторный анализ показал, что уровень ПСА, объем ПЖ, среднее максимальное значение модуля Юнга (m-Emax) достоверно различались в группах пациентов с доброкачественными (m-Emax = 59,02 ± 14,57 кПа) и злокачественными (m-Emax = 73,65 ± 16,18 кПа) новообразованиями (Mean ± SD).
По мнению авторов, технология SWE доказала свою эффективность в диагностике РПЖ. В ходе исследования ими был сделан вывод о том, что SWE более экономически эффективна и обеспечивает дополнительную чистую пользу для здоровья по сравнению с многопараметрической МРТ в условиях здравоохранения большинства стран [10].
SWE-изображения были получены и проанализированы в другом схожем по дизайну исследовании N. Huang и соавт. [11]. Авторы подтверждают, что трансректальная сдвиговая волновая эластография (T-SWE) может использоваться неинвазивно для диагностики РПЖ и ДГПЖ. Ткань ПЖ рассматривали как эллипсоидальную сферу с вязкоупругими характеристиками. Для характеристики мягких тканей железы использовали линейную упругую модель. Это ретроспективное исследование включало 144 пациента с подозрением на заболевание ПЖ, которые прошли T-SWE в больнице. Среднее максимальное значение модуля Юнга (m-Emax) максимального поперечного сечения ПЖ было получено путем расчета среднего значения 12 измеренных максимальных значений модуля Юнга (Emax) в четырех квадрантах. Соответственно, m-Emax статистически коррелировал с ДГПЖ (табл. 2) и РПЖ (табл. 3) и имел хорошую дискриминацию.
Была выявлена нелинейная зависимость между m-Emax и риском РПЖ, а также между m-Emax и риском ДГПЖ. При увеличении жесткости зависимость напряжения от деформации приближалась к линейной. Авторы констатировали, что m-Emax может использоваться в качестве эффективного параметра значения модуля Юнга, который представляет жесткость ткани ПЖ в T-SWE, и имеет важное значение в дифференциальной диагностике заболеваний ПЖ.
Хотя ультразвуковая визуализация ПЖ продолжает привлекать все большее внимание клиницистов, опубликовано мало данных о фундаментальных ультразвуковых свойствах тканей нормальной и патологически измененной ПЖ. В исследовании K.J. Parker и соавт. представлены данные об ультразвуковых свойствах образцов ПЖ собаки и человека, а также результаты измерений упругих свойств тканей органов. Для ПЖ человека скорость звука – 1561 ± 22 м/с, затухание – 0,78 ± 0,24 дБ/см·МГц, линейный модуль упругости – 2,15 ± 0,81 – 3,96 ± 2,16 кПа, нелинейный модуль упругости (деформация > 10%) – 17,3 ± 18,0 – 39,2 ± 9,7 кПа, гистерезис – 23 ± 8,2% [12].
Поскольку изменения жесткости ткани могут указывать на аномальный патологический процесс, параметры визуализации, связанные с эластичностью ткани, могут служить эффективным биомаркером для дифференциации нормальных и раковых тканей. Несколько выполненных исследований, включающих визуализацию эластичности патологических тканей, подтвердили эту гипотезу, например исследования, посвященные выявлению рака молочной и предстательной желез с использованием ультразвуковых методов. К. Hoyt и соавт. оценили эластичность ткани как давно используемый, но качественный биомаркер РПЖ, а соноэластографию – как новый инструмент визуализации для качественной и количественной оценки жесткости ткани ПЖ. Для характеристики данных релаксации механического напряжения, измеренных в образцах ткани ПЖ человека, использовалась вязкоупругая модель дробной производной Кельвина – Фойгта (KVFD). Результаты механических испытаний показали, что коэффициент вязкости для раковой ткани ПЖ примерно в 2,4 раза выше, чем для нормальной ткани. Также было установлено, что существует значительная разница между жесткостью нормальной и раковой тканей ПЖ (p < 0,01). Был представлен пример соноэластографии in vivo клинического исследования, который дополнительно продемонстрировал возможности визуализации ПЖ in vivo и выявления рака с использованием методов, основанных на анализе эластичности. Показано, что количественная визуализация эластичности ткани перспективна для выявления и характеристики РПЖ, а эластичность ткани является перспективным биомаркером РПЖ [13].
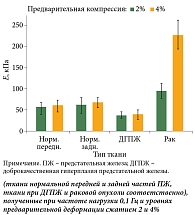
Для оценки динамического диапазона ткани, полученной с помощью эластографии, было исследовано механическое поведение образцов ткани молочной железы и ПЖ, подвергнутых компрессионной нагрузке (T. Krouskop и соавт.) [14]. Установлено, нормальная ткань ПЖ имеет модуль упругости ниже, чем модуль упругости исследованных образцов РПЖ (рис. 2). Ткань ПЖ с ДГПЖ имела значения модуля упругости значительно ниже, чем нормальная ткань. Наблюдалось постоянное, но несущественное различие в модуле упругости тканей, взятых из передней и задней частей железы. Диапазон модулей Юнга составил: для нормальной ткани железы – 55–71 кПа, при наличии ДГПЖ – 36–41 кПа, для раковой ткани – 96–241 кПа. Различия в модулях упругости различных тканей железы, по мнению авторов, могут быть полезны при разработке методов различения доброкачественных и злокачественных опухолей.
Целью исследования K.H. Kim и соавт. было изучение взаимосвязи между эластичностью ПЖ и симптомами нижних мочевыводящих путей (СНМП). С августа по декабрь 2009 г. в исследование были включены 48 пациентов без анамнеза неоадъювантной терапии или предшествующих операций на ПЖ, перенесших роботизированную радикальную простатэктомию. Для измерения эластичности тканей ПЖ использовалась новая система пальпации. Эластичность ПЖ определялась как средний модуль упругости в 21 точке задней поверхности ПЖ. Все пациенты заполняли опросник по международной шкале симптомов заболевания ПЖ перед операцией, а СНМП определялись как общий балл по международной шкале симптомов заболевания ПЖ, равный 8. Значимые симптомы нарушения мочеиспускания были выявлены с оценкой 5 на основе ответов пациентов на четыре вопроса (Q1, Q3, Q5 и Q6), а симптомы нарушения мочеиспускания были выявлены с оценкой 4 на основе ответов пациентов на три вопроса (Q2, Q4 и Q7) [15].
Медианный модуль упругости ПЖ составил 20,8 кПа (межквартильный размах 15,6–22,9), а частота СНМП и симптомов нарушения мочеиспускания была значительно выше у пациентов с модулем упругости > 20 кПа. Результаты многомерной логистической регрессии показали, что более высокий модуль упругости (как непрерывная переменная) был независимо связан с симптомами нарушения мочеиспускания (отношение шансов 1,18; p = 0,038) после коррекции с учетом возраста и объема предстательной железы. Однако модуль упругости не был независимо связан с СНМП или симптомами нарушения мочеиспускания. Установлено, что пациенты с более высокой жесткостью ПЖ более склонны к развитию СНМП. В частности, эластичность ПЖ была независимо связана с симптомами нарушения мочеиспускания.
Ультразвуковая сдвигово-волновая вязко-гиперэластография была использована в диссертационном изучении локализации РПЖ (X. Li) [16]. Модуль Юнга вязкоупругой среды рассматривался как сумма G*(ω) = Gs(ω) + iGl(ω), где ω – угловая частота, Gs(ω) и Gl(ω) – модуль упругости/накопления и модуль вязкости/потерь соответственно. Gs(ω) представляет собой способность ткани накапливать механическую энергию в виде деформации сдвига, а Gl(ω) отражает механическую энергию, рассеиваемую за счет вязкости. Модуль G*(ω) называется комплексным модулем сдвига, а отношение Gl(ω)/Gs(ω) = tgδ – тангенсом угла потерь. В обзоре литературы автор диссертации ссылается на исследования ex vivo с использованием соноэластографии и ультразвуковой визуализации эластичности (SWEI), согласно которым модуль сдвига нормальной ткани ПЖ лежит в интервале от 1,8 до 10,8 кПа (модуль Юнга от 5,4 до 32,4 кПа) [5, 13, 17, 18].
Целью исследования M. Zhang и соавт. была разработка надежного метода неинвазивной оценки инфравезикальной обструкции (ИВО), вызванной ДГПЖ. В исследовании была проведена оценка по международной шкале простатических симптомов, а также трансректальное ультразвуковое исследование (ТРУЗИ) и соноэластография сдвиговой волной (SWE) у 55 пациентов с ДГПЖ, прошедших уродинамическое исследование (золотой стандарт диагностики ИВО). Результаты показали, что модуль упругости переходной зоны был показателем, наиболее сильно коррелирующим со стадией ИВО (r = 0,666; p < 0,001), и имел наибольшую площадь под рабочей характеристикой – 0,826 (95%-ный доверительный интервал (ДИ) 0,717–0,934; p = 0,001). Модуль упругости переходной зоны ≥ 32,4 кПа или общий объем предстательной железы ≥ 54,4 мл были диагностическими показателями ИВО с чувствительностью, специфичностью, положительной прогностической ценностью, отрицательной прогностической ценностью и точностью для ИВО 97,2; 62,5; 85,4; 90,9 и 86,5% соответственно. Авторы полагают, что модуль упругости переходной зоны является перспективным показателем для оценки тяжести ИВО. Кроме того, сочетание модуля упругости и общего объема ПЖ оказалось наиболее точным показателем при неинвазивной диагностике ИВО у пациентов с ДГПЖ [19]. Результаты исследования модуля Юнга тканей ПЖ с ДГПЖ представлены в табл. 4.
В статье J. Kemper и соавт. представлены результаты измерений сдвиговой жесткости и вязкости, полученные с помощью «виртуальной биопсии» трех иссеченных доброкачественных предстательных желез человека, с использованием нового метода, известного как ультразвуковая виброметрия сдвиговой волны (SDUV) in vitro. Кроме того, измерение жесткости ткани помогает определить предполагаемый участок для биопсии, поскольку, как было показано, жесткость ткани коррелирует с патологиями, такими как рак. Что еще более важно, раннее выявление РПЖ может помочь в выборе малоинвазивной терапии и исключить инвазивные процедуры. В данной статье измерения сдвиговой упругости и вязкости с помощью SDUV проводились в выбранных подозрительных участках ПЖ. Результаты измерений эластичности и вязкости с помощью SDUV в целом согласуются со значениями, ранее опубликованными в литературе: средние значения G и η (вязкость) для трех предстательных желез варьировались от 1,31 до 12,81 кПа и от 1,10 до 6,82 Па·с соответственно. Авторы считают, что разброс этих значений мог быть обусловлен неоднородностью тканей. Однако здесь важно подчеркнуть, что полученные значения вязкоупругих параметров являлись локальными и не представляли собой среднее значение для всей ПЖ [20]. Сравнение модулей сдвига простаты авторы производили с данными G = 2,2 ± 0,3 кПа и G = 3,3 ± 0,5 кПа, полученными для центральной и периферической частей ПЖ.
Целью исследования O. Rouvière и соавт. было измерение жесткости доброкачественной и злокачественной тканей ПЖ с помощью сдвигово-волновой эластографии (SWE) [21]. В ходе исследования 30 последовательным пациентам была проведена трансректальная SWE в аксиальной и сагиттальной плоскостях перед простатэктомией. После изучения образцов простатэктомии рентгенологи измерили жесткость в областях, соответствующих раку: латеральной и срединной доброкачественной периферической зонах (PZ) и доброкачественной переходной зоне (TZ). Раковые опухоли были более жесткими, чем доброкачественные ткани PZ и TZ. Все классы тканей были более жесткими на сагиттальной, чем на аксиальной зонах, в TZ, чем в PZ, в срединной TZ, чем в латеральной PZ зонах. При многофакторном анализе характер ткани (доброкачественная или злокачественная; p < 0,00001), плоскость сканирования (аксиальная или сагиттальная; p < 0,00001) и расположение в предстательной железе (TZ, срединная PZ или латеральная PZ; p = 0,0065) достоверно и независимо влияли на жесткость ткани. На аксиальных изображениях пороги, максимизирующие индекс Юдена в TZ, латеральной PZ и срединной PZ, составляли 62, 33 и 49 кПа соответственно (А.М. Беляев и соавт.) [22]. На сагиттальных изображениях пороги составляли 76, 50 и 72 кПа соответственно. Детально результаты изучения распределения жесткости тканей железы представлены в табл. 5. Несмотря на установленные статистически значимые различия в жесткости тканей во всех зонах интереса, отметим относительно высокие значения p-value и межквартильного размаха, соответствующие переходной зоне железы.
Результаты выполненного исследования позволили авторам сделать следующее заключение: SWE позволяет различать злокачественные и доброкачественные ткани предстательной железы, а жесткость ткани зависит от плоскости сканирования и расположения в железе.
Кроме того, авторы посчитали возможным отдельно выделить следующие моменты:
- раковая ткань ПЖ более жесткая, чем ткань в доброкачественной периферической зоне;
- все классы ткани более жесткие на сагиттальной, чем на аксиальной проекции;
- все классы ткани более жесткие в переходной зоне, чем в периферической;
- все классы ткани более жесткие в срединной зоне, чем в латеральной периферической;
- учет плоскости визуализации и зональной анатомии может повысить выявляемость рака.
В связи с важными клиническими приложениями, моделирование поведения мягких тканей и изучение их механических свойств, таких как эластичность и гиперэластичность, приобрело особое значение в последнее десятилетие. Учитывая различия в механических свойствах нормальных и раковых тканей, точное моделирование механического поведения мягких тканей и определение типов тканей на основе их реакции на приложенную стимуляцию облегчает диагностику раковых тканей. Целью исследования P. Tahmasebi и соавт. было неинвазивное распознавание механического поведения ткани ПЖ и ее раковых образований [23]. В связи с этим механические параметры раковой ткани были точно оценены с помощью метода нейронных сетей на основе данных о смещениях ткани. (Данные о смещении различных тканей и соответствующих механических свойствах необходимы для разработки и обучения моделей нейронных сетей.) Для моделирования поведения ткани ПЖ и извлечения необходимых данных для обучения нейронных сетей было реализовано конечно-элементное моделирование с использованием программного обеспечения Abaqus. При моделировании поведения мягких тканей необходимо учитывать нелинейное поведение ткани. Для представления гиперэластичного поведения мягких тканей модели Огдена и Йео являются наиболее точными, и они были использованы в исследовании для построения конечно-элементной модели ткани ПЖ, содержащей опухоль (J.J. O'Hagan и соавт.; С.А. Муслов и соавт.) [24, 25, 26]. Мягкие ткани линейно реагируют на ограниченные стимуляции, поэтому в исследовании опухоль была смоделирована с использованием данных гиперэластичных моделей. Для модели опухоли Огдена:

были рассмотрены гиперэластичные параметры α = 2 и μ = E/2(1 + ν), где E и ν иллюстрируют модуль упругости (модуль Юнга) и коэффициент Пуассона опухоли соответственно. Поскольку третий инвариант деформации I3 равен 1 для несжимаемых тканей, уравнение (7) представляет собой связь между функцией энергии деформации W и гиперупругими параметрами (C10, C20 и C30) в модели Йео:

Коэффициент Пуассона мягких тканей приблизительно принимался равным 0,495 из-за их несжимаемости (С.А. Муслов и соавт.) [27]. Таким образом, параметр гиперупругости опухоли μ напрямую связан с ее модулем упругости E, и, следовательно, расчет μ приводит к оценке модуля упругости. Что касается моделируемой ткани, значение модулей упругости опухоли предполагалось в диапазоне 50–120 кПа, что включает в себя как нормальную, так и раковую ткани (T.A. Krouskop и соавт.) [14]. В модели Огдена для опухоли предполагалось 15 различных значений упругости. Кроме того, как для нормальной, так и для раковой ткани была применена гиперупругая модель Йео с параметрами, представленными в табл. 6.
В детальном обзоре техники и клинических результатов ультразвуковой эластографии отмечалось, что большое число исследований показало хорошие результаты в дифференциации доброкачественных тканей от злокачественных поражений с помощью SWE (R. Sigrist и соавт.) [29].
Correas и соавт. обследовали 184 мужчины, которым была выполнена 2D-SWE перед 12 основными секстантными биопсиями под контролем УЗИ. Пороговое значение 2D-SWE 35 кПа для дифференциации доброкачественных и злокачественных поражений простаты обеспечило чувствительность, специфичность, положительные прогностические значения (PPV) и отрицательные (NPV), площадь под ROC-кривой, которая измеряет способность модели различать между классами (AUROC), равные 96, 85, 48, 99 и 95% соответственно [30].
В исследовании, проведенном R.G. Barr и соавт., при меньшем числе пациентов (n = 53) пороговое значение 37 кПа для различения доброкачественных и злокачественных поражений обеспечило чувствительность – 96,2%, специфичность – 96,2%, PPV – 69,4% и NPV – 99,6% [31].
K. Boehm и соавт. применили пороговое значение 50 кПа, что обеспечило чувствительность и специфичность 80,9 и 69,1% соответственно. Соответствующие положительная и отрицательная прогностическая ценность составили 67,1 и 82,2% соответственно [32]. Для порогового значения 43,9 кПа S. Woo и соавт. обнаружили, что РПЖ можно предсказать с чувствительностью, специфичностью, PPV и NPV – 43,0; 80,8; 15,3 и 94,6% соответственно [33]. Хотя чувствительность и специфичность различались в разных исследованиях, все они показали высокую отрицательную прогностическую ценность, что указывает на то, что применение метода SWE может помочь сократить количество биопсий.
Количественная оценка изменений жесткости может предоставить важную диагностическую информацию и помочь в раннем выявлении рака. Эластография сдвиговой волной – это метод визуализации, который оценивает жесткость ткани с использованием силы акустического излучения в качестве альтернативы ручной пальпации, описанной ранее при квазистатической эластографии. В исследовании, проведенном R. Cao и соавт., оценивались упругие свойства материалов, имитирующих ткань, включая агар, полиакриламид (ПАА) и силикон, с целью определения характеристик материалов, которые напоминают нормальную и раковую ткани предстательной железы. Акустические свойства и жесткость фантомов, имитирующих ткань, измерялись с помощью компрессионных механических испытаний и эластографии сдвиговой волной с использованием сверхзвуковой сдвиговой визуализации. Последняя основана на принципах сдвиговых волн, генерируемых с использованием силы акустического излучения. Оценка включала использование материалов, имитирующих ткань (МИТ) ПЖ. Данные нормальной ткани и ткани РПЖ, количественно оцененные с помощью гистопатологического исследования биопсии, проведенной у пациентов, были использованы для подтверждения результатов. Результаты: значения модуля Юнга составили 86,2 ± 4,5 и 271,5 ± 25,7 кПа для ПАА, смешанного с 2% частицами Al2O3, и силикона соответственно. Модуль Юнга МИТ, определенный при механическом компрессионном испытании, показал четкую тенденцию к увеличению жесткости с увеличением содержания агара. Силиконовый материал имел более высокие значения жесткости по сравнению с ПАА, смешанным с Al2O3. Среднее значение модуля Юнга в раковой ткани составило 90,5 ± 4,5 кПа по сравнению с 93,8 ± 4,4 и 86,2 ± 4,5 кПа, полученными с помощью ПАА с фантомом 2% Al2O3 на глубине 52,4 и 36,6 мм соответственно. Авторы исследования сделали следующий вывод: ПАА, смешанный с Al2O3, является наиболее подходящим материалом для имитации ткани опухоли ПЖ, в то время как агар может служить фоном для имитации нормальной ткани ПЖ [34].
W.C. Carson и соавт. отмечали, что механические характеристики ткани ПЖ не получили должного внимания и часто не связаны с клиническими исследованиями. В связи с этим был разработан сферический индентор для клинических исследований, позволяющий получать данные о силе смещения ex vivo ткани ПЖ. Тестировали скорость, глубину и диаметр сферы индентора, а также четыре способа оценки модуля упругости. Модуль упругости оценивали для 26 образцов ткани ПЖ, полученных путем простатэктомии, и 6 образцов, полученных при аутопсии. Простатэктомированные предстательные железы оценивали клинически при пальцевом ректальном исследовании и патологоанатомически после экстирпации. Измерения всего препарата дали медианное значение модуля 43,2 кПа (SD 59,8 кПа). После разрезания на поперечные срезы медианное значение модуля для желез стадии T2 (с опухолями, ограниченными органом) и T3 (с опухолями, не ограниченными органом) составило 30,9 и 71,0 кПа соответственно, но не различалось достоверно. Кроме того, мы сравнили внутриорганную разницу в модуле Юнга для ПЖ с пальпируемыми аномалиями (медиана – 46,5 кПа, SD – 22,2 кПа) и без них (медиана – 31,0 кПа, SD – 63,1 кПа). В данной работе установлено, что ткань пораженной ПЖ более жесткая, чем нормальная ткань (разница в медианах – 49,4 кПа), жесткость увеличивается с тяжестью заболевания и существует большая вариабельность между образцами [35]. Дальнейшее исследование рака поздней стадии поможет подтвердить результаты, представленные в данной работе.
Целью исследования, проведенного Y. Ji и соавт., была оценка значения модуля Юнга, полученного с помощью трансректальной эластографии сдвиговой волной (SWE) в реальном времени для диагностики РПЖ. 215 пациентов прошли SWE в шести идентичных проекциях перед биопсией под контролем трансректального УЗИ. Модуль Юнга всей ПЖ определялся как среднее значение результатов в этих проекциях. Измерения сравнивались с результатами патологического исследования, уровнем ПСА и индексом Глисона (GS) после биопсии. Модуль упругости Юнга, включая максимальный модуль Юнга (Emax), средний модуль Юнга (Emean) и минимальный модуль Юнга (Emin), был значительно выше при злокачественных новообразованиях, чем при доброкачественных (все p < 0,05). Оптимальные пороговые значения для РПЖ составили 128,48; 62,27 и 20,03 кПа соответственно. Чувствительность составила 77,88; 81,42 и 60,18% соответственно, а специфичность – 85,33; 74,51 и 63,73% соответственно. ПСА положительно коррелировал с Emax и Emean (r = 0,686 и 0,678 соответственно), как и GS (r = 0,410 и 0,382 соответственно). Авторы декларировали, что модуль Юнга всей ПЖ можно использовать для дифференциации доброкачественных и злокачественных поражений ПЖ. Отмечены более высокий модуль Юнга упругости и более высокий риск злокачественных поражений. Между тем, более высокий модуль Юнга коррелировал с более высокими значениями ПСА и GS [36].
В медицинской диагностике использование эластографии становится все более полезным. Однако методы лечения обычно предполагают плоскостное сжатие, прикладываемое к поверхностям тканей, и измерение деформации. Распределение напряжения относительно равномерно вблизи поверхности при использовании большого плоского датчика, но постепенно расходится по глубине ткани. Обычно при эластографии ПЖ для сканирования и сжатия используются трансректальные датчики цилиндрической формы с боковым или закругленным торцевым расположением датчиков, а сила прикладывается через стенку прямой кишки. Это значительно затрудняет обнаружение РПЖ, поскольку закругленные контактные поверхности усиливают неравномерность приложенного напряжения, особенно в дистальной передней части ПЖ.
Z. Yan и соавт. разработали предварительную двумерную модель конечных элементов (FEM) для моделирования деформации ПЖ в эластографии. Модель включает однородную предстательную железу с более жесткой опухолью в проксимальной задней области. К стенке прямой кишки прикладывается сила, деформирующая предстательную железу, и распределение деформаций и напряжений можно рассчитать по полученным смещениям. Затем принимаются смещения в качестве граничных условий и восстанавливается распределение модулей (обратная задача) методом линейного возмущения. Моделирование методом конечных элементов показывает, что деформация и контраст деформаций (поражения) очень быстро уменьшаются с увеличением глубины и латерального расстояния. Следовательно, поражения не будут четко видны, если они расположены далеко от датчика. Однако реконструированное изображение модуля может лучше отображать относительно жесткие поражения, где бы они ни находились. При моделировании принимались значения модуля Юнга ПЖ: в норме – 30 кПа, раковой ткани – 90 кПа и во 2-м варианте расчетов – 40 кПа [37].
В исследование, проведенное А.В. Кадревым и соавт., было включено 96 пациентов с подозрением на РПЖ. Всем пациентам выполнялось мультипараметрическое трансректальное ультразвуковое исследование ПЖ (эластография сдвиговой волной) с последующей системной биопсией ПЖ. Для статистического анализа использовали следующие показатели модуля Юнга: 1) среднее арифметическое из трех Emean, измеренных в каждом секторе aveEmean; и 2) максимальное из трех Emean, измеренных в каждом секторе maxEmean (обозначения авторов сохранены). Было проанализировано 1308 биоптатов. По результатам морфологического исследования РПЖ был выявлен в 275 образцах (основная группа). Остальные образцы составили группу сравнения (n = 1033). Значения aveEmean и maxEmean в основной группе и группе сравнения достоверно различались (p < 0,0001). При проведении корреляционного анализа в основной группе выявлены заметные достоверные корреляции суммы Глисона, с одной стороны, и aveEmean (rS – 0,558, p < 0,0001) и maxEmean (rS – 0,548, p < 0,0001) – с другой. Чувствительность диагностического теста «aveEmean > 35,4 кПа – рак предстательной железы» (n = 1308) – 85,1%, специфичность – 85,8%, AUC – 0,908. Чувствительность диагностического теста «maxEmean > 37,9 кПа – рак предстательной железы» (n = 1308) – 88,4%, специфичность – 80,4%, AUC – 0,912. Чувствительность прогностического теста «aveEmean > 59,2 кПа – рак предстательной железы» (n = 275) (прогнозирование морфологически значимого рака предстательной железы) – 76,8%, специфичность – 77,7%, AUC – 0,807. Чувствительность прогностического теста «maxEmean > 62,7 кПа – рак предстательной железы» (n = 275) (прогнозирование морфологически значимого рака предстательной железы) – 79,3%, специфичность – 71,5%, AUC – 0,802. По мнению авторов, эластография сдвиговой волной продемонстрировала достаточно большую информативность в диагностике РПЖ [38].
При проведении лапароскопической простатэктомии существует риск повреждения сосудов и нервов, что может оказать негативное влияние на важнейшие функции мочеполовой системы, поэтому проектируемые системы для малоинвазивной хирургии должны быть апробированы на физических моделях (С.И. Бархатова и соавт.) [39]. В данной работе рассмотрены материалы, которые могут быть использованы для физического моделирования предстательной железы и окружающих ее тканей. Для некоторых из них экспериментально определены модуль Юнга, максимальное относительное удлинение при растяжении и предел прочности на разрыв. На основе полученных данных подобраны материалы для физической модели ПЖ. Авторы отмечают, что при построении физической модели приоритетным параметром является модуль Юнга на растяжение, который принят равным 62,50 ± 7,50 кПа для предстательной железы в норме и 93,30 ± 1,10 кПа при ДГПЖ. Эти данные расходятся с результатами T. Krouskop и соавт., согласно которым ткань ПЖ с доброкачественной гиперплазией имеет значения модуля упругости значительно ниже, чем нормальная ткань (36–41 кПа против 55–71 кПа соответственно) [14].
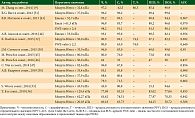
При ультразвуковой эластографии сдвиговой волной (ЭСВ) представляет интерес возможность количественной оценки показателей жесткости ткани ПЖ в реальном времени (А.С. Болоцков и соавт.). Одним из перспективных направлений использования ЭСВ является ранняя диагностика РПЖ, который в развитых странах диагностируется второй по частоте злокачественной опухолью и является третьей причиной смерти от рака у мужчин. Целью исследования явилась оценка возможности применения метода ультразвуковой ЭСВ в дифференциальной диагностике заболеваний ПЖ. Установлено, что пороговым значением жесткости для доброкачественных процессов в периферической зоне ПЖ может служить показатель E < 45 кПа. При Еmean > 70 кПа в абсолютном большинстве случаев выявлялся рак простаты [40]. М.З. Хасанов, анализируя результаты применения ультразвуковой эластографии сдвиговой волной, представил пороговые значения модуля Юнга по данным литературы [41]. Часть результатов, размещенных в таблице, прошла детальное обсуждение в данном обзоре, кроме того, часть данных была добавлена (табл. 7).
A. Saftoiu и соавторы отмечают, что в рекомендациях Европейской федерации обществ ультразвука в медицине и биологии (2019 г.) пороговое значение эластометрии для РПЖ – больше или равно 35 кПа [42].
Также в работе представлена таблица (табл. 8) диагностической информативности ДГПЖ для различных пороговых значений эластометрии сдвиговой волной (модуля Юнга).
На основании проведенных исследований М.З. Хасанов сделал вывод, что в качестве порогового значения в диагностике риска злокачественности очаговых образований периферической зоны ПЖ рекомендуется использовать значение Emean ≥ 37,8 кПа или SWE-ratio 2 ≥ 1,94. В качестве порогового значения в диагностике риска гиперплазии переходной зоны рекомендуется использовать значение Emean ≥ 30,2 кПа. В более ранних работах М.З. Хасанова проведенный статистический анализ устанавливал максимальную информативную ценность показателей эластометрии в диагностике РПЖ при значении Emean > 46,5 и SWE-ratio > 2,6 [48, 49].
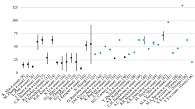
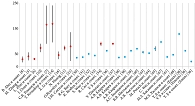
Представленные в обзоре численные данные нормальной и раковой тканей ПЖ можно видеть сгруппированными на рис. 3 и 4. Среднее значение модуля Юнга ПЖ составило 43,96 ± 8,36 кПа и 72,10 ± 19,55 кПа (M ± 95% ДИ) нормальной и раковой тканей соответственно. То есть опухолевая ткань в среднем примерно в 1,65 раза жестче нормальной. Данные из исследования B.Johnson и соавт. [9], не попавшие в обычный интервал значений модуля Юнга тканей ПЖ, было решено не рассматривать и не размещать на диаграммах.
На рисунке 5 рассмотренные в обзоре данные по модулю Юнга тканей предстательной железы представлены с помощью диаграммы Box & Whiskers, из которой тоже видно, что раковая ткань жестче нормальной (p < 0,05).
Заключение
Выполнен обзор результатов использования различных методов тестирования, включая испытания на сжатие, вдавливание и растяжение, а также некоторые косвенные методы тестирования, такие как сдвиговая волновая эластография. Результаты существенно различаются в зависимости от методов тестирования и патологического состояния ткани ПЖ. Тем не менее оценка механических свойств ткани ПЖ позволяет лучше понять патологические и физиологические изменения, происходящие в ней. Имеются убедительные доказательства значительных различий в жесткости раковой и нераковой тканей ПЖ, а также корреляции со стадией РПЖ.
Выявлено, что механические свойства ПЖ обладают большим потенциалом для углубления понимания заболеваний, которые ее поражают. Обзор показал, что существуют значительные механические различия между доброкачественной и раковой тканями ПЖ, подтверждающие известные клинические результаты, которые были воспроизведены в ряде случаев, хотя разнообразие используемых методов испытаний, включая УЗ-эластографию, испытания на растяжение и вдавливание, затрудняет использование абсолютных цифр для их однозначного сравнения и диагностики.
S.A. Muslov, PhD, Ye.A. Lapshikhina, I.A. Reva, PhD, P.Yu. Sukhochev, A.A. Solodov, PhD, S.S. Pertsov, PhD
Russian Medical University, Moscow
City Oncological Hospital No 62, Moscow
Lomonosov Moscow State University
P.K. Anokhin Research Institute of Normal Physiology, Moscow
Contact person: Sergey A. Muslov, muslov@mail.ru
Characterization of the mechanical properties of organs is important for determining their behavior under external mechanical stress, as well as for understanding and predicting their response to diagnosis and therapy. In order to properly understand behavior and develop predictive models, it is important that the method used in measuring properties is consistent with practical application, as different test methods may produce different results. The prostate gland is one of the organs for which an insufficient number of mechanical tests have been carried out. Therefore, the purpose of this article is to expand knowledge about the mechanical behavior of the prostate gland using different test methods. An analysis of the literature has been performed in which the elastic properties of the prostate gland are considered as a measure in diagnosing the risk of malignancy of focal formations in the areas of the gland. Among the diagnostic methods, the main attention is paid to ultrasonic shear wave elastography (SWE), which allows noninvasively assessing the stiffness of biological tissues of organs in normal and pathological conditions.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.