VI Всероссийский конгресс эндокринологов с международным участием «Современные технологии в эндокринологии»: От молекулярных механизмов до неврологических последствий гипергликемической памяти
- Аннотация
- Статья
- Ссылки
Официально в России зарегистрировано 3,4 млн больных сахарным диабетом. Согласно данным, опубликованным в пятом издании Атласа Международной диабетической федерации (IDF), в России проживают порядка 12,5 млн больных сахарным диабетом, еще 12 млн наших сограждан имеют нарушенную толерантность к глюкозе. Таким образом, распространенность пре- и собственно диабета в России составляет порядка 22%.
Проблема гиподиагностики сахарного диабета является чрезвычайно актуальной, особенно учитывая, что ранние поражения сосудов возникают задолго до клинических проявлений диабета. Какие патофизиологические механизмы лежат в основе развития диабетических осложнений? Возможно ли предотвратить их прогрессирование?
Когда нужно начинать лечение осложнений диабета? Какие препараты имеют доказанную эффективность в схемах патогенетической терапии диабетической невропатии? Эти и другие вопросы обсуждались участниками симпозиума «От молекулярных механизмов до неврологических последствий гипергликемической памяти», организованного компанией «Вёрваг Фарма» в рамках VI Всероссийского эндокринологического конгресса.
Официально в России зарегистрировано 3,4 млн больных сахарным диабетом. Согласно данным, опубликованным в пятом издании Атласа Международной диабетической федерации (IDF), в России проживают порядка 12,5 млн больных сахарным диабетом, еще 12 млн наших сограждан имеют нарушенную толерантность к глюкозе. Таким образом, распространенность пре- и собственно диабета в России составляет порядка 22%.
Проблема гиподиагностики сахарного диабета является чрезвычайно актуальной, особенно учитывая, что ранние поражения сосудов возникают задолго до клинических проявлений диабета. Какие патофизиологические механизмы лежат в основе развития диабетических осложнений? Возможно ли предотвратить их прогрессирование?
Когда нужно начинать лечение осложнений диабета? Какие препараты имеют доказанную эффективность в схемах патогенетической терапии диабетической невропатии? Эти и другие вопросы обсуждались участниками симпозиума «От молекулярных механизмов до неврологических последствий гипергликемической памяти», организованного компанией «Вёрваг Фарма» в рамках VI Всероссийского эндокринологического конгресса.




Профессор кафедры эндокринологии и диабетологии с курсом эндокринной хирургии ГОУ ДПО РМАПО, д. м. н. И.В. ГУРЬЕВА привела данные ФГБУ «Федеральное бюро медико-социальной экспертизы», согласно которым у 2,5% пациентов с сахарным диабетом (СД) такое осложнение заболевания, как диабетическая невропатия, приводит к инвалидности. Невропатия является наиболее важным предиктором повышенного риска смерти при интенсивной терапии диабета, что было доказано в ходе исследования ACCORD2.
При этом у пациентов с кардиальной автономной невропатией риск смертельного исхода возрастает в 1,55–2,14 раза, а в сочетании с диабетической полиневропатией – почти в три раза3. На основании данных собственного клинического опыта Ирина Владимировна констатировала, что периферическая сенсомоторная невропатия в комбинации с другими факторами риска, особенно с малыми ампутациями в анамнезе, повышает риск образования изъязвлений стоп4.
К факторам риска развития диабетической полиневропатии относят наличие у пациента сердечно-сосудистых заболеваний, артериальной гипертензии, ретинопатии, повышенный индекс массы тела (ИМТ), курение, гипергликемию, колебания уровня гликированного гемоглобина, длительность диабета. Так, согласно данным, полученным в ходе исследования ACCORD, заболеваемость диабетической полиневропатией у пациентов с СД возрастала на 1,2% в год. Интересно, что интенсивный контроль уровня триглицеридов и артериального давления не повлиял на скорость развития невропатии, хотя доказано, что гиперлипидемия и артериальная гипертензия ассоциируются с повышенным риском диабетической невропатии.
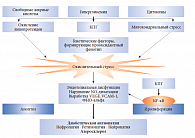
Еще один важный с точки зрения практической медицины «урок» исследования ACCORD заключается в том, что интенсивный гликемический контроль снижает риск и прогрессию невропатии при СД 1 и 2 типа. На современном этапе медицинской науки доказано: ключевая роль в патогенезе микрососудистых осложнений СД принадлежит оксидативному стрессу и повышенному образованию конечных продуктов избыточного гликозилирования (КПГ) (англ. advanced glycation end-products, AGE) (рис. 1).
Последствиями оксидативного стресса являются снижение концентрации оксида азота (NO), обладающего антипролиферативным и вазодилататорным эффектами, эндотелиальная дисфункция. При этом на фоне биохимических процессов формируется прооксидантный фенотип, являющийся генетически детерминированным. Внутриклеточная продукция КПГ изменяет транскрипцию генов, структуру белков, вызывает активацию ядерного фактора каппа-B (NF-κB), что в конечном итоге приводит к преждевременному развитию апоптоза, пролиферации и тканевым изменениям.
В последние годы сформировался новый взгляд на механизмы развития поздних осложнений диабета. Выдающий исследователь из Гейдельбергского университета Ангелика Бирхаус (Angelika Bierhaus), много лет занимающаяся биохимическими аспектами окислительного стресса, в своем выступлении на 47-м конгрессе Европейской ассоциации по изучению сахарного диабета – EASD-2011 – сформулировала «диабетический парадокс»: с одной стороны, гипергликемия является необходимым условием для развития осложнений СД, с другой – повышенным уровнем HbA1c обусловлена лишь малая доля диабетических осложнений5.
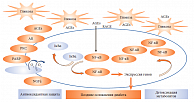
Для объяснения диабетического парадокса и поиска новых терапевтических подходов профессор А. Бирхаус предложила следующую гипотезу: необходимо соблюдать баланс между процессами образования метаболических продуктов и процессами их детоксикации. Первая часть этого уравнения хорошо известна специалистам. Основные механизмы повреждения тканей, индуцированные гипергликемией, описал Майкл Браунли (Michael Brownlee) в своей знаменитой «Бентингской лекции» (2005): активация полиолового пути метаболизма глюкозы, реализуемого через фермент альдозоредуктазу; увеличение образования конечных продуктов избыточного гликозилирования; активация протеинкиназы C; активация гексозаминового пути.
Дальнейшие исследования показали, что под влиянием повышенной внутриклеточной концентрации глюкозы происходит увеличенное образование радикала супероксида, мишенями для которого становятся нуклеиновые кислоты, белки, липиды и липопротеиды, которые, в отличие от супероксида, обладающего очень коротким периодом полураспада, нарушают работу клетки в течение продолжительного времени. Кроме того, при гипергликемии происходит гликирование митохондриальных белков, в том числе увеличение уровня метилглиоксаля. Этот побочный продукт гликолиза, вступая в реакции с белками и нуклеиновыми кислотами, образует КПГ.
Необратимость процесса формирования КПГ и неспособность, в отличие от HbA1c, хотя бы к частичному энзиматическому дегликозилированию определяют ключевую роль КПГ в развитии диабетических осложнений и объясняют развитие и прогрессирование этих осложнений независимо от текущего уровня глюкозы плазмы. Этот феномен получил название «метаболической памяти», или «эффекта наследства». Последний термин используется, когда исследователи акцентируют внимание на роли рецептора RAGE, который, связываясь с КПГ, приводит к образованию активных форм кислорода с активацией NF-κB.
В свою очередь, активация NF-κB влечет повышенную экспрессию провоспалительных цитокинов, изменяются свойства гистона и образуются новые эпигены, которые, собственно, и являются носителями метаболической памяти. Негативное действие КПГ влияет не только на стенки сосудов, но и на нейроны, то есть происходит разрушение периферических нервных волокон, как следствие, развиваются диабетическая ретинопатия, нефропатия, невропатия.
Так, в своей лекции на конгрессе EASD-2011 А. Бирхаус привела данные экспериментальных исследований, в которых изучался механизм потери болевой чувствительности при диабетической невропатии на животных моделях. При помощи метода горячей пластины в эксперименте на мышах было показано, что диабетзависимая потеря болевой чувствительности снижается при отсутствии у мышей рецептора RAGE. Это еще раз подтверждает теоретическую модель, согласно которой в условиях гипергликемии и оксидативного стресса происходит образование КПГ, что приводит к повреждению митохондриальной ДНК.
Запускаемые метаболической памятью разрушительные внутриклеточные процессы протекают на фоне частично дезактивированной антиоксидантной защиты и снижения детоксикации метаболитов (рис. 2).Современная терапевтическая стратегия, по мнению профессора И.В. Гурьевой, должна строиться на своевременной диагностике диабетической невропатии, патогенетическом и симптоматическом (противоболевом) лечении и профилактике поражения стопы.
Диагноз диабетической полиневропатии устанавливается при наличии симптомов заболевания (боль, жжение, онемение, парестезии – оцениваются по шкале общей невропатической симптоматики TSS – Total Symptom Score), неврологического дефицита (нарушения вибрационной, температурной, тактильной чувствительности, рефлексов и силы мышц – оцениваются по шкале невропатических симптомов нижних конечностей NIS-LL – Neuropathy Impairment Score of Low Limbs) и поражения функции периферических нервов (определяется на основании электромиографии и исследования нервной проводимости).
Как известно, периферический нерв состоит из толстых и тонких нервных волокон. Для ранней стадии диабетической полиневропатии характерно поражение преимущественно тонких волокон, поэтому, по мнению докладчика, для раннего выявления невропатии в клиническую практику целесообразно внедрять специализированные методы исследования состояния тонких нервных волокон – оценку интраэпидермальной плотности нервных волокон (ИЭПНВ) и конфокальную микроскопию (ККМ). Основные стратегии лечения диабетической полиневропатии предполагают:
- контроль гликемии и колебаний уровня HbA1c;
- диетотерапию, физические нагрузки, изменение образа жизни;
- патогенетическую терапию с использованием антиоксидантов (препараты альфа-липоевой кислоты, например Тиогамма), активаторов транскетолазы (Мильгамма композитум), антигипоксантов;
- симптоматическую (противоболевую) терапию (по показаниям);
- уход за стопой (при наличии факторов риска);
- психологическую поддержку.
Профессор И.В. Гурьева особо подчеркнула необходимость компенсации основного заболевания – сахарного диабета. При этом очень важно создание такого гликемического профиля, при котором показатели гликемии будут находиться в диапазоне допустимых минимальных и максимальных значений, а показатель среднего уровня HbA1c будет соответствовать подобранной для конкретного пациента индивидуальной цели. Таким образом, контроль гликемии и ее вариабельности является необходимым условием терапии диабетических осложнений.
Однако даже на фоне компенсированного СД запущенные ранее хронической гипергликемией и поддерживаемые метаболической памятью патологические процессы способствуют прогрессированию диабетических осложнений. В этой связи патогенетической можно назвать такую терапию диабетической полиневропатии, которая бы «блокировала» метаболическую память. Антиоксиданты связывают избыточно образующиеся при окислительном стрессе свободные радикалы, тем самым предотвращается нарушение функции главного антиатерогенного вещества эндотелия сосудов – оксида азота.
«Альфа-липоевая кислота, вводимая внутривенно, – единственное патогенетическое лечение, эффективность которого доказана в нескольких рандомизированных контролируемых клинических исследованиях и подтверждена метаанализом (уровень доказательности А)1, – подчеркнула профессор И.В. Гурьева. – Более того, в нескольких недавно завершившихся исследованиях показано, что альфа-липоевая кислота купирует болевой синдром и наряду с трициклическими антидепрессантами, селективными антагонистами обратного захвата серотонина и норадреналина, антиконвульсантами, опиатами и стабилизаторами нейрональных мембран показана для симптоматического лечения болевой диабетической невропатии»6.
На сегодняшний день важное место в патогенетической терапии диабетической полиневропатии занимает также применение препаратов витаминов группы В. Восполнение наблюдаемого при СД дефицита тиамина (активатора транскетолазы – фермента, катализирующего неокислительную стадию пентозофосфатной реакции) позволяет блокировать три патологических пути – гексозаминовый, путь протеинкиназы С и путь формирования КПГ. Доказанной эффективностью в лечении диабетической невропатии обладает жирорастворимое производное витамина B1 – бенфотиамин.
В качестве примера докладчик сослалась на результаты исследования BENDIP (BENfotiamine in Diabetic Polyneuropathy study), в ходе которого было продемонстрировано положительное дозозависимое влияние бенфотиамина на уменьшение боли и сенсорного дефицита. Наиболее выраженное улучшение показателей по шкале общей невропатической симптоматики (TSS) отмечено в группе пациентов, принимавших бенфотиамин в дозе 600 мг/день, эффект нарастал по мере увеличения продолжительности лечения (рис. 3).
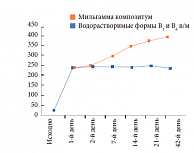
Профессор И.В. Гурьева также привела данные исследования, проведенного О.А. Маркиной на кафедре эндокринологии и диабетологии РМАПО7. Участники исследования были разделены на 3 группы: пациенты группы А получали Мильгамму композитум (100 мг бенфотиамина и 100 мг пиридоксина) по 1 драже 3 раза в день в течение 6 недель, пациенты группы В – плацебо, пациенты группы С – инъекционные водорастворимые формы витаминов В1 и В6.
Результаты исследования показали: в отличие от пациентов, получавших водорастворимые формы витаминов В1 и В6, в группе терапии препаратом Мильгамма композитум достигнута более высокая плазменная концентрация тиамина (в 1,7 раза выше у бенфотиамина + пиридоксин по сравнению с тиамина гидрохлоридом (p < 0,02) в конце исследования). При приеме Мильгаммы композитум с 14-го дня исследования концентрация тиамина в плазме достоверно (p < 0,01) превышала таковую на фоне терапии водорастворимыми препаратами (рис. 4).
На фоне шестинедельной терапии препаратом Мильгамма композитум у больных СД с диабетической полиневропатией отмечены положительные изменения по всем параметрам шкалы NIS-LL: -59% в группе Мильгаммы композитум (для сравнения: -14% в группе тиамина гидрохлорида и -3% в группе плацебо). Улучшилась и автономная иннервация: отмечено уменьшение тахикардии, увеличение вариабельности сердечного ритма и других показателей.
В заключение профессор И.В. Гурьева отметила, что применение альфа-липоевой кислоты и нейротропных комплексов (Мильгамма композитум) имеет важное клиническое значение, поскольку является эффективной патогенетической и симптоматической терапией болевой диабетической полиневропатии и характеризуется высоким профилем безопасности.
Несмотря на то что полиорганность поражений и многообразие проявлений ДАН вызывают определенные трудности при диагностике и лечении этого осложнения СД, следует помнить: ДАН снижает качество жизни пациента и ухудшает прогноз заболевания. Важно как можно более раннее выявление ДАН, поскольку патогенетическая терапия наиболее эффективна на начальных стадиях ДАН, когда поражение нервных волокон носит обратимый характер8.
Кардиоваскулярная автономная невропатия (КАН) проявляется в виде синусовой тахикардии в состоянии покоя, безболевого инфаркта миокарда, ортостатической гипотензии и синдрома внезапной смерти. КАН встречается у 25% больных СД, половина из них погибают в течение первых 2,5 лет после установления диагноза. Симптомы КАН зависят от степени выраженности поражения парасимпатического и симпатического отделов ВНС. Парасимпатическая нервная система при СД поражается раньше, чем симпатическая, поэтому начальным признаком КАН является тахикардия покоя. При поражении симпатической нервной системы может ухудшаться толерантность к физической нагрузке, поскольку не происходит повышения сердечного выброса и увеличения мышечного кровотока. Тяжелые нарушения в кардиоваскулярной системе могут проявляться атипичным течением инфаркта миокарда, фиксированным сердечным ритмом (состояние аутосимпатэктомии, денервационной гиперчувствительности к катехоламинам вследствие дегенерации симпатических нервов).
Для диагностики КАН наиболее часто используется ортостатическая проба (при перемене положения тела с горизонтального на вертикальное отмечается снижение систолического артериального давления (АД) более 30 мм рт. ст.), проба Вальсальвы (отсутствие увеличения частоты сердечных сокращений (ЧСС) при натуживании более чем на 10 уд/мин). В качестве дополнительных диагностических методов рекомендованы суточное мониторирование АД (отсутствие ночного снижения), холтеровское мониторирование ЭКГ (разница между ЧССmax и ЧССmin в течение суток менее 14 уд/мин), а также ЭКГ в пробе Вальсальвы (отношение RRmax/RRmin менее 1,2).
Гастроинтестинальная форма ДАН может вовлекать все отделы желудочно-кишечного тракта (ЖКТ), проявляется дисфункцией пищевода, гастропарезом (в виде тошноты, рвоты, чувства раннего насыщения, диффузной боли в области эпигастрия, потери веса), замедленной эвакуацией желудочного содержимого, атонией желчного пузыря, диабетической энтеропатией, запорами и недержанием кала. Применяются следующие методы диагностики гастроинтестинальной формы ДАН: рентгенография ЖКТ с использованием бария (атония, вялая перистальтика желудка, длительная задержка контрастной пищи), эзофагогастродуоденоскопия (остатки съеденной накануне пищи, слизи, жидкости), динамическая сцинтиграфия и электрогастрография (в качестве дополнительных методов). «Нарушение моторно-эвакуаторной функции ЖКТ не позволяет прогнозировать повышение концентрации глюкозы после приема пищи, поэтому такие пациенты имеют высокий риск гипогликемических состояний», – комментирует Елена Валерьевна.
Урогенитальная форма ДАН характеризуется нарушением эректильной функции, ретроградной эякуляцией, дисфункцией мочевого пузыря, нередко сопровождается восходящей мочевой инфекцией. По мере прогрессирования заболевания отмечается затруднение мочеиспускания. Чаще всего пациент жалуется на тяжесть внизу живота, исчезновение ощущения наполненного мочевого пузыря, императивные позывы на мочеиспускание, нарушение оттока мочи, неполное опорожнение мочевого пузыря, недержание мочи. «Ощущение наполнения мочевого пузыря и его сокращение регулируются парасимпатическими нервами, расслабление непроизвольных сфинктеров мочевого пузыря – симпатическими нервами. Их повреждением обусловлены клинические проявления урогенитальной формы ДАН», – говорит профессор Е.В. Бирюкова.
Для диагностики заболевания используются инструментальные методы – ультразвуковое исследование (УЗИ) мочевого пузыря (увеличение объема остаточной мочи), цистоскопия (субклиническое увеличение мочевого пузыря), урофлоуметрия, ультразвуковая допплерография (УЗДГ) и дуплексное сканирование сосудов полового члена. ДАН имеет также и дерматологические «маски»: нарушается функция потоотделения, наблюдается сухость кожи, что способствует образованию трещин. ДАН является причиной повышенного кровотока в системе поверхностных кожных сосудов (постоянно повышенной температуры поверхности стоп).
Основой лечения диабетической автономной невропатии является достижение целевых показателей гликемии. Патогенетическое лечение включает препараты нейрометаболического ряда. Из сердечно-сосудистых проявлений чаще всего требует лечения ортостатическая гипотония, при которой рекомендована богатая солью диета, фторсодержащие кортикостероиды (9-альфа-фторкортизол), эластическая компрессия нижних конечностей, сон с приподнятым на 5–20 градусов головным концом, медленное поэтапное вставание с постели, при тахикардии – низкие дозы кардиоселективных бета-адреноблокаторов.
При гастроинтестинальной форме ДАН назначается дробное питание малыми порциями (в случае замедления эвакуации кишечника предпочтение следует отдать жидкой, мягкой пище с низким содержанием клетчатки), меняется режим введения болюсного инсулина (инсулин короткого действия перед едой или аналог инсулина ультракороткого действия через 20 минут после приема пищи). Дополнительно могут быть назначены прокинетики, влияющие на восстановление нормальной скорости эвакуации пищи. При диагностике гастропареза следует отменить эксенатид, блокаторы кальциевых каналов и антихолинэстеразные препараты. Лечение урогенитальной формы ДАН предполагает соблюдение строгого режима мочеиспускания (каждые 2 часа), терапию антихолинэстеразными средствами, а при мочевой инфекции следует назначить антибактериальную терапию.
Профессор Е.В. Бирюкова более детально остановилась на патогенетической терапии ДАН нейрометаболическими препаратами. «При поражении вегетативной нервной системы оправдано использование нейрометаболической терапии, в частности, препаратов, содержащих бенфотиамин и пиридоксин», – отметила профессор Е.В. Бирюкова. Бенфотиамин подавляет невропатическую боль, блокирует образование КПГ путем активации транскетолазы, улучшает энергетические процессы в нервной ткани (синтез АТФ). Пиридоксин усиливает действие антиноцицептивных медиаторов (норадреналина и серотонина), блокирует образование КПГ путем нейтрализации метилглиоксаля, улучшает синтез протеинов – структурных элементов нервного волокна.
Одним из наиболее широко применяемых препаратов, содержащих бенфотиамин и пиридоксин в терапевтических дозах (по 100 мг), является Мильгамма композитум. Докладчик представила участникам симпозиума результаты проведенного С.В. Воробьевым и соавт. (Ростов-на-Дону) исследования эффективности метаболического препарата Мильгамма композитум и антиоксиданта Тиогаммы в лечении больных с диабетической автономной невропатией9. В исследовании приняли участие 103 пациента в возрасте 36–72 лет: из них 10 человек имели нарушенную толерантность к глюкозе (НТГ), 80 – СД 2 типа средней продолжительности 7,36 ± 0,41 года.
Диагноз автономной невропатии ставился при выявлении ее кардиоваскулярной формы методом кардиоинтервалографии. В группу 1 вошли 27 человек без электрофизиологических признаков автономной невропатии, в группу 2 – 76 пациентов с КАН. Для определения связи дисфункции желчевыводящих путей с гастроинтестинальной формой ДАН исключались сопутствующие заболевания ЖКТ, оценка функции желчевыводящих путей выполнялась при проведении ультразвуковой динамической холецистографии.
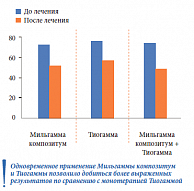
Пациентам с диагностированной КАН назначили патогенетическую терапию в течение 3 месяцев и в зависимости от ее видов разделили на 3 подгруппы: 1-я подгруппа (n = 27) получала монотерапию препаратом Мильгамма композитум по 1 драже 3 раза в день, 2-я подгруппа (n = 26) – монотерапию препаратом Тиогамма в дозе 600 мг/сут по стандартной схеме, 3-я подгруппа (n = 23) – комбинацию препаратов Мильгамма композитум + Тиогамма по описанным выше схемам. После курса патогенетической терапии улучшение самочувствия и субъективных проявлений КАН отметили 59% больных, получавших Мильгамму композитум, 62% – Тиогамму и 78% – оба препарата.
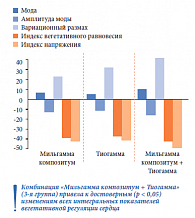
Анализ динамики показателей кардиоинтервалографии показал: на фоне комбинированной терапии нейротропным комплексом с тиоктовой кислотой отмечено достоверное изменение показателей вегетативной регуляции (индексы напряжения и вегетативного равновесия) и моды (преобладающая продолжительность кардиоинтервала), наиболее выраженно улучшились показатели вариационного размаха и амплитуды моды, снизился индекс напряжения (рис. 5).
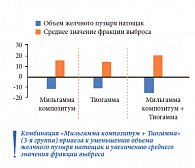
В ходе исследования было также показано, что в группе комбинированной терапии (Мильгамма композитум + Тиогамма) отмечались самые высокие показатели уменьшения объема желчного пузыря натощак и увеличения среднего значения фракции выброса (рис. 6). Одновременное применение Мильгаммы композитум и Тиогаммы позволило добиться более значительного снижения частоты дискинезии желчевыводящих путей по гипокинетическому типу по сравнению с монотерапией Тиогаммой (рис. 7).
Результаты исследования позволили сделать следующие выводы: применение комбинации «Мильгамма композитум + Тиогамма» позволяет добиться более значительного и выраженного эффекта при кардиоваскулярной автономной невропатии и дисфункции желчного пузыря. В конце своего выступления профессор Е.В. Бирюкова напомнила, что патогенетическую терапию ДАН следует назначать на ранних стадиях, когда возможно добиться обратного развития симптомов заболевания.
Доклад старшего научного сотрудника ФГБУ ГНЦ «Лазерная медицина» ФМБА РФ, к. м. н. А.Н. БЕГМЫ был посвящен практическим аспектам диагностики и ведения пациентов с синдромом диабетической стопы. Стопа является основным участком человеческого тела, осуществляющим функцию опоры, поэтому при сочетании поражений нервов и сосудов, вызванных диабетом, подвержена различным травмам. К тому же стопа – наиболее удаленный от сердца орган, этим обусловлено недостаточное кровоснабжение стопы уже при минимальном поражении сосудов.
Согласно данным международных экспертов, ежегодно в мире проводится 1 млн ампутаций, при этом до 70% всех ампутаций нижних конечностей связано с диабетом. В течение жизни у 8–15% больных диабетом образуются язвы стоп. Изменения, лежащие в основе синдрома диабетической стопы, развиваются по двум вариантам: атеросклеротическое поражение периферических артерий и поражение периферических нервов. В структуре хронических заболеваний нижних конечностей доля диабетической ангиопатии составляет 6%. Риск возникновения язвенных дефектов стоп увеличивается при сочетании патологии периферических сосудов и периферической невропатии.
Диабетическая полиневропатия у больных сахарным диабетом (СД) развивается спустя 5–8 лет от начала заболевания, а при недостаточной его компенсации – через 1,5–2 года. При невропатии происходит снижение или наблюдается отсутствие чувствительных функций периферических нервов. Прежде всего выходит из строя болевая сигнальная система, а также тактильная и температурная, что обозначается термином «отсутствие защитной чувствительности» и является основным фактором риска развития язвы стопы. Потеря «защитной чувствительности» чревата травматизацией стопы.
Наиболее тяжелым проявлением невропатии, характеризующимся деструкцией кости и сустава, является диабетическая остеоартропатия (синдром Шарко). Распространенность диабетической остеоартропатии (ДОАП) среди всех больных СД не превышает 1%. Однако в связи с разрушением костно-связочного аппарата стопы данное осложнение нередко приводит к развитию гнойно-некротического процесса, потере функциональных способностей нижних конечностей, тяжелой инвалидизации и стойкой утрате трудоспособности.
«Золотым стандартом» оценки функции нервных волокон считается электронейромиография (ЭНМГ). Диагностика диабетической невропатии осложняется тем, что незначительные отклонения в одном или двух инструментальных тестах могут обнаруживаться и у здоровых людей. По данным международных экспертов, 85% ампутаций нижних конечностей можно предотвратить. Для достижения этой цели необходим, в первую очередь, скрининг больных группы высокого риска, организация «школ диабетической стопы» с обучением больных осмотру стопы, уходу за стопой и подбору обуви. Один из основных моментов – это обучение врачей первичного звена, родственников больных, активная профилактика развития язвы стопы и мультидисциплинарный подход к лечению.
Междисциплинарная помощь заключается в координированной работе диабетолога и хирурга-ортопеда, диабетологической сестры, подиатра и ортезиста в тесной кооперации с сосудистым хирургом. Она должна быть трехуровневой: первый уровень подразумевает помощь врачей общей практики амбулаторного звена, второй – диабетологов, хирургов, подиатров в кабинетах «Диабетическая стопа», третий – помощь пластических и сосудистых хирургов, ортопедов, эндокринологов на базе специализированного госпитального центра. По мнению докладчика, существует четкая взаимосвязь между внедрением мультидисциплинарного командного принципа организации помощи больным с диабетическими язвами стоп и снижением числа ампутаций конечностей.
Базовые принципы лечения, направленного на сохранение конечности, предполагают нормализацию углеводного и липидного обменов, лечение невропатии, стабилизацию артериального давления, адекватную антибактериальную терапию, купирование критической ишемии, местное лечение раны и разгрузку конечности.
В последние годы особое место в лечении диабетической полиневропатии занимает нейротропная терапия. К одним из наиболее эффективных нейротропных комплексов относятся Мильгамма и Мильгамма композитум. Инъекции Мильгаммы (в 1 ампуле содержится 2 мл раствора: 100 мг тиамина, 100 мг пиридоксина, 1000 мкг цианокобаламина и 20 мг лидокаина) показаны на первом этапе терапии диабетической невропатии, курс составляет 10 ежедневных внутримышечных инъекций. Драже Мильгамма композитум (по 100 мг бенфотиамина и пиридоксина) назначается в качестве поддерживающей терапии для усиления и пролонгирования эффекта инъекций Мильгаммы (6 недель по 1 драже 3 раза в сутки).
В качестве примера исследования эффективности препаратов Мильгамма и Мильгамма композитум в лечении язвенных дефектов у больных с синдромом диабетической стопы Андрей Николаевич Бегма привел результаты рандомизированного открытого проспективного исследования, проведенного на базе отделения эндокринологии ЦКБ № 2 им. Н.А. Семашко ОАО «РЖД»10. В исследовании участвовали 54 пациента с невропатической формой синдрома диабетической стопы и язвенным поражением, которые были рандомизированы на 2 группы. Больным 1-й группы назначалась базовая терапия, больным 2-й группы – последовательно Мильгамма по 2 мл в/м ежедневно в течение 10 дней с последующим переводом пациентов на пероральный прием препарата Мильгамма композитум по 1 драже 3 раза в день в течение
6 недель.
«Распространенность и глубина язвенных дефектов оценивались по Вагнеру. В наше исследование включены те пациенты, язвенный дефект которых оценен как Вагнер 1–2. Невропатия оценивалась по шкале Нейропатического дисфункционального счета (НДС, англ. Neuropathy Dysability Score). При этом вибрационная чувствительность определялась с помощью градуированного камертона в стандартных точках (медиальная лодыжка и основание первого пальца)», – рассказывает А.Н. Бегма. Тактильная чувствительность определялась с помощью стандартизированного 10-граммового монофиламента. Температурную чувствительность исследовали стандартным цилиндром тип-терм.
Изменение болевой чувствительности определяли иглой. Сухожильные коленный и ахиллов рефлексы определялись неврологическим молоточком. В исследование включались пациенты со значением НДС от 14 баллов и выше, то есть с выраженной невропатией. Всем пациентам проводилось допплерографическое исследование сосудов нижних конечностей, кровоток на периферии оценивался по плече-лодыжечному индексу (ПЛИ). В исследование не включались пациенты с уровнем ПЛИ < 1,00. У всех исследуемых определяли уровень компенсации углеводного обмена измерением уровня сахара крови стандартной методикой 6 раз в сутки. Скорость закрытия язвенного дефекта определялась по расчету его площади и глубины в миллиметрах 1 раз в 10 дней в течение 7 недель.
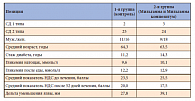
В исследование включались пациенты с ранами площадью > 30 мм2. Площадь раны и ее изменения на фоне лечения оценивались количественно с помощью прозрачной пленки в начале, после 3 недель лечения и в конце исследования. Клинические и лабораторные исследования проводили до, во время и после проведенного курса лечения. Оценку невропатии проводили дважды: до и после лечения. Характеристика пациентов представлена в таблице 1.
Комплексное лечение включало в себя деэскалационную антибактериальную терапию (1–2 препарата) с учетом определения чувствительности микрофлоры при микробиологическом исследовании посева из раны, компенсацию углеводного обмена, разгрузку пораженной конечности, перевязки с гидрофильными мазями и антисептическими растворами. Больным 2-й группы назначался препарат Мильгамма по 2,0 мл в/м ежедневно в течение 10 дней с последующим переводом пациентов на пероральный прием Мильгаммы композитум по 1 драже 3 раза в день в течение 6 недель.
При сравнении результатов лечения статистически достоверно уменьшились сроки раневого процесса в 1-й (фаза экссудации) и во 2-й (фаза грануляции) фазах, отмечено улучшение общего самочувствия больных в группе терапии Мильгаммой и Мильгаммой композитум по сравнению с пациентами группы контроля.
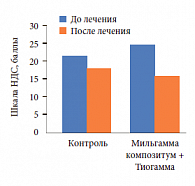
При оценке невропатии по шкале НДС в 1-й группе количество баллов к концу лечения снизилось на 3,5, а во 2 группе – на 8 баллов (рис. 8). Если в контрольной группе очищение раны наступало лишь к 22–27-м суткам, то в группе терапии Мильгаммой и Мильгаммой композитум раны очищались уже через 9–15 дней, то есть скорость заживления ран возрастала примерно в 1,5 раза. Кроме того, у больных во 2-й группе раньше начиналась 3-я фаза раневого процесса (фаза эпителизации), примерно на 11–14-е сутки. Доля полностью заживших за 7 недель язв составила 31% в 1-й группе и 54% во 2-й группе.
«Таким образом, комплексное лечение язвенных дефектов стоп у больных с синдромом диабетической стопы, включающее препараты с нейротрофопротекторным действием (Мильгамма и Мильгамма композитум), не только уменьшает проявления невропатии, но и ускоряет течение раневого процесса и длительность заживления ран», – констатировал А.Н. Бегма, завершая выступление.
Заключение
